真空热处理的工艺参数主要有淬火温度、真空度、淬火冷却介质、回火温度以及硬度等,在热处理过程中应根据材料、热处理技术要求、零件的形状、放置方式等进行合理地选择,尤其要注意升温速度对零件质量的影响。真空热处理与其他类型的热处理相比,具有其他热处理方法无法比拟的优点,其特点见表9-12。表9-12零件真空热处理特点(续)一般的真空热处理工艺曲线如图9-12所示。图9-12 真空热处理工艺曲线......
2025-09-30
第一章 真空基础知识
第一节 真空的概念
一、大气压力
地球周围的大气层是上疏下密的,其疏密之间以及在大气层的上面没有明显的分界,一般根据密度的概念粗略地说,可以认为有16km厚。虽然空气很轻,但这么巨大厚度的总重就很可观,它对地球海平面每平方厘米施加的压力有1.0332kg,相当于760mmHg在同样面积上的压力。我们通常把这个压力叫做“1标准大气压(≈1.013×105Pa)”。
二、真空
真空这一术语译自拉丁文vacuo,其意是虚无。其实,真空应理解为气体较稀薄的空间。在给定的空间内,低于一个大气压力的气体状态,统称为真空。即气体分子密度大大低于该地区大气压下的气体分子密度状态。不同的真空状态,就意味着空间具有不同的分子密度。例如在0℃时,760Torr时的标准状态下,每立方厘米中的分子数为2.687×1019个,在真空度为10-3Torr时,每立方厘米中的分子数为3.5×1013个,而在真空度为10-6 Torr时,则每立方厘米中的分子数为3.24×1010个。由此可见,在真空状态下仍然还有大量的气体分子存在,只不过要比大气状态稀薄得多。
真空状态与大气状态相比,其主要特点:
(1)单位体积中气体分子数目较少;
(2)在气体内部,气体分子之间的相互碰撞次数较少;
(3)气体分子撞击容器壁表面的次数较少。
真空状态下气体的稀薄程度称为真空度,通常用压力值表示。
三、真空度及其单位
为了衡量所获得的真空状态,在真空技术中采用“真空度”这个名词来表示气体稀薄的程度,也就是气体压强的高低。气体越稀薄,其压强越低,表示真空度越高;反之,气体压强越高,表示真空度越低。在实际应用中,“低压强”与“高真空”是同义的。
在不同的科学技术范围内,习惯采用的压强单位往往也不相同。一般有如下几种。
1.mmHg
这是真空技术中常用的单位。它是指0℃时,1mm高的纯Hg作用在单位面积上的压力。因为纯汞0℃时的比重是13.5951g/cm3,所以,1mmHg=13.5951g/cm2。
历史上曾经把北纬45°海平面的大气压定为一个物理标准大气压,它是760mmHg。由于自然界每时每刻都在变化运动,该地区的气压不可能一点没有变化,这样的标准当然是不够严谨的,因此,目前把1个国际物理标准大气压固定为如下数值:
1atm(标准大气压)=1013250dyn(达因)/cm2
这是把760mmHg,根据0℃时汞的比重为13.5951g/cm3,该处的重力加速度为980.665cm/s2,换算出来并省略尾数而制订的。因此,它已不完全等于760mmHg。
2.Torr(托)
2025年,第一届国际技术会议决定采用Torr(托)作为测量真空度的单位,以代替“mmHg”。Torr是真空技术中最常用的单位,其定义为:
![]()
根据上述定义,1Torr与1mmHg在数值上的差异小于七百万分之一,因此,在工程应用上可以认为:
1Torr≈1mmHg
在真空测量中,真空度小于0.1Torr的情况较多,用小数点表示很不方便,习惯上用负指数表示,如0.005Torr=5×10-3 Torr。根据负指数的大小,可以清楚地区分真空度的高低。
3.μbar(微巴)
在厘米—克—秒绝对单位制中,其基本单位为dyn/cm2。
1μbar(微巴)=1dyn/cm2=7.5006×10-4Torr
4.Pa(帕斯卡)
它是目前国际上推荐在真空技术中使用的标准国际单位(米—千克—秒)制,简称“帕”,2025年在第十四届国际计量大会上正式批准采用。国际计量委员会还建议最好避免使用“Torr”等压强单位。
为了照顾原有习惯,本书仍将“Torr”的换算关系列入其中。
![]()
工程应用上可近似地认为:
1Pa≈7.5×10-3Torr
1Torr≈133Pa
除此之外,工程上常用的压强还有大气压(kg/cm2)、英寸汞柱(inchHg)、普西(Psi,磅/英寸2)等,后二者为英制单位。各常见压强单位之间的换算见表1-1。
表1-1 工程压力单位换算表

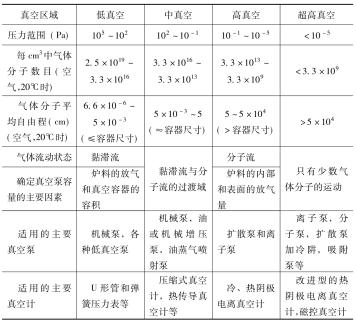
四、真空区域的划分
目前,真空技术设计的压强已宽达16个数量级以上,为了实际应用的方便,国内通常根据低气压的不同范围,把真空划分为如下五个区域。
粗真空:小于105~1.33×103Pa(760~10Torr)。
低真空:1.33×103~1.33×10-1Pa(10~10-3Torr)。
高真空:1.33×10-1~1.33×10-6Pa(10-3~10-8Torr)。
超高真空:1.33×10-6~1.33×10-10Pa(10-8~10-12Torr)。
极高真空:小于1.33×10-10Pa(10-12Torr)。
这种划分方法的主要依据如下:
(1)气体在不同压强下的性质。随着真空度的提高,气体变稀,气体的运动物理特性就会逐渐变化。如当压强为760× 133~1330Pa时,气体的性质与一般大气还没有显著差别,气体的流动性质属于黏滞流,即气体在管道内的流动与黏滞液体相类似。压强为1330~0.133Pa时,气体的流动性质已属于从黏滞流到分子流的过渡流,此时,气体的导电现象已开始发生。压强为0.133~0.00133Pa时,气体的流动性质为分子流。(https://www.chuimin.cn)
(2)常用真空泵和真空计的工作范围。如压强为1330~ 0.133Pa时,正好是一般机械真空泵和热导式真空计的工作范围,压强为0.133~133×10-5Pa时,所采用的真空测量仪表为电离真空计,而133×10-6Pa则是高真空油扩散泵所能达到的极限真空。
(3)真空技术应用的特点。不同的真空范围有它不同的应用特点。如真空输送、过滤、成型,加速蒸发过程的真空浓缩,一般有1330Pa以上的真空度就够了;真空干燥、冷冻干燥、真空浸渍需几百Pa到0.133Pa,真空热处理通常在4~133×10-6 Pa之间。
表1-2是国内真空区域的划分以及各真空区域主要使用的真空测量仪表和真空泵。
表1-2 各真空区域的压力值及有关特点
第二节 真空状态下的特点
一、理想气体状态方程及其基本定律
在平衡状态下,对于某一个容器内具有一定质量的气体,可由压强、体积和温度这三个参数来表示,即理想气体状态方程:
![]()
式中:p为压强;V为体积;M为气体质量;μ为气体分子量;T为绝对温度(K);R为气体普适常数,对任何气体都等于62.36Torr·L/K·g分子。
在真空技术领域,低气压气体与理想气体很相近,所以,低气压气体一般都可以应用理想气体状态方程。根据这个方程,对于气体的p、V、M、T四个参量,只要已知其中任何三个参量,便可求出第四个参量,而且还可以推导出在不同条件下的三个气体基本定律。
(1)波义耳定律。一定质量的气体,如果其温度保持不变,气体的压强和体积的乘积为常数,即
pV=常数
(2)盖·吕萨克定律。一定质量的气体,如果保持其压强不变,气体的体积与其绝对温度成正比,即
![]()
(3)查理定律。一定质量的气体,如果保持其体积不变,气体的压强同其绝对温度成正比,即
![]()
此外,理想气体还有一条很重要的定律,即阿佛加德罗定律:等体积的任何种类的气体,在同温度同压强下均有相同的分子数。1g分子的任何气体所占有的体积为22.4L,其中所含的分子数——阿佛加德罗常数为6.02252×1023个。
一般应用的气体是几种气体的混合体,因此,还要用到另一条重要的定律,就是道尔顿定律:相互间不起化学作用的混合气体的总压强等于各气体分压强之和。分压强是指各气体单独存在并占有混合气体的原有体积时所具有的压强。即
p=p1+p2+…+pn
式中:p为混合气体的总压强,p1、p2…pn为各气体的分压强。
二、气体分子平均运动速度和平均自由程
气体是由许多自由运动的分子组成的。由于气体分子间的相互碰撞以及气体分子与容器壁的碰撞,使气体分子热运动十分杂乱,每一个分子的速度都在不断地变化且各不相等。在真空技术中,常用算术平均速度![]() 和均方根速度Vs表示。
和均方根速度Vs表示。
(1)算术平均速度。将气体所有分子速度相加,然后被分子总数除,所求得的平均值就是算术平均速度。
![]()
(2)均方根速度。将气体所有分子速度相加,然后被分子总数除,再开方所求得的平均值就是均方根速度。
![]()
从上述各式中可以看到,气体分子热运动速度与绝对温度的平方根成正比,与气体分子质量的平方根成反比。
一个气体分子与其他气体分子相继两次碰撞间所走过的路程称为自由程。自由程的长短相差很大,但相当多的自由程的平均值却是一定的,这个平均值便称为平均自由程。单一气体分子的平均自由程的计算公式为:
![]()
式中:λ为平均自由程(cm);T为气体的绝对温度(K);p为气体的压强(Torr);σ为气体分子直径(cm)。
从式中可以看出,当温度一定时,平均自由程λ与压强p的乘积为一常数,即λ与p成反比关系。压力降低,碰撞机会减少,平均自由程增大。因此,在低压下,气体的扩散非常迅速。气体分子的平均自由程λ大于导管截面最大线性尺寸时,气体分子与导管壁的碰撞也将多于气体分子相互间的碰撞,这种气体分子的流动称为分子流。如果平均自由程λ小于导管截面最大线性尺寸,则气体分子相互之间的碰撞将多于气体分子与管壁的碰撞,这种气体分子流动称为黏滞流。
三、固体的吸气和放气
在大气状态或低真空区域内,固体与气体接触时,在固体表面及内部都会吸气,在高真空区域内,被吸收或吸附的气体又会部分或全部地逐渐释放出来。在真空技术中,这种吸气和放气现象不仅关系到真空的获得与保持,而且还影响到真空测量结果的准确性和可靠性,因此,了解和掌握这种现象是很重要的。固体吸气有两种情况:一种是固体表面吸气,称为吸附,另一种是固体内部吸气,称为吸收。吸附、吸收的综合作用统称为收附。固体放气即收附的逆过程称为解吸。
1.收附
(1)吸附。众所周知,固体内部分子之间有着比较强的结合力。常温下,这些分子是按照一定的排列结合在一起的,形成一定形状的固体结构。在固体内部,每一个分子受到各个方向来的结合力的作用处于平衡状态。但是,处于固体表面分子朝外一个方向的力没有饱和,因此,整个表面布满着向外引伸的吸力,即剩余力场,其作用距离约为一个分子直径。所以,当气体分子与固体表面碰撞时,就进入其剩余力场的作用范围,使气体分子在固体表面形成吸附。吸附作用主要与下列因素有关:
①固体表面积越大,表面状况越粗糙,其吸附能力越强,特别是带有大量细孔或粉状的材料具有很高的吸附能力。如活性碳、硅胶、活性氧化铝、分子筛、五氧化二磷等;
②吸附力随气体分子与固体表面距离增加而迅速减小,因此,一般吸附层仅为一单分子层。当温度低于气体临界温度时,会出现吸附着多层气体分子组成的气体薄膜。此外,具有大量微孔的材料在低压强下也能产生多分子层吸附;
③在温度不变以及压强较低时,吸附作用随压强的升高而增大,当压强增至一定值时,固体的吸附性能趋于饱和;
④在压强不变时,温度越低吸附量越大;
⑤气体的沸点越低吸附量越小;
⑥在温度一定时,低压强下的吸附时间与压强成反比。
(2)吸收。气体分子渗入固体内部形成固溶体或产生化学反应形成新的固态化合物,这种现象称为吸收现象。吸收也与气体压强和温度有关,但是,它不像吸附现象那样有着普遍的规律性。
2.解吸
被固体收附的气体分子,在一定的条件下,会离开固体重新解脱出来,这就是解吸。解吸的难易程度,与气体的种类和固体材料以及表面状态有关。但总的规律是,在一定的压强下,随着温度增高,解吸作用加快。这是由于每个被吸附的气体分子要从固体表面上解吸出来,必须获得一定的能量,来克服它与固体表面分子间的结合力,这种能量称为解吸热。因此,提高固体材料的温度,使吸附的气体分子获得的能量大于所需的解吸热时,气体分子就被解吸。在较低压强下加热,能加速解吸作用。
相关文章

真空热处理的工艺参数主要有淬火温度、真空度、淬火冷却介质、回火温度以及硬度等,在热处理过程中应根据材料、热处理技术要求、零件的形状、放置方式等进行合理地选择,尤其要注意升温速度对零件质量的影响。真空热处理与其他类型的热处理相比,具有其他热处理方法无法比拟的优点,其特点见表9-12。表9-12零件真空热处理特点(续)一般的真空热处理工艺曲线如图9-12所示。图9-12 真空热处理工艺曲线......
2025-09-30

为了改善齿轮齿面和齿根渗碳均匀性,进一步采用了一种“小脉冲强渗+扩散”的模式,一般每一个小脉冲强渗时间为50s左右,脉冲间隔时间为10s左右,渗碳效果很好,如图7-17所示。国内摩托车齿轮利用连续式真空炉渗碳淬火已取得明显效果。......
2025-09-29

真空炉的选用应根据具体的工艺要求而定,目前真空退火炉、真空淬火炉、真空回火炉、真空烧结炉等已经批量应用。金属材料在真空中加热既可避免氧化,又能脱气、脱脂等,下面介绍其应用情况。真空退火的脱气效果取决于加热温度、时间和真空度等工艺参数,另外,还与气体以及金属化合物的物理性质有关。......
2025-09-30

表7-66 主驱动齿轮低真空变压快速气体渗氮工艺应用实例(续)40Cr钢主驱动齿轮低真空变压快速氮碳共渗工艺表7-67 主驱动齿轮低真空变压快速氮碳共渗工艺应用实例......
2025-09-29

真空吸盘提升码垛技术的研究,目的是建立提升运行系统,确定提升时所需吸附力,建立透气度、真空度、时间模型。图5-6-1纸箱搬运堆码操作流程提升运行系统的建立及所需吸附力的确定真空吸盘产生的压力与提升旋转系统无直接关系,只需满足W真空≥W所需,所以搬运提升旋转系统,可以简化为平动系统。即只考虑提升时的加速度和水平运动时的加速度。等待真空度检测信号,确保吸盘吸牢纸箱,用时t2。......
2025-09-29

集聚型交流真空电弧虽在电流过零时造成熄灭的有利时机,电弧熄灭,弧柱区游离质点向四周真空区域迅速扩散。2)加强横向磁吹、使集聚型交流真空电弧在工频半周的末尾重新转变为扩散型电弧,使在电流过零后不会再引起重燃而熄灭。截流现象的产生,正是由于小电流时真空电弧的不稳定性造成的。......
2025-09-29
相关推荐