当熔体流动速率一定. VA含量增高时,其弹性、伸长率、柔软性、相容性、透明性等均有所提高;VA含量降低时,则性能接近于聚乙烯,结晶度提高,刚性增大、强度、硬度、耐磨性、耐热性及电绝缘性能提高。......
2023-06-20
分子荧光法测定饮料中Vc的含量
Vc又名抗坏血酸,是维持机体正常生理功能的重要维生素之一。本文采取分子荧光分析法测定饮料中的Vc含量。该法是基于Vc被Cu2+ 氧化为脱氢抗坏血酸(DHAA),DHAA进一步与苯甲酸及十六烷基三甲基溴化铵产生荧光协同增敏作用,然后采取标准曲线法进行分析。
一、前言
维生素又名维他命,即维持生命的元素,是维持人体生命活动所必须的一类有机物质,也是保持人体健康的重要活性物质。维生素在体内的含量很少,但不可或缺,如果长期缺乏某种维生素,就会引起生理机能障碍而发生某种疾病。维生素一般由食物中取得,Vc在水果和蔬菜中含量丰富,在氧化还原代谢反应中起调节作用,缺乏它可引起坏血病。
Vc的测量方法有紫外分光光度法、液相色法谱、原子吸收和分子荧光等。本文采用分子荧光法对饮料中的Vc含量进行了分析。荧光分析法(fl uorescence analysis)灵敏度高,选择性好,样品用量少且操作简便,因此,在卫生检验、环境及食品分析、药物分析、生化和临床检验等方面有着广泛的应用。
二、实验部分
(一)主要仪器
Fluorescene Spectrophotometer(F-2700); pH计(SHP-3D );电热恒温水浴锅;玻璃恒温水浴锅(SYP)。
(二)主要试剂
CuSO4、十六烷基三甲基溴化铵(CTMAB)、维生素C:分析纯。
统一葡萄多、统一鲜橙多、农夫30%果园果蔬:市购。
(三)原理
Vc本身不发射荧光,本实验是基于Vc被Cu2+氧化为脱氢抗坏血酸(DHAA),DHAA进一步与苯甲酸及十六烷基三甲基溴化铵产生荧光协同增敏作用,通过对体系荧光强度的测定进行维生素C的定量分析。
(四)实验方法
在25mL比色管中依次加入0.6mLCuSO4溶液、2.0mL十六烷基三甲基溴化铵溶液、2.0mL苯甲酸溶液、一定体积的Vc标准溶液、5.0mL pH=6.0的NaOH-邻苯二甲酸氢钾缓冲溶液,用蒸馏水定容,摇匀。在35℃恒温水浴中加热30 min,将溶液流水冷却至室温,在激发波长301nm、在发射波长404nm处,测量荧光强度If。
三、结果与讨论
(一)激发光谱和发射光谱的测定
在25mL比色管中依次加入0.6mLCuSO4溶液、2.0mL十六烷基三甲基溴化铵溶液、2.0mL苯甲酸溶液、3.0mLVc标准溶液、5.0mL pH=6.0的NaOH-邻苯二甲酸氢钾缓冲溶液,用蒸馏水定容,摇匀。在35℃恒温水浴中加热30 min,将溶液流水冷却至室温,分别在280—350nm、350—450nm内扫描得到激发光谱和发射光谱,如图1所示。
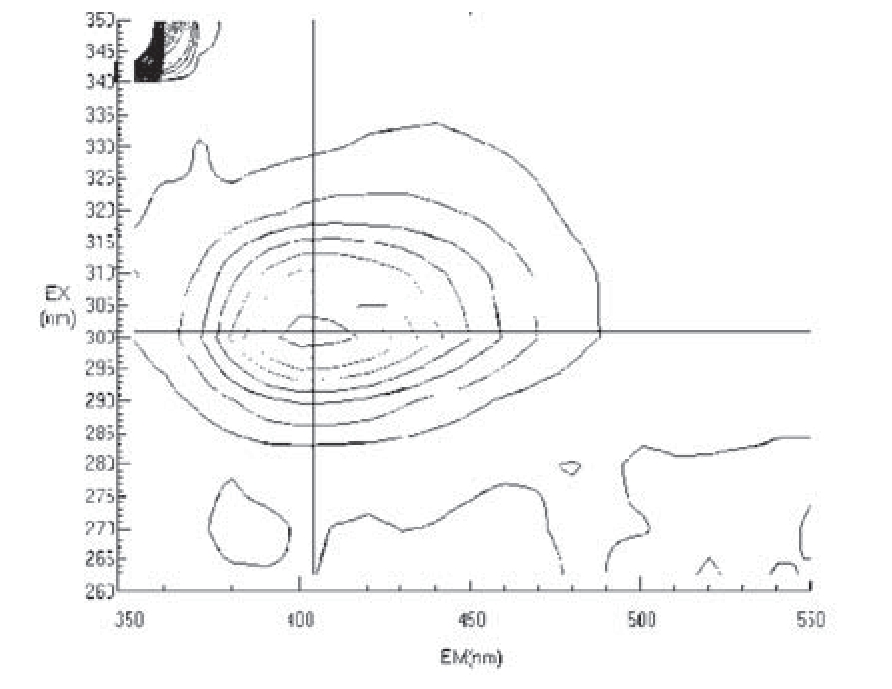
图1 标准Vc溶液的荧光光谱(3D图)
从图1中可看出,当激发波长为301nm、发射波长为404nm时,体系的荧光强度最大,故本实验选择激发波长为301nm、发射波长为404nm。
(二)加热温度
配制浓度为6µg/ml的Vc溶液,分别在25℃、30℃、35℃、40℃、45℃下的水浴中加热30 min,将溶液流水冷却至室温,反应30min后,测试各体系的荧光强度If。所得结果见图2。
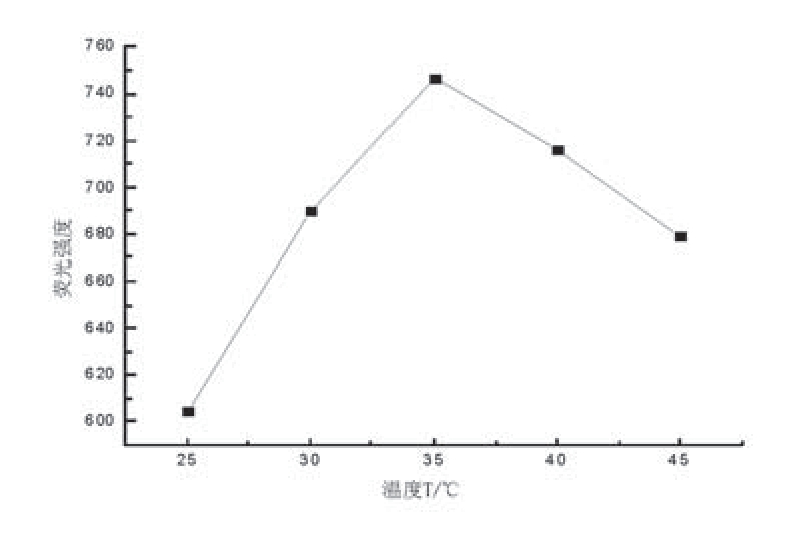
图2 溶液在不同温度下的荧光强度
结果表明,当加热温度为35℃时,既有利于提高体系反应速度,荧光强度最大,又不使产物结构受到破坏。因此本实验选用加热温度为35℃。
(三)加热时间
配制浓度为6µg/ml的5瓶标准溶液,在35℃加热温度下,分别加热20min、25min、30min、35min、40min后,测试出各体系的荧光强度If。结果如图3所示。

图3 加热时间与荧光强度的关系曲线(www.chuimin.cn)
结果表明,在水浴中加热30min后,体系荧光强度达到最大值且相对稳定。因此本实验选用加热时间为30min。
(四)缓冲溶液
溶液的pH值对体系荧光强度有较大的影响,实验测试了不同pH值对体系的荧光强度的影响。采用6µg/mL的标准溶液,在35℃加热温度下加热30min后,测量各溶液在pH值为5.0、5.5、6.0、6.5、7.0下的荧光强度If。结果见图4所示。
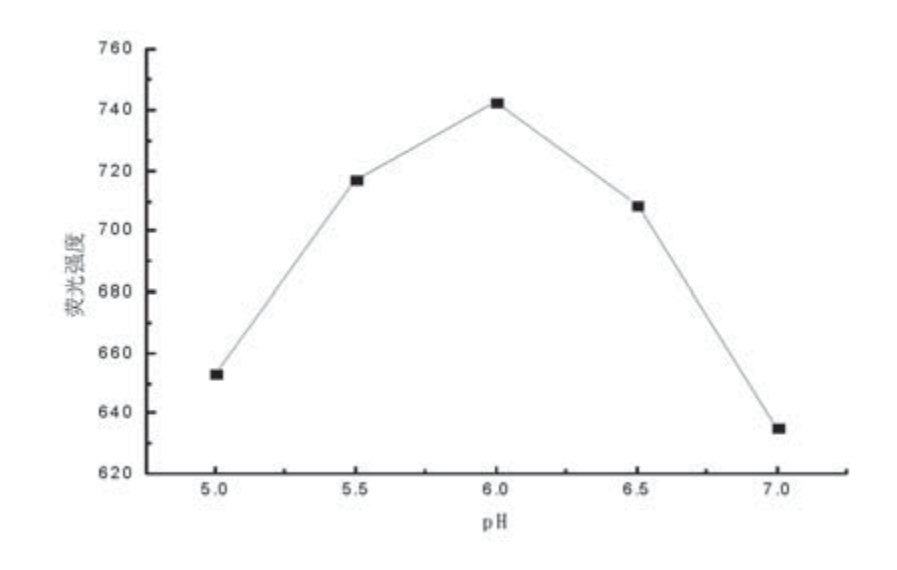
图4 溶液的pH值与荧光强度的关系曲线
由pH值—荧光强度的曲线可知,当pH值为5.9—6.2时,荧光强度If达到最大值且比较稳定。因此本实验确定最佳pH为6.0。
(四)表面活性剂用量
在其他条件不变的情况下,向溶液中分别加入1.0mL、1.5mL、2.0mL、2.5mL、3.0ml 0.6mg/mL的十六烷基三甲基溴化铵溶液,配成浓度为6µg/mL的标准溶液,在35℃加热温度下加热30min后测量体系的荧光强度值If。结果见图5所示。
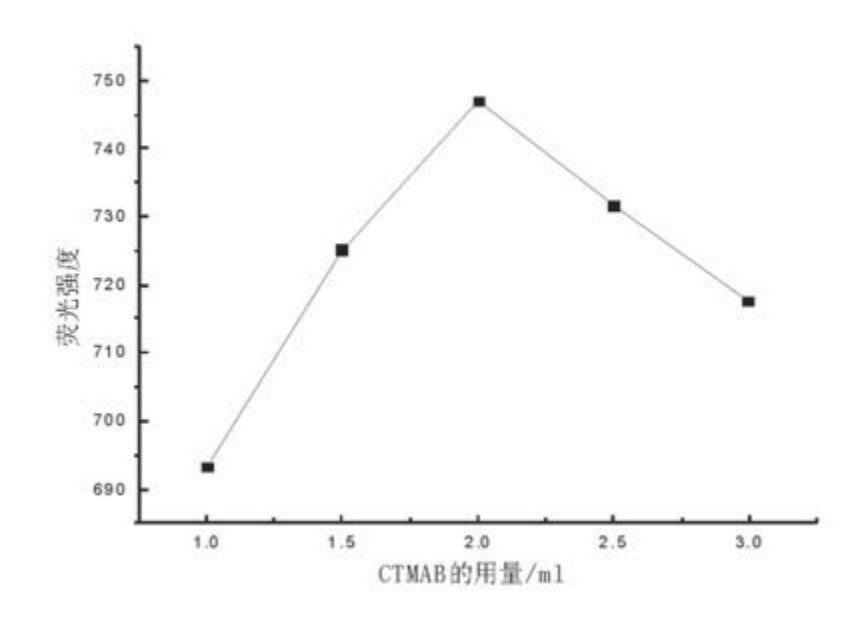
图5 CTMAB用量与荧光强度的关系
实验表明,当CTMAB的用量为2.0mL时,体系荧光强度If最大。因此本实验选用CTMAB的用量为2.0mL。
(五)标准曲线的制作
配制浓度为3.0、4.0、5.0、6.0、7.0μg/mL的一系列Vc标准工作溶液,确定实验的加热温度为35℃,加热时间为30min,pH值为6.0,CTMAB的用量为2.0mL进行测定,测定出各标准溶液的荧光强度If,并以荧光强度If对维生素C的浓度C(μg/mL)作图。见图6。
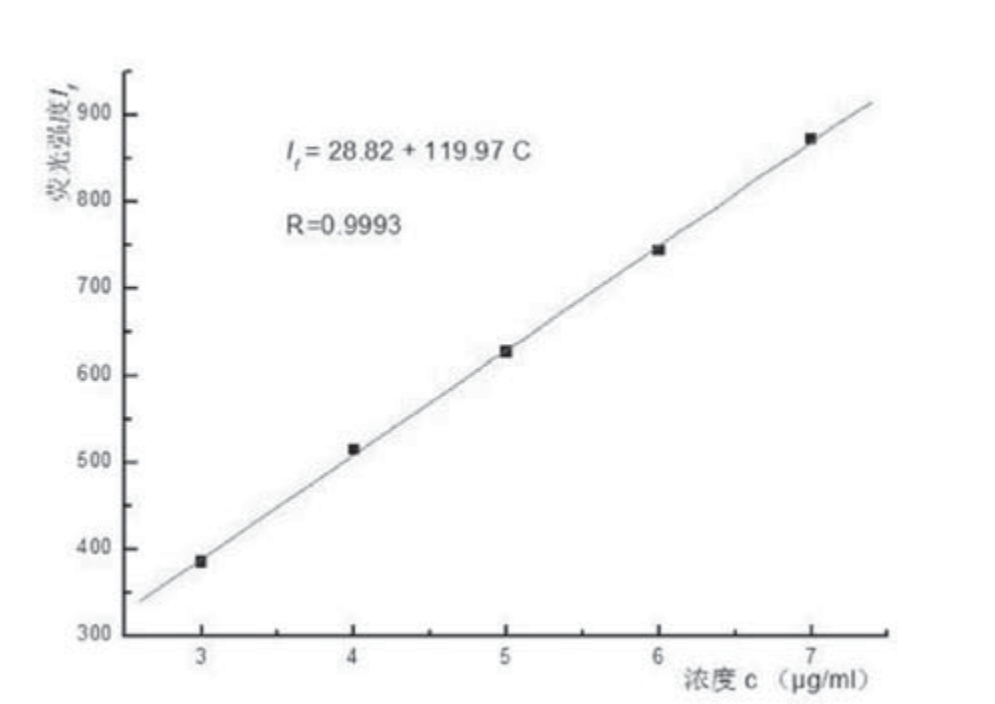
图6 标准曲线
所作的标准曲线如上,维生素C浓度在3.0—7.0µg /mL范围内,与荧光强度呈良好的线性关系,线性回归方程为If=119.97C+28.82,相关系数为R=0.9993,线性相关良好。
(六)饮料中维生素C的测定
分别吸取三种饮料各1.0mL、1.5mL、0.6mL,先用0.45µm的滤膜过滤,再将过滤后的溶液转移到25mL比色管中并依次加入0.6mLCuSO4溶液、2.0mL十六烷基三甲基溴化铵溶液,2.0mL苯甲酸溶液、一定体积的维生素C标准溶液、5.0mL NaOH-邻苯二甲酸氢钾缓冲溶液,用蒸馏水定容,摇匀。在35℃恒温水浴中加热30 min,将溶液流水冷却至室温,在激发波长301nm和发射波长404nm处,测量荧光强度If,与标准曲线中荧光强度值对照,计算出各饮料的浓度。结果见表1。
表1 各饮料的荧光强度及对应的浓度

由以上数据得知:统一葡萄多中Vc的含量为15.06 mg/100mL,比营养成分表上Vc的含量偏高;而农夫30%果园果蔬和统一鲜橙多中Vc的含量分别为9.87 mg/ 100mL和24.80 mg/100mL,略低于营养成分表上所示的Vc的含量。
四、结论
荧光分析法测定Vc具有操作简单、精密度高、检出限低等优点,该法可以应用于水果、蔬菜和药物中Vc的检测。本试验中,采用分子荧光法测定饮料中Vc的含量,确定了最大激发波长为301nm和最大发射波长为404nm,并在该波长下进行了一系列的条件实验,从而确定了各条件实验中的最佳条件为加热温度35℃,加热时间为30min,pH为6.0,CTMAB的量为2.0mL。
【参考文献】
[1] Levine M,Conry—Cantilena C,Wang Y etal.Vitamine C pharmacokinetics in healthy volunteers:evidence for a recommeded dietary allowance[J].Anal Biochem,1992,(204):1.
[2] 张丽萍,吴小春,吴友谊等.国内维生素 C仪器定量分析进展[J].四川轻化工学院学报,2002,15(4):34.
[3] 赵兴红,郭新华.抗坏血酸的快速比色测定[J].中国药学杂志,1991,26(6):358.
[4] 童裳伦.荧光光度法测定维生素C[J].浙江大学学报(理学版),2001,28(5):542—546.
[5] SchenkJ O.Miller E.Adams R N.Electrochemical assay for brain ascorbate with ascorbate oxidase [J].Anal Chem,1982,54(8):1452.
[6] 孙振艳,赵中一,郭小慧等.荧光分析法测定维生素C [J].化学分析计量,2006,15(4):18—20.
有关武汉东湖学院论文集的文章

当熔体流动速率一定. VA含量增高时,其弹性、伸长率、柔软性、相容性、透明性等均有所提高;VA含量降低时,则性能接近于聚乙烯,结晶度提高,刚性增大、强度、硬度、耐磨性、耐热性及电绝缘性能提高。......
2023-06-20

脱氧核糖在酸性环境中脱水生成ω-羟基-γ-酮基戊醛,它与二苯胺试剂反应产生蓝色化合物,在595nm处有最大吸收,可用比色法测定。以DNA浓度μg为横坐标,A595为纵坐标,绘制标准曲线。根据所测得的吸光度对照标准曲线求得DNA的质量(μg)。......
2023-11-06

现场含气性测试技术指利用现场钻井岩心或有代表性岩屑测定页岩含气量。目前,国内外针对页岩气现场含气性测试技术是指解吸法。本书通过研究页岩含气性测试各项技术的方法、原理、测试仪器设备、比较优缺点,并结合重庆地区页岩气含气性测试技术需求与特点,优选出适合重庆地区的页岩气含气性测试技术。1)页岩含气性测试优选技术研究页岩气含气性测试技术主要包括现场含气性测试技术、等温吸附测试技术和含油气饱和度测试技术。......
2023-06-24

本方法适用于不含铌、钽和铪元素的钛合金中锆含量的测定,测定范围为0.50%~5.00%。于瓷坩埚中加入4g焦硫酸钾,放入高温炉内,于700℃加热至得到清亮的熔融物,取出冷却,放入300mL烧杯中,加50mL水,加热浸取熔块。......
2023-06-23

本方法适用钛合金中铜含量的测定,测定范围为1.00%~5.00%。于数个100mL容量瓶中,分别加入0mL、0.50mL、1mL、1.50mL、2mL、2.50mL铜标准溶液,加入10mL柠檬酸溶液,以下按分析步骤进行,以不加铜标准溶液的一份为参比溶液,测量吸光度,绘制校准曲线。将显色后的上述溶液移入1cm吸收池中,以参比溶液为参比,于560nm波长处测量吸光度,从校准曲线上查得铜量。以不加铜标准溶液的一份为参比溶液,测量吸光度,绘制校准曲线。......
2023-06-23

本方法适用钛合金中钒含量的测定,测定范围为1.00%~10.00%。3)校准曲线的绘制:称取0.10g海绵钛或不含钒的钛合金,溶解,分取10.00mL钛溶液数份,分别置于数个125mL分液漏斗中,分别加入0mL、2.00mL、4.00mL、6.00mL、8.00mL、10.00mL钒标准溶液B,在摇动下滴加高锰酸钾溶液,以下按分析步骤进行,以不加钒标准溶液的一份为参比液,测量吸光度,绘制成校准曲线。......
2023-06-23

支链淀粉又称胶淀粉,分子量相对较大。在食物淀粉中,支链淀粉含量较高,一般为65%~81%。目前关于稻米中支链淀粉含量的测定还没有相应标准。如果用两种淀粉的标准溶液分别与碘反应,然后在同一个坐标系里进行扫描或作吸收曲线,可以得到支链淀粉的含量。关于支链淀粉含量的测定,还可以参照胡培松等发明的方法。直链淀粉面积与支链淀粉的长链和支链淀粉的中短链(第三峰)总出峰面积之比,即为直链淀粉含量/支链淀粉含量之比。......
2023-06-20

掌握酚醛树脂由B阶向C阶过渡时小分子释放的原理。理解树脂含量和固体含量的不同含义。它的分子结构比可溶酚醛树脂要复杂得多,分子链产生支链,酚已经开始充分发挥其3个官能团的作用。树脂含量R c指去除挥发溶剂后测出的溶液中树脂含量的百分比,即2)固体含量的测定将质量为m 3的试样再放入℃恒温烘箱中处理60 min;取出称量瓶在干燥器中冷却至室温后称其质量为m 4。......
2023-06-22
相关推荐