(一)血清γ-球蛋白的分离与纯化1.了解蛋白质分离纯化的总体思路。本实验在血清中加50%饱和度的硫酸铵,使球蛋白沉淀析出,清蛋白则仍溶解于溶解中,经离心分离获得沉淀部分即为含有γ-球蛋白的粗制品。脱盐后的γ-球蛋白再经DEAE纤维素层析柱进一步纯化。血清γ-球蛋白分离纯化后,选用醋酸纤维薄膜电泳法鉴定其纯度。合并含有蛋白质的各管,即为已脱盐的γ-球蛋白溶液,待进一步纯化。......
2023-11-06
酪蛋白的纯化和初步鉴定研究
涂毅,龙尧尧,彭勃,汪越,范苏秦,曹军卫
从牛奶中分离酪蛋白的最佳工艺参数为:提取温度40℃,pH 4.8,乙醇用量20 mL/100 mL牛奶。本文探讨了离子交换层析分离纯化酪蛋白的实验条件,以pH 7时洗脱效果较为理想;连续梯度洗脱分离出了五个峰值,电泳分析得知纯化五种蛋白质的NaCl浓度分别为0.048mol/L,0.078mol/L,0.162mol/L,0.198mol/L,0.240mol/L,其中前两个浓度对应于洗脱γ和β-酪蛋白,且两种蛋白质的含量分别为0.32g,2.01g。α或κ-酪蛋白由于峰的归属不明尚无法确定含量,需其他实验方法作进一步鉴定。
一、前言
酪蛋白是乳中特有的,由乳腺上皮细胞合成的一组磷蛋白。酪蛋白中含有大量的磷和钙,以磷酸酯键与丝氨酸的羟基结合,含有少量己糖、氨基糖和唾液酸等残基。乳中酪蛋白分为α-酪蛋白,β-酪蛋白,γ-酪蛋白和κ-酪蛋白四种,它们各自都有不同相对分子质量和等电点的变异体。牛乳中α-酪蛋白约占50%,等电点约为4.1,分子量约为23000;β-酪蛋白约占30%,等电点约为4.5,分子量约为24000;γ-酪蛋白和κ-酪蛋白都只有很少一部分,γ-酪蛋白约占3%,等电点约为5.9,分子量约为31000;κ-酪蛋白约占10%,等电点4.1,分子量约为19000。
酪蛋白是乳中含量最高的蛋白质,与人们的生活也密切相关,需求量非常大,因此,确定一个好的分离提纯方法有着十分重要的意义。本研究的目的是对酪蛋白进行粗提后,通过不同的pH、盐离子浓度等洗脱方式的优化来确定分离提纯酪蛋白的最佳条件。
二、实验部分
(一)材料与试剂
脱脂奶粉(市售),氯化钠,95%乙醇,SDS,考马斯亮蓝G-250,DEAE-c纤维素,Ampholine,牛血清白蛋白(BSA)等,均为分析纯。
TH-300梯度混合仪(上海沪西分析仪器厂有限公司 TH-300),自动部分收集器(上海青浦沪西仪器厂 BS-100),凝胶成像系统(Beijing Junyi-Dongfang Electrophoresis Instrument Co.,Ltd JYO4S型)等。
(二)方法
1.酪蛋白的粗提
(1)确定酪蛋白提取的最佳温度、pH、乙醇用量作为最佳提取条件。
(2)在最佳提取条件下提取酪蛋白样品。
2.离子交换层析
将1.5g已处理好的酩蛋白粗制品溶液离心后取其上清液上样。
选择不同离子强度的洗脱液进行连续梯度或不连续梯度洗脱。我们使用了以下两种方案。
(1)把起始缓冲液配成分别含0mol/L NaCl、0.22mol/L NaCl和含0.35mol/L NaCl的洗脱液在不同pH下进行不连续梯度洗脱。
(2)选择最佳pH进行连续梯度洗脱。
3.检测与鉴定
将有明显峰值的样品收集,进行SDS-PAGE电泳和等电聚焦电泳检测样品酪蛋白的组分;用考马斯亮蓝G-250法测定蛋白质的含量。
(三)结果与讨论
1.酪蛋白的提取
(1) 温度的影响
酪蛋白在牛乳中以酪蛋白磷酸钙的形式存在,随着温度的升高,酪蛋白胶囊之间热碰撞频率增加,酪蛋白容易相互结合成块。但温度超过一定范围后,蛋白质的次级结构遭破坏,静电斥力增加,这就使酪蛋白结合变得困难而不易结块,导致酪蛋白得率下降。由图la可知,最适提取温度为40℃。
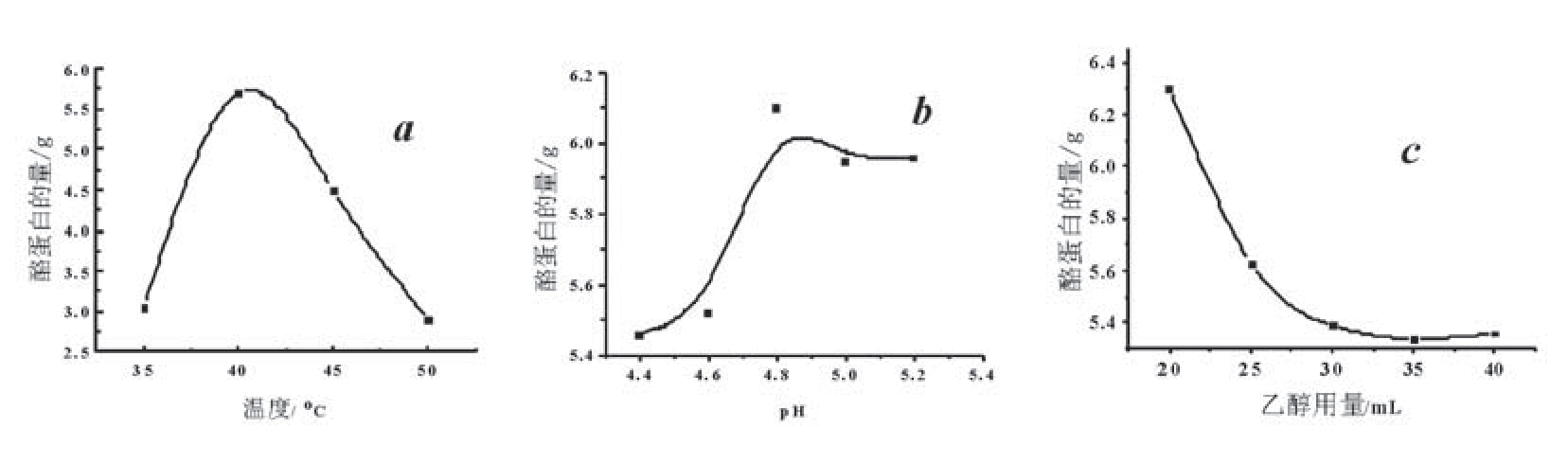
图1 提取条件对酪蛋白得率的影响(a:温度;b:pH;c:乙醇用量)
(2)pH的影响
由图1b可知,当pH值增至4.8左右时,酪蛋白的量最大;pH值继续升高,沉淀量会逐渐下降。其原因为蛋白质是两性化合物,等电点(pH 4.8)时酪蛋白的溶解度最小,会从牛奶中沉淀出来;偏离它的等电点时,酪蛋白胶粒静电斥力增大不易结合成块,提取量下降。
(3) 乙醇用量的影响
由图1c可知,随着乙醇用量的增加,酪蛋白的提取量迅速减少。当用量达到30 mL左右时,提取量逐渐趋于稳定。因此,最适用量取20mL。
(4)最佳提取条件下提取酪蛋白样品
称取12g市售奶粉配成100mL溶液,经过粗提得到6.3g酪蛋白粗提品,收率为52.5%。
2.离子交换层析
(1)不同pH下的不连续梯度洗脱
① pH为7的不连续梯度洗脱。
依次采用0mol/L、0.22mol/L 、0.35mol/L pH 7.0的NaCl溶液洗脱,其中69管处的A280达到2.046,出现一明显峰值(图2a)。之后未出现峰值。(www.chuimin.cn)
(a:pH 7;b:pH 6;c:pH 8)

图2 不同pH的NaCl不连续梯度洗脱曲线
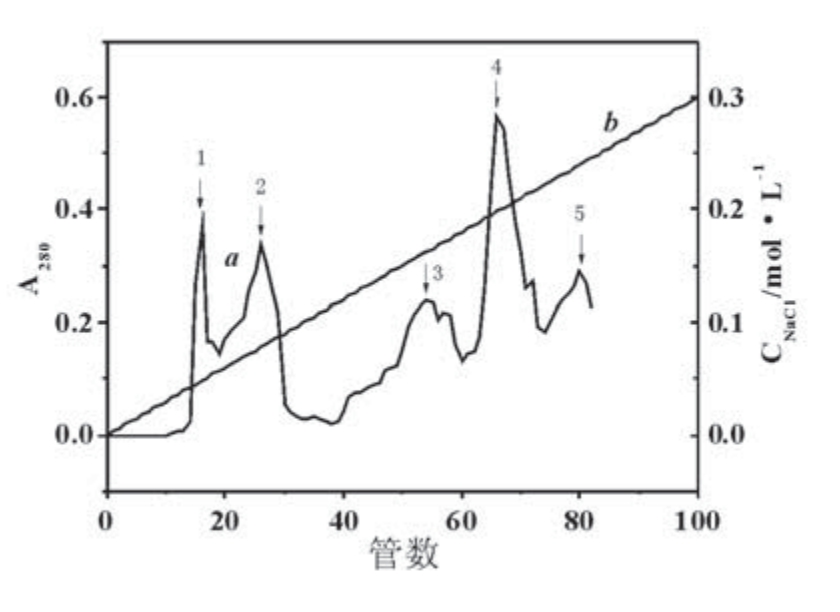
图3 连续梯度洗脱曲线(a)与NaCl浓度梯度(b)
②pH为6的NaCl洗脱液洗脱
将NaCl溶液的pH调为6,其他条件不变。在61管出现一个明显的峰值(图2b),达到2.035,之后再未出现峰值。为何出峰时间比pH 7时要早,这是由于酪蛋白等电点是4.7,在pH为7时所带电荷要大,故洗脱下来更难一些。
③pH为8的NaCl洗脱液洗脱
换用pH为8的NaCl溶液洗脱,只得到了一个明显的峰值(图2c)。
由图2可知,在盐离子浓度不变的情况下,pH的改变只会改变洗脱的难易,pH为8时最难洗脱。考虑到出峰快慢可选择pH 7洗脱最合适。
(2)最佳pH下的连续梯度洗脱
洗脱速度为0.5mL/min、洗脱缓冲液pH为7,梯度混合仪两边盛放离子强度为0 mol/L和0.3mol/L的NaCl溶液进行洗脱。洗脱曲线如图3a所示,得到5个峰,编号为1—5,洗脱浓度与管数之间的对应关系如图3b所示。5个峰值所对应的NaCl浓度依次为0.048mol/L,0.078mol/L,0.162mol/L,0.198mol/L,0.240mol/L。
3.SDS-PAGE电泳
将5个峰值对应的样品进行收集,SDS-PAGE电泳图谱如图4所示。
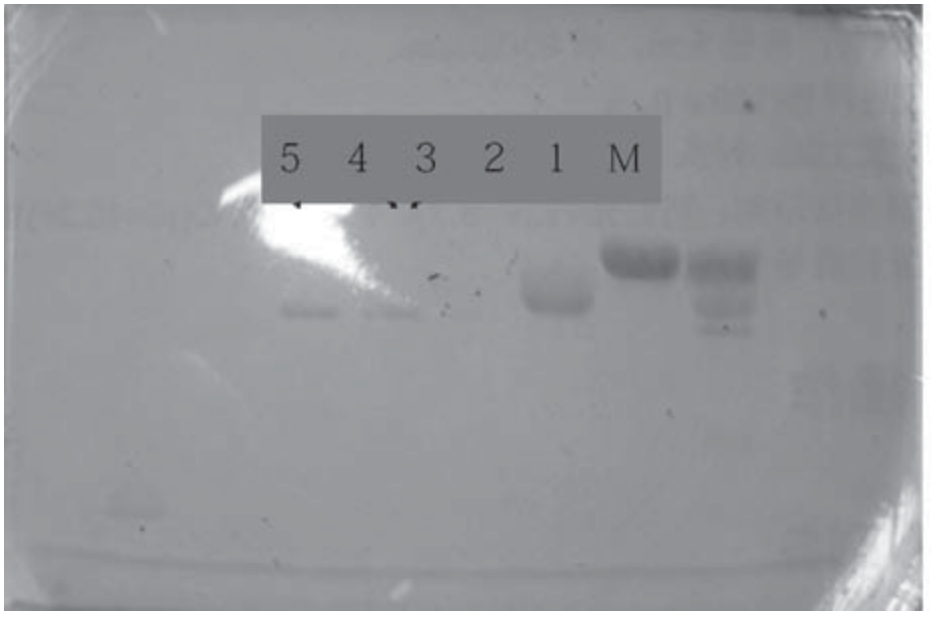
图4 SDS-PAGE电泳图谱
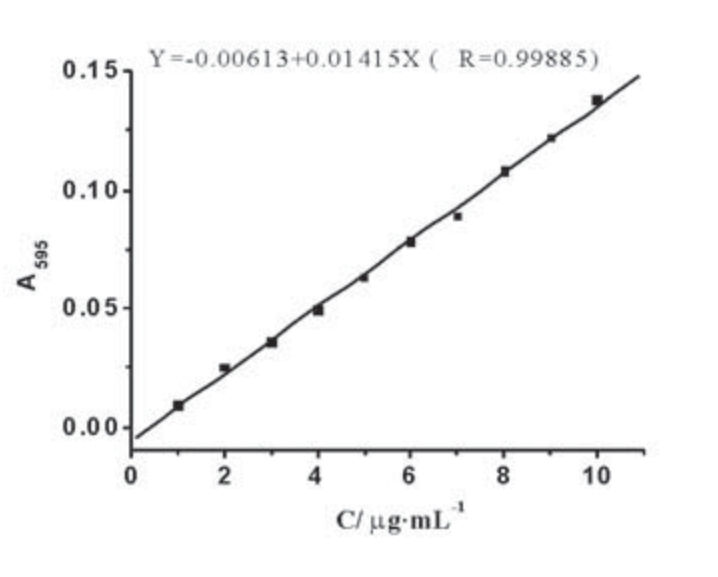
图5 考马斯亮蓝法工作曲线
(M为酪蛋白的粗提品,1—5泳道依次对应5个峰值的样品)
由图4可知,3、4、5泳道对应的样品条带处于同一水平,考虑到没有其他蛋白质的影响,故它们的分子量相同,可能为同一种酪蛋白,且与1和2的条带明显不同,因此分离出了至少三种不同分子量的酪蛋白。
4.等电聚焦电泳
通过等电聚焦电泳,测出峰1样品的pI为4.9,峰2样品的pI为4.7,峰3、4、5样品的pI都为4.1。对比四种酪蛋白的等电点,推测峰1对应的是γ-酪蛋白,峰2对应的是β-酪蛋白,峰3—5对应的是α或κ-酪蛋白。
5.考马斯亮蓝G-250法测定蛋白质的含量
用考马斯亮蓝G-250法作工作曲线,如图5所示。得到线性拟合曲线方程为
Y=-0.00613+0.01415X(R=0.99885)
可计算得γ-酪蛋白的浓度为0.32mg/mL,β-酪蛋白的浓度为2.01mg/mL,α或κ-酪蛋白由于峰的归属不明尚无法确定浓度。推测12g牛奶中的γ-酪蛋白为0.32g,β-酪蛋白为2.01g。
三、小结
(1)分离酪蛋白最佳工艺:提取温度40℃,pH4.8,乙醇用量20mL/100mL牛奶。
(2)离子交换层析 pH 7时洗脱效果较为理想,但是几种酪蛋白未分离开,可能是离子浓度的大小影响了洗脱的效果。进行连续梯度洗脱分离出了5个峰值,电泳分析得知纯化五种蛋白质的NaCl浓度分别为0.048mol/L,0.078mol/L,0.162mol/L,0.198mol/L,0.240mol/L,其中前两个浓度对应于洗脱γ和β-酪蛋白,且两种蛋白质含量分别为0.32g,2.01g。
(3)α或κ-酪蛋白由于峰的归属不明尚无法确定含量,需其他实验方法作进一步鉴定。
【参考文献】
[1] 陆健.蛋白质纯化技术与应用[M].北京:化学工业出版社,2005:26-27.
[2] 吴宪禹.蛋白质纯化实验方案与应用[M].朱厚础译.北京:化学工业出版社,2010:44—49.
[3] [美]D.R.马歇克,J.T.门永,R.R.布格斯等.蛋白质纯化与鉴定实验指南[M].北京:科学出版社,1999:249.
[4] [英]特怀曼(Twyman,R.M.).蛋白质组学原理[M].王恒樑译.北京:化学工业出版,2007:26—30.
[5] 王延华.蛋白质理论与技术[M].北京:科学出版社,2005:36—46.
[6] [美]弗鲁顿.蛋白质酶和基因[M].昌增益译.北京:清华大学出版社,2005: 13—18.
有关武汉东湖学院论文集的文章

(一)血清γ-球蛋白的分离与纯化1.了解蛋白质分离纯化的总体思路。本实验在血清中加50%饱和度的硫酸铵,使球蛋白沉淀析出,清蛋白则仍溶解于溶解中,经离心分离获得沉淀部分即为含有γ-球蛋白的粗制品。脱盐后的γ-球蛋白再经DEAE纤维素层析柱进一步纯化。血清γ-球蛋白分离纯化后,选用醋酸纤维薄膜电泳法鉴定其纯度。合并含有蛋白质的各管,即为已脱盐的γ-球蛋白溶液,待进一步纯化。......
2023-11-06

(一)蛋白质的表达、分离、纯化了解重组蛋白表达的方法和意义。目的基因在宿主细胞中的高效表达及表达的重组蛋白的分离、纯化及理论研究和实验应用都具有重要的意义。蛋白质的纯化程度可通过聚丙烯酰胺凝胶电泳进行分析。......
2023-11-06

选择合适的pH及适当浓度的三氯乙酸或丙酮,可以从蛋清中除去大量的非卵类黏蛋白,获得鸡卵类黏蛋白的粗提液。初步纯化的鸡卵类黏蛋白,经DEAE-纤维素离子交换柱进一步纯化,可除去少量的杂蛋白,得到鸡卵类黏蛋白的纯溶液。鸡卵类黏蛋白在280nm处的消光系数=4.13,即蛋白质浓度为1mg/mL时溶液的吸光度A280=0.413,据此可以测定鸡卵类黏蛋白的含量。将收集的蛋白液体放置冰箱,准备进一步用DEAE-纤维素柱层析纯化。......
2023-11-06

(一)多糖的提取、纯化了解多糖提取和纯化的一般方法。多糖的纯化,就是除去存在于粗多糖的杂质而获得单一的多糖组分。它只是一种多糖的混合物,其中可能存在中性多糖、酸性多糖、单糖、低聚糖、蛋白质和无机盐,必须进一步分离纯化。各管用硫酸苯酚法检测多糖。本实验利用红外光谱对多糖进行鉴定。多糖类物质的官能团在红外谱图上表现为相应的特征吸收峰,可以根据其特征吸收峰来鉴定糖类物质。......
2023-11-06

(一)概述生物大分子主要是指蛋白质、酶和核酸,这三类物质是生命活动的物质基础。在自然科学,尤其是生命科学高度发展的今天,蛋白质、酶和核酸等生物大分子的结构与功能的研究是探求生命奥秘的中心课题。然而生物大分子的分离纯化与制备是一件十分细致而困难的工作,有时制备一种高纯度的蛋白质、酶或核酸,要付出长期和艰苦的努力。目前纯化蛋白质等生物大分子的关键技术是电泳、层析和高速与超速离心。......
2023-11-06

实验类型 综合性教学时数 6一、实验目的学习从牛乳中制备酪蛋白的原理和方法。酪蛋白为白色、无味、无臭的粒状固体。牛乳在pH4.7时酪蛋白等电聚沉后剩余的蛋白质统称乳清蛋白。乳清蛋白不同于酪蛋白,其粒子的水合能力强、分散性高,可溶解分散在乳清中。牛乳中酪蛋白含量约为35g/L。弃去上清液,沉淀即为酪蛋白粗制品。......
2023-11-04

掌握凝胶柱层析分离技术的原理。利用交联葡聚糖凝胶G 50的凝胶过滤作用,将脲酶和胰岛素分开,以FolimDenis反应检查流出液中的蛋白质。将乳胶管放下,仍继续加入上述悬液至凝胶层沉积至18cm高度即可。操作过程中,应防止气泡与分层现象的发生。某样品中含有1mg A蛋白、1mg B蛋白、4mg C蛋白、1mg D蛋白、1mg E蛋白,采用Sephadex G75凝胶柱层析,请指出各蛋白质的洗脱顺序。通过实验讨论,哪些因素会影响凝胶层析的分离效果?......
2023-11-09

实验十单克隆抗体的制备、纯化及鉴定抗体是机体在抗原刺激下产生的能与该抗原特异性结合的免疫球蛋白。由于常规抗体的多克隆性质,以及不同批次的抗体制剂质量差异很大,从而不利于其应用。经过克隆选择,可筛选出能产生特异性单克隆抗体的杂交瘤细胞,在体内或体外培养,即可无限制地大量制备单克隆抗体。现用的免疫程序中多数是参照制备常规多克隆抗体的方法。......
2023-12-07
相关推荐