同源四倍体双胚苗材料在其性状表达特征、性状表达频率和性状表达的条件等方面均显现出一定的特异性。在同源四倍体双胚苗材料中,其苗位特征表现出明显的多样性。对于同源四倍体水稻群体内所出现的双胚苗突变材料,按照单株筛选法对其进行2个世代的筛选和纯化,待其主要农艺性状稳定后按照试验设计对其双胚苗的形态特征及其性状稳定性进行了研究。......
2023-11-28
N+注入对不同倍性双胚苗水稻幼苗生长及酶活性的影响(1)
燕晓阳 黄群策 陈雪能
摘要 以同源四倍体双胚苗水稻品系09-04-01和相应的二倍体09-02-01为研究材料,对其不同剂量离子注入后种子电解质外渗率及幼苗生长状况和酶活性做了初步研究。结果表明:离子注入后,09-04-01种子电解质外渗率与对照相比的平均增幅低于09-02-01;09-02-01在1.0×1017N+/cm2注入剂量下幼苗生长状况较好,而09-04-01在3.0×1017N+/cm2注入剂量下幼苗生长状况较好;过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性随离子注入剂量的增加均有先升高后降低的趋势,但这种趋势因酶种类的不同而表现出一定的差异。09-02-01在1.0×1017N+/cm2注入剂量下POD和SOD活性最强;09-04-01在7.0×1017N+/cm2注入剂量下POD和SOD活性最强。结果说明一定剂量的氮离子注入能够增强清除自由基的酶的合成能力,09-04-01比09-02-01效应更为显著。
关键词 双胚苗水稻;氮离子注入;酶活性
余增亮等1986年首次发现了N+注入水稻种子诱发变异的生物效应[1],从而开创了新的研究领域—低能离子生物学,由此离子束生物工程的研究揭开序幕[2]。经过20多年的发展,离子注入技术已广泛应用于植物、微生物的品种改良及新品种和新品系的育,并取得了明显的进展[3-7]。有研究表明[8],离子束辐照可引起植物体内产生大量的活性氧自由基,这些自由损伤。但植物体内存在各种清除活性氧自由基的酶,这些酶可以清除植物体内过量的活性氧自由基,保护植物免受伤害。因此通过研究离子注入后植物体内保护酶的活性可以了解植物抗辐射性的强弱。
当今水稻遗传改良面临着两大难题,即如何在现有基础上进一步提高水稻的产量潜力和有效固定水稻的杂种优势[9]。研究发现无融合生殖方式可以很好地固定杂种优势[10]。前人的研究结果表明,在禾本科植物中,多胚现象或多胚苗现象是无融合生殖物种在胚胎学和形态学上的重要特征,因而通过筛选多胚苗材料来寻找无融合生殖种质是一条有效的研究途径[10-12]。双胚苗水稻为无融合生殖种质的筛选提供了丰富的材料,对双胚苗水稻的研究引起人们的关注。但是研究者对双胚苗水稻的研究多集中在胚位、苗位的观察[11]及配子体的发育[13]和双胚苗频率[14]等方面,而对不同倍性双胚苗水稻离子注入后的生长状况及生理生化方面的研究尚不多见。因此,本文研究了离子注入后不同倍性双胚苗水稻幼苗生长状况及酶活性的变化,旨在为水稻无融合生殖品系的选育和多倍体育种积累资料。
1 材料与方法
1.1 材料
试验所用材料为同源四倍体双胚苗水稻品系09-04-01和相应的双胚苗二倍体水稻品系09-02-01。对同源四倍体水稻品系IR36-4X进行离子注入,在其第2代群体中筛选出具有多胚苗特征的IR36-双[15]。09-04-01是从IR36-双的后代中筛选出的农艺性状稳定的具有双、多苗特性的株系,09-02-01是以09-04-01的花粉为材料通过花药离体培养获得的稳定的二倍体后代株系。在适宜温度和去颖壳条件下,09-04-01的多胚苗频率为2.33%; 09-02-01的多胚苗频率为4.48%[11]。
1.2 方法
1.2.1 氮离子注入
氮离子注入在郑州大学离子束生物工程实验室的离子注入机(俄罗斯产TITAN源低能离子注入机)进行。注入能量为30 keV,设5个处理剂量,分别为: 1×1017、3×1017、4×1017、6×1017和7×1017N+/cm2,设置1组空白对照(CK),注入时水稻种子胚朝上固定于花泥中。
1.2.2 电导率测定方法
参考徐本美的方法[16]并略有改动。每个处理分别挑选饱满且无机械损伤的水稻干种子50粒,称重,单蒸水清洗数次,置于小烧杯中,加入40mL单蒸水并用保鲜膜封口,设置单蒸水的空白对照。25℃下浸泡处理24h,室温放置1h后用DDS-11A型数字电导仪测定其电导率(C1),再将样品煮沸10min,冷却至室温测其电导率(C2),重复3次。相对电导率(%)= (C1-空白值)/(C2-空白值)×100。
1.2.3 材料处理
每个处理挑选饱满种子100粒,0.1%HgCl2处理15min,单蒸水清洗5次,浸泡24h后置于铺有单层滤纸的培养皿中。28℃暗培养下催芽48h,转移至25℃光培养箱中培养。培养7 d时测量苗高、根数(>0.5cm)和根长(根毛最多的根)。每个处理剂量重复3次。
1.2.4 酶液的提取
取培养10 d的幼苗单株称重后剪碎,置于预冷的研钵中加稍许液氮研磨,加入0.05mol/L pH =7.8的磷酸盐缓冲液研磨成匀浆,将匀浆定容到2mL的离心管中。在10 000 r/min、4℃条件下离心15min,上清液即为酶的粗提液,-20℃保存用于测定酶活性。每个处理提取10个单株。
1.2.5 酶活性测定
过氧化物酶(POD)活性采用愈创木酚法[17]。在过氧化氢存在下,POD能使愈创木酚氧化,生成茶褐色的物质,该物质在470nm下有最大光吸收,可用紫外分光光度计测量470nm下的吸光度变化测定过氧化物酶的活性。反应体系包括280mL,pH =7.4的磷酸缓冲液、0.1mL 1%H2O2、0.05mL 20mmol/L的愈创木酚溶液和0.05mL的酶粗提液,对照组以0.05mL的磷酸缓冲液代替酶液。加样后混合均匀即刻在470nm下测定其吸光度,每隔30 s读数1次,共读4min,计算样品POD活性。酶活性以每分钟吸光度变化0.01为1个酶活力单位,酶活性用U/(min·g)表示。
超氧化物歧化酶(SOD)活性检测参照Stewert和Bewley[18]抑制NBT光化还原的方法。反应液总体积3mL,其中含有0.05mol/L pH = 7.8的磷酸缓冲液1.5mL,130mmol/L甲硫氨酸0.3mL,750 μmol/L氮兰四唑0.3mL,100 μmol/L EDTA-Na2溶液0.3mL、20 μmol/L核黄素0.3mL、蒸馏水0.25mL和酶液0.05mL,在4 000 lx光培养箱中反应20min,对照管以缓冲液代替酶液,并以不加酶液的照光管和避光管为对照组,检测560nm波长下吸光度。每30 s测1次,共测4次,取平均值。酶活性以抑制氮兰四唑光氧化还原50%时所需的酶量为1个酶活力单位。酶活性用U/(g·min)表示。
过氧化氢酶(CAT)活性测定参考邹奇的紫外吸收法[19]并略作改动。过氧化氢在240nm下有强吸收,CAT能分解过氧化氢,使反应溶液吸光度随反应时间而降低。测量240nm下的吸光度变化即可测出过氧化氢酶的活性。反应底物溶液为0.82mL 0.05mol/L pH =7.4的磷酸缓冲液和0.18mL 1%H2O2溶液。测量时先加入底物溶液再加入0.02mL酶粗提液,对照以0.02mL磷酸缓冲液代替酶液,最后加入1.98mL双蒸水补足3mL。迅速混匀后检测240nm处的吸光度,每隔30 s检测1次,共测4min。以每分钟减少0.1个OD 240nm值所需酶量为1个酶活力单位。酶活性用U/(min·g)表示。酶活性检测均用TU-1901型紫外分光光度计测定。数据处理与分析用SPSS11.5进行,绘图用EXCEL2003进行。
2 结果与分析
2.1 不同剂量氮离子束处理对双胚苗水稻种子电解质外渗率的影响
逆境伤害会造成生物体质膜选择透性的改变或丧失,进而使细胞内的物质,尤其是电解质大量外渗,引起组织浸泡液的电导率值发生变化。通过检测外渗液电导率变化,可知质膜的伤害程度和所测材料的抗逆性大小。由表1可知,氮离子注入后,水稻种子浸泡液相对电导率值均比对照增加,09-02-01的增幅为0.02~3.31,平均增幅为1.252; 09-04-01的增幅为0.32~3.07,平均增幅为1.132。离子注入后09-04-01种子浸泡液的相对电导率平均增幅低于09-02-01。09-02-01与09-04-01均呈现出增加→减小→增加→减小的变化趋势,且二者均在3.0×1017N+/cm2和7.0×1017N+/cm2剂量注入时相对电导率较低,6.0×1017N+/cm2剂量注入时相对电导率较高。
表1 氮离子注入后水稻种子浸泡液相对电导率

2.2 不同剂量氮离子束处理对双胚苗水稻幼苗苗高的影响
对照组的苗高较为整齐,离子注入后的苗高整齐度较差(图1)。不同剂量离子注入后的平均苗高统计如表2。由表2可看出,离子注入后09-02-01和09-04-01的苗高与对照相比均降低,09-02-01的降低幅度变化范围为0.36~1.23cm,平均降幅为0.732cm; 09-04-01的降低幅度变化范围为0.03~0.72cm,平均降幅为0.478cm。09-04-01苗高的平均降幅低于09-02-01。09-02-01苗高在4.0×1017N+/cm2剂量下出现峰值,达(3.84 ±0.68)cm,比对照低0.36cm; 09-04-01苗高在3.0×1017N+/cm2剂量下出现峰值,达(3.81 ±0.70)cm,仅比对照低0.03cm。09-02-01苗高在1.0×1017、6.0×1017和7.0×1017N+/cm2剂量下与对照相比差异极显著,在3.0×1017 N+/cm2剂量下与对照相比差异显著。09-04-01苗高在6.0×1017N+/cm2和7.0×1017 N+/cm2剂量下与对照相比差异极显著,在1.0×1017N+/cm2剂量下与对照相比差异显著。
图1 离子注入后的双胚苗材料
表2 离子注入后水稻幼苗生长的状况

注:*与**分别表示与对照相比差异显著(P<0.05)和极显著(P<0.01)
2.3 不同剂量氮离子束处理对双胚苗水稻幼苗根数和根长的影响
由表2可看出,09-02-01的根数和根长随注入剂量的增加均呈现下降→上升→下降→上升的变化趋势。根数在1.0×1017N+/cm2注入剂量下最多,达到4.88 ±0.72,比对照增加了22%,差异显著;在3.0×1017N+/cm2注入剂量下最少,为3.45 ±1.15,比对照减少了13.75%,与对照差异显著。09-02-01的根长均低于对照,降低幅度变化范围为0.49~1.57cm,平均降低幅度为1.114cm。从3.0×1017N+/cm2注入剂量开始其与对照相比均差异极显著,在6.0×1017N+/cm2注入剂量下最低,为(1.98 ±0.75)cm,比对照低1.57cm。
09-04-01的根数随注入剂量的增加呈现先增多后减少的变化趋势,根长呈现出上升→下降→上升→下降的变化趋势,且除1.0×1017N+/cm2剂量外其他剂量下的根长均高于对照,这与09-02-01明显不同。09-04-01根数在3.0×1017N+/cm2注入剂量下最多,达到3.40 ±0.83,比对照增加8.62%;根长在3.0×1017N+/cm2和6.0×1017N+/cm2注入剂量下出现峰值,3.0×1017N+/cm2注入剂量下为(3.09 ±0.80)cm,比对照增加10.75%;6.0×1017N+/cm2注入剂量下最高,达到(3.31 ±0.50)cm,较对照增加18.64%,差异显著。
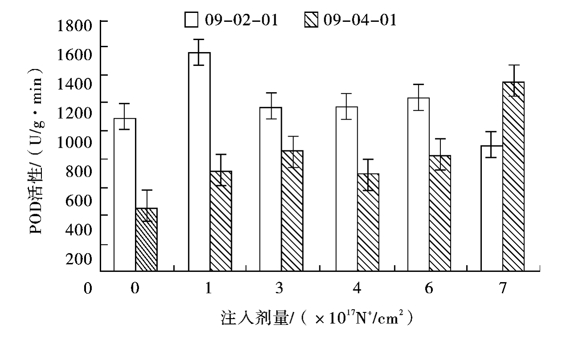
2.4 不同剂量氮离子束处理对双胚苗水稻幼苗POD活性的影响
由图2可知,随着注入剂量的增加,09-02-01和09-04-01的POD活性均有先上升后下降的变化趋势。在1.0×1017N+/cm2剂量下,09-02-01的POD活性出现峰值,达1558.478 U/(g·min),为对照的1.4倍; 09-04-01的酶活性为对照的1.6倍。在3.0×1017N+/cm2剂量下,09-02-01的酶活性比峰值下降了24.67%;而09-04-01的酶活性进一步升高达到峰值853.412 U/(g·min),是对照的1.9倍。09-02-01POD活性在3.0×1017~6.0×1017N+/cm2剂量范围内处于相对稳定的阶段,09-04-01则在4.0×1017~6.0×1017N+/cm2剂量范围内POD活性处于相对稳定的阶段。7.0×1017N+/cm2注入剂量时09-02-01POD活性比对照下降了18.92%;而09-04-01POD活性则急剧上升,为前一个峰值的1.58倍,与对照相比差异显著(P<0.05)。
 (www.chuimin.cn)
(www.chuimin.cn)
图2 氮离子注入对双胚苗水稻幼苗POD活性变化的影响
2.5 不同剂量氮离子束处理对双胚苗水稻幼苗SOD活性的影响
由图3可知,2个水稻品系的SOD活性随注入剂量增加均有先上升后下降又上升的趋势,与POD活性变化有一定相似,且除09-02-01在6.0×1017N+/cm2剂量时SOD活性低于对照外,其他各剂量下SOD活性均高于对照。09-02-01和09-04-01SOD活性在1.0×1017N+/cm2注入剂量下均达到峰值,前者的酶活性达到1254.614 U/(g·min),为对照的1.9倍;后者的酶活性达到954.555 U/(g·min),为对照的4.89倍,与对照相比均差异显著(P<0.05)。09-02-01在1.0×1017~4.0×1017N+/cm2剂量下SOD活性处于相对稳定的阶段,而09-04-01的SOD活性则在3.0×1017N+/cm2剂量下比峰值下降了52.38%。当注入剂量达到6.0×1017N+/cm2时,09-02-01和09-04-01的酶活性与峰值相比均显著下降。在7.0×1017N+/cm2注入剂量时,二者酶活性与6.0×1017N+/cm2注入剂量时相比均上升,09-04-01的上升幅度为09-02-01的4.48倍。
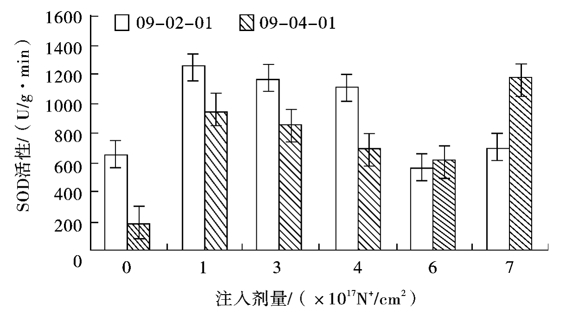
图3 氮离子注入对双胚苗水稻幼苗SOD活性的影响
2.6不同剂量氮离子束处理对水稻幼苗CAT活性的影响
经过不同剂量的氮离子束处理后,试验材料在幼苗期的CAT活性会发生相应的变化。由图4可知,随着剂量的变化09-02-01CAT活性逐渐下降,而09-04-01CAT活性呈现出先上升后下降的变化趋势。09-02-01在各处理剂量下酶活性均低于对照,在1.0×1017~4.0×1017N+/cm2剂量范围内酶活性有一个相对稳定的阶段,这一阶段后酶活性急剧下降,到7.0×1017N+/cm2注入剂量时与对照相比下降了38.6%,这与SOD活性变化类似。09-04-01酶活性在1.0×1017N+/cm2剂量下达到峰值,为对照的1.4倍,之后随着剂量的增加酶活性急剧下降,到4.0×1017N+/cm2剂量时与对照相比下降了25.64%,之后下降幅度减慢。
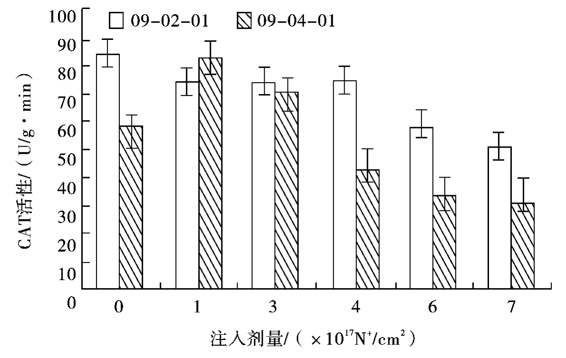
图4 氮离子注入对双胚苗水稻幼苗CAT活性的影响
3 讨论
低能离子注入种子的过程发生了能量沉积、动量传递、电荷交换和质量沉积,由此引起生物体发生复杂的物理化学变化,进而诱发多种生物学效应的产生,最终导致植物遗传物质的损伤和细胞生理生化功能的改变[20]。本试验中,经氮离子注入处理后干种子浸泡液的电导率值均高于对照,说明离子注入对细胞膜造成一定程度的损伤。魏胜林等[21]的研究表明,低剂量的氮离子注入主要通过注入氮离子的动量对种皮“溅射”和“掘进”,使种皮留有许多穿孔或通道,大大增加了种子萌发初期对H2O2的通透性和少量N+进入种胚形成了“电荷沉积”中高剂量的N+注入会对种子形成“损伤-修复-损伤”的生物学效应,损伤主要由离子注入的能量沉积和动量传递所产生的自由基伤害引起,而中间的修复主要由离子注入的质量沉积和电荷交换与自由基发生竞争性反应或N+俘获电子使水分激发产生OH减少引起的。自由基也会对细胞膜造成损害,从而引起细胞膜通透性的改变。因此,在本研究中1.0×1017N+/cm2的低剂量注入下细胞膜通透性增加,之后随着剂量的增加细胞膜通透性呈现出减小、增加、减小的变化趋势,这是“损伤-修复-损伤”生物学效应在细胞膜上的表现。这一效应在3种酶活性变化上也有明显的体现。另外从幼苗的生长状况来看,氮离子注入对苗高产生了抑制作用,而对根则在一定注入剂量下表现出促进的作用。离子注入对根作用的变化趋势与魏胜林等[21]的研究结果一致。氮离子的注入引起生物体产生大量的自由基,SOD、CAT和POD是生物体内清除自由基的主要酶系,SOD促使O-2转化为H2O2,而POD和CAT是清除H2O2的酶,三者在阻断自由基上呈现出承上启下的作用[22]。本研究中3种酶活性均有先升后降的变化趋势,这与陆佳[23]、冯亮英等[24]的研究结果一致,而且酶活性随着剂量的变化会有一定波动。与前人研究结果不同之处在于本研究中POD和SOD均在高剂量时活性较强,这可能是因为高剂量的N+注入刺激了相关基因的表达或者是提高了酶的活性,这有待进一步的研究。09-02-01离子注入后的CAT活性均低于对照,笔者认为这可能是离子注入对控制CAT合成的相关基因造成了损伤或者影响了CAT合成的相关代谢活动。综上所述,同源四倍体双胚苗水稻对离子注入的耐受性强于相应的二倍体,因此可以通过低能离子束技术对二倍体材料进行遗传改良,为筛选无融合生殖水稻材料提供丰富的种质资源。本研究也为离子束生物技术在水稻多倍体育种方面的应用提供了一定的参考。
[1]Yu Z L,Deng J G,He J J,et al.Mutation breeding by ion implantation[J].Nucl Instrmeth B,1991,59: 705-708.
[2]冯亮英,董喜存,李文建,等.碳离子辐照对甜高粱种子萌发及幼苗酶活的影响[J].安徽农业科学,2009,37(33):16286-16288.
[3]吴跃进,余增亮,吴家道,等.离子注入在生物改良上的应用[J].核农学通报,1996,16(6):288-290.
[4]赵连芝,王勇,甄东升,等.春小麦突变新品种——“陇辐2号” [J].核农学报,
2005,19(1):80-80.
[5]魏良明,蒋鸿勋,胡学安,等.植物诱变新技术及其在玉米育种上的应用[J].玉米科学,2000,8(1):19-20.
[6]袁成凌,余增亮,张宏慧.富含花生四烯酸(AA)微生物油脂提取及富集研究[J].粮食与油脂,2001,(5):6-7.
[7]颉红梅,卫增泉,李文建.7meV/u O6 +离子对庆大霉素生产菌诱变的初步研究[J].辐射研究与辐射工艺学报,1995,13(2):99-101.
[8]郭金华,谢传晓,徐剑,等.N+注入对大豆种子活力及幼苗的抗氧化酶活性影响[J].激光生物学报,2003,12(5):368-372.
[9]赵帅鹏,黄群策.无性系培养技术在水稻遗传改良中的应用前景[J].安徽农业科学,2008,36(10):4021-4023.
[10]黄群策.被子植物的无融合生殖[M].福州:福建科学技术出版社,2000.
[11]黄雅琴,黄群策,燕晓阳.水稻双胚苗种子的特征研究[J].郑州大学学报(理学版),2009,41(4):97-102.
[12]Hanna W W.Use of apomoxis in cultivar development[J].Advance in Agronomy,1995,54: 333-350.
[13]黄群策,胡秀明,梁秋霞.同源四倍体双胚苗水稻雄配子体的发育特征[J].中国稻米,2007,4-14.
[14]胡秀明,黄群策,贾宏汝,等.不同温度条件下同源四倍体双胚苗水稻的双苗率研究[J].河南农业科学,2007,4: 22-24.
[15]代西梅,黄群策,胡秀明,等.离子束诱变水稻多胚苗突变株的筛选及其多胚来源[J].原子核物理评论,2007,24(2):124-128.
[16]徐本美,顾增辉.测定种子电导率方法的探讨[J].种子,1983(1):18-23.
[17]李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2004: 164-165.
[18]Stewert R C,Bewley J D.Lipid peroxidation associated with accelerated aging of soybean axes[J].Plant Physiol,1980,65: 245-248.
[19]邹琦.植物生理学[M].北京:中国农业出版社,2000.
[20]Yu Zengliang.Introduction of ion beam biotechnology[M].Hefei: Anhui Science and Technology Press,1998.
[21]魏胜林,刘竞男,王陶,等.N+注入对甘草种子萌发和根发育效应及作用机制[J].草业学报,2004,13(5):112-115.
[22]葛娟,齐丽杰.Ar离子注入对紫花苜蓿发芽、生长及幼苗脂质过氧化的影响[J].种子,2005,2: 38-41.
[23]陆佳,李志辉,张斌,等.氮离子注入对仿栗种子当代生理生化性状的影响[J].核农学报,2008,22(5):617-620.
[24]Feng Liang ying,Dong Xicun,Li Wenjian,et al.Effect of C + ions beam irradiation on seed germination and enzymes activity in seedlings of sweet sorghum[J].Agriculture Science & Technology,2009,10(5):22-25.
【注释】
(1)该文曾在《核农学报》 [2011,25(2):214~219]刊出
有关水稻染色体组多倍化研究的文章

同源四倍体双胚苗材料在其性状表达特征、性状表达频率和性状表达的条件等方面均显现出一定的特异性。在同源四倍体双胚苗材料中,其苗位特征表现出明显的多样性。对于同源四倍体水稻群体内所出现的双胚苗突变材料,按照单株筛选法对其进行2个世代的筛选和纯化,待其主要农艺性状稳定后按照试验设计对其双胚苗的形态特征及其性状稳定性进行了研究。......
2023-11-28

稻属植物的进化特点及其潜在价值黄群策王书玉张书艮摘要概括了稻属植物的种群特征及进化特点。关键词稻属植物;种群特征;进化特点;染色体组多倍化;产量潜力在植物物种的自然演化进程中,稻是一种起源比较早、进化程度比较高的古老植物类群。稻属植物是禾本科中非常重要的植物种群,在该属内包含有23个物种,它们广泛分布于全球的热带地区和亚热带地区。......
2023-11-28

关于多倍体水稻的诱导技术前人已经进行过一些研究[7,8],而关于水稻多倍化的诱导效果与其原始材料的关系的研究目前尚未见到公开的文献报道。对每份材料中所获得的同源四倍体水稻植株的数量进行统计分析,计算多倍化的诱导效果。由此可见,利用常规水稻品种和光温敏核不育水稻品系为诱导材料,其多倍化的诱导频率均很低。利用杂种F1群体为试验材料经过多倍化诱导和筛选后所获得的......
2023-11-28

我国超级稻育种的技术性突破促使稻属遗传改良的水平提升到新的研究层次并给水稻生产带来了革命性的巨变。通过现代生物技术进一步挖掘稻属植物的增产潜力和提高遗传改良水平已经成为水稻育种中的研究热点[7]。其二,在水稻遗传改良的研究领域内研究范围的局限性明显地限制着这一学科在挖掘稻属植物杂种优势效应上发生根本性突破。......
2023-11-28

然而,在千粒重和结实率上,不同染色体组倍性的籼粳亚种间杂种第一代所表现出的差异特别明显。同源四倍体籼粳亚种间杂种第一代在千粒重和结实率上所表现出的特点是挖掘其产量潜力的性状基础。关于同源四倍体籼粳亚种间杂种第一代的产量潜力问题近年来已经引起了一些研究者的关注,但尚未见到公开的文献报道。......
2023-11-28

研究结果表明,不同倍性的普通栽培稻与非洲栽培稻之间不存在严格的生殖隔离,通过有性杂交可以获得杂种第一代种子,但其结实率因普通栽培稻的倍性水平而异。由此认为,利用同源四倍体水稻为杂交母本与非洲栽培稻杂交更容易将后者的遗传物质引入到亚洲栽培稻。以同源四倍体水稻为杂交母本,以非洲栽培稻为花粉供体所配制的16个杂交组合均表现出明显的营养生长优势。......
2023-11-28

水稻多倍化及其同源多倍体的潜在价值黄群策代西梅摘要在水稻遗传改良领域我们面临着两大难题需要探索,即如何在促进稻属植物在物种升级的过程中进一步提高其产量潜力和怎样才能固定稻属植物的杂种优势效应。多倍体水稻包括同源多倍体水稻、异源多倍体水稻和同源异源多倍体水稻等多种类型。从同源多倍体水稻的研究现状来看,存在着三大......
2023-11-28

一系法杂交水稻研究的技术策略探讨黄群策摘要通过一系法利用和固定水稻的远缘杂种优势是一项具有极大诱惑力但难度颇大的科研难题。由于多倍体水稻的有性生殖能力明显变弱,在多倍性水平筛选和创造水稻无融合生殖种质有可能成为一系法杂交稻研究的突破口。目前,我国水稻无融合生殖的研究仍然停留在探索性阶段,其首要任务就是要通过采用新的技术路线和策略尽快筛选出具有育种价值的无融合生殖种质。......
2023-11-28
相关推荐