低能氮离子束对不同倍性水稻的诱变效应黄群策代西梅摘要对二倍体水稻和同源四倍体水稻进行了低能氮离子束注入处理并对其生物学效应进行了鉴定。由此认为,利用低能离子束注入技术对同源四倍体水稻进行遗传改良的效果值得肯定。在成熟期,以水稻的主要农艺性状为考查对象,统计群体内变异植株出现的频率,以便研究低能氮离子束的诱变效应。......
2023-11-28
离子束诱变水稻多胚苗突变株的筛选及其多胚来源(1)
代西梅 黄群策 胡秀明
摘要 以低能氮离子束为诱变源,通过对同源四倍体水稻品系“IR36-4X”进行离子注入后在其第2代群体内筛选得到了1株具有多胚苗性状特征的突变株(IR36-双),对该突变株后代的多胚苗形态特征及其多胚来源进行了研究。结果表明,多胚苗突变株系“IR36-4X”在双胚苗性状的表现形态上有其特异性,在同一纯合株系的群体内双胚苗的苗位有非完全双苗和完全双苗两种类型。非完全双苗包括单胚轴单胚根双苗和单胚根异胚轴双苗这两种类型;完全双苗也可以进一步划分为正常双苗和异常双苗两种类型。在多胚苗材料中,单胚根单胚轴双苗所占的比例相对较大。其多胚(额外胚)的来源主要有4种可能性,即双套胚囊形成多胚、多卵卵器形成多胚、反足细胞团发育形成不定胚及胚乳细胞形成不定胚(胚乳细胞胚状体)。由此可见,“IR36-4X”植株表现双胚苗性状有其胚胎学根源。
关键词 离子注入;同源四倍体水稻;多胚苗突变体
1 引言
水稻是世界上最重要的粮食作物之一,在世界粮食生产与消费中占有极其重要的地位。水稻育种是提高水稻产量的有效途径。目前,我国水稻育种面临着两大难题有待攻关,即怎样通过有效的方法和途径在现有的产量水平上更有效地挖掘水稻的杂种优势效应和固定水稻的杂种优势效应。固定杂种优势的途径可能有多种,其中以培育无融合生殖系最有前途[1]。而通过筛选多胚苗来寻找无融合生殖材料是一种较为有效的途径。20世纪80年代中期发展起来的离子束生物技术具有独特的技术原理和简单的操作程序,在作物育种中其实用性已经被越来越多的研究结果所证实,也引起了越来越多研究者的关注和重视[2]。离子束作为新的诱变源具有质量、能量和电荷三位一体的功效,在损伤比较轻的诱变状态中,可以获得比较高的诱变率和比较宽的诱变谱[3]。有研究表明,同源四倍体水稻比二倍体水稻对低能氮离子束注入处理更敏感[4]。本文利用低能氮离子束注入同源四倍体水稻,在其M2代植株中发现1株具有多胚苗特性的突变株,对其多胚苗形态特征和多胚起源的细胞学机制做了研究。
2 材料与方法
2.1 实验材料
IR36同源四倍体水稻(IR36-4X):由本实验室利用秋水仙碱处理ⅠR36-2X,使其染色体成功加倍且稳定的同源四倍体水稻体系。2001~2003年离子注入后的种子和对照种子(未注入)及其后代在温箱中催芽,然后单株播种于合肥中国科学院等离子体物理研究所的水稻实验田。2004~2005年将实验材料种植于河南新乡市农业科学研究院水稻研究所的实验田,采用常规管理。
2.2 实验方法
2.2.1 低能N+注入
将水稻种子去壳后胚朝上置于铺有花泥的培养皿中,采用间隔为50 s的脉冲注入,在靶室中经能量25 keV的不同剂量N+注入,注入剂量范围是2.0×1016~10.0×1016ions/cm2,每个处理组间隔2.0×1016ions/cm2。对照组同样放置在靶室中,但不经离子注入。离子注入实验2001年在中国科学院等离子体物理研究所进行。
2.2.2 多胚苗突变株多胚来源的观察
用核荧光染色和子房整体透明技术对水稻双受精过程和胚胎发育过程进行观察。具体方法是,分别取开花后0.5h、1h、2h、3h、4h、5h、6h和12h以及1 d、2 d、3 d、5 d和7 d的颖花用FAA固定液固定,并保存于FAA固定液中。每个时期约取颖花50个。观察前用70%的酒精冲洗一下,然后在解剖镜下分离出子房,保存于70%酒精中备用。染色前,各个时期的水稻子房经50%、30%和15%乙醇直至蒸馏水进行复水处理,每次20min。用pH =8.2磷酸盐缓冲液预处理2h,然后用0.005%水溶性苯胺蓝溶液染色2h。蒸馏水冲洗2~3次,再用1 μg/mL的DAPI溶液染色12h。用蒸馏水冲洗2~3次,乙醇梯度(15%、30%、50%、70%、85%和95%)脱水,每级20min,随后将子房放入无水乙醇中脱水两次,每次脱水时间为2h,接着,再转入无水乙醇中过夜。第2天将已经脱水的材料在无水乙醇和水杨酸甲酯组成的混合液(1∶1)中过渡1h,然后再用水杨酸甲酯透明处理3次。在前两次透明处理时,每次2h,最后一次处理的时间为15h。试验材料经过水杨酸甲酯透明处理后可以在水杨酸甲酯中保存备用。观察前,用镊子轻轻将处理好的子房夹出,置于凹玻片上,用丁香油封片(注意加盖玻片时不要挤压,防止子房变形或破裂)。将制备好的载玻片倒置于Leica SP2激光共聚焦扫描显微镜上,用488nm波长的激光激发,扫描获得双受精及胚胎发育过程的各个时期的清晰图片,并用Leica相关软件对系列扫描图片进行3 D重建。对于受精后子房较大的材料,可直接放在和激光扫描共聚焦显微镜相配套的小培养皿中,用同样的方法进行激光扫描共聚焦显微镜观察。
3 结果与分析
3.1 多胚苗突变株的筛选及其株系的建立
IR36-4X经各种剂量的低能N+注入处理后,成苗率除在剂量为2.0×1016ions/cm2时稍有增加外,经其他剂量N+注入处理后,成苗率均比对照组有所下降,其中以剂量为10.0×1016ions/cm2成苗率最低,仅有20%左右。在当代没有发现明显的变异现象。收取所有的M1代种子,并于第2年(2002年)种植M2代。在剂量为4.0×1016ions/cm2的低能N+注入处理ⅠR36-4X的M2代植株中,发现了一株多胚苗突变株(命名为“IR36-双” ),即在一粒水稻种子中萌发出了两个稻苗。该突变株形成的两个苗为均势双苗。即形成的两个苗在长势上大小相当,没有强弱之分。该双胚苗突变株经根尖染色体鉴定,两个单苗染色体数目均为48条[见图1(a)],比我们观察的二倍体水稻IR36-2X的染色体数目[见图1(b)]增加了1倍。保持了其原始亲本IR36-4X的染色体数目,因此应为同源四倍体双胚苗水稻。值得特别提出的是,我们在对其对照IR36-4X的观察过程中,没有发现任何双胚苗或多胚苗植株。这说明我们筛选到的“IR36-双”双胚苗植株是经低能氮离子束处理后的突变植株。
当年成熟后单株收获该双胚苗突变株,共收取576粒种子。于第3年(2003)种成M3代株系,并对该多胚苗突变株系的苗位进行了跟踪调查。

图1(a )“IR36-双”染色体; (b)IR36-2X染色体
3.2 “IR36-双”双苗苗位的观察
邓鸿德等[5]根据对多胚水稻胚位与苗位的观察研究,将多胚水稻双苗分为非完全双苗和完全双苗两类。非完全双苗又可进一步分为单胚轴单胚根双苗、单胚轴异胚根双苗和单胚根异胚轴双苗;完全双苗又可分为正常双苗和异常双苗(大小苗)。
根据对“IR36-双”双苗苗位的观察,发现其双苗苗位也有非完全双苗和完全双苗两种情况。非完全双苗中主要有单胚轴单胚根双苗[见图2(a)]和单胚根异胚轴双苗[见图2(b),(c),(d)]两种;完全双苗中有正常双苗[见图2(e)]和异常双苗(大小苗)[见图2(f)]。在“IR36-双”双苗中,单胚根单胚轴双苗所占比例相对较大。

图2(a)单胚轴单胚根双苗; (b)~(d)单胚根异胚轴双苗; (e)正常双苗; (f)异常双苗(www.chuimin.cn)
3.3 “IR36-双”多胚苗中多胚的可能来源
根据对“IR36-双”双受精过程和胚胎的发育过程的观察,认为“IR36-双”多胚苗的多胚主要有以下几个来源。第一,卵器中的卵细胞与类卵细胞分别受精形成多胚。在“IR36-双”成熟胚囊中以及开花后的胚囊中都存在一定频率的多卵卵器,多卵卵器中的卵细胞和类卵细胞可以分别受精而形成多胚[见图3(a),(b)]。第二,来源于双套胚囊形成的假多胚。在对“IR36-双”成熟胚囊的观察过程中,发现有一定频率的双套胚囊的存在,双套胚囊中各有一套卵器,可以分别受精而发育成假多胚[见图3(c)]。第三,反足细胞发育形成多胚。在对“IR36-双”胚胎发育过程的观察中发现,有一定频率的胚囊内的反足细胞在开花后3 d左右并不解体消失,反而逐渐发育成胚[见图3(d)],这也可能是“IR36-双”形成多胚的来源之一。第四,胚乳细胞发育成胚乳胚状体。在对“IR36-双”胚胎发育过程的观察中发现,胚乳细胞可以发育成胚乳胚状体,胚乳胚状体的发育进度比合子胚要快。胚乳胚状体已经开始分化,而合子胚还处在球型胚阶段[见图3(e)]。
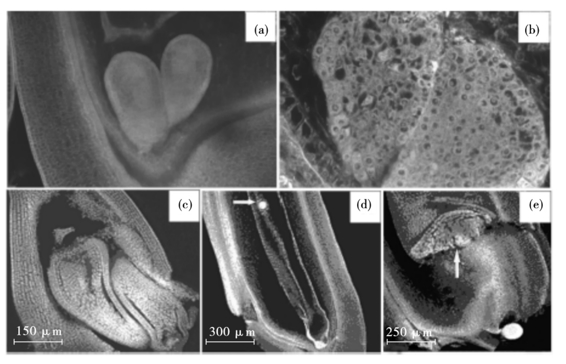
图3 “IR36-双”双胚的来源
(a),(b)在胚囊的珠孔端有两个大小均等的胚,可能是两个卵细胞分别受精形成的; (c)双套胚囊; (d)在开花后3 d的胚囊内,反足细胞团发育成类似于合子胚状的球型胚(如箭头所示); (e)在开花后5 d的胚囊内,胚乳细胞形成1个胚乳胚状体(如箭头所示)
4 讨论
水稻育种的历史经验已经充分地说明,育种新材料的发现、育种新方法的建立、育种新思路的提出都有可能使水稻育种水平得到明显提高。离子束生物工程是20世纪80年代在我国兴起的新的研究领域,其原理是利用低能离子束注入生物体,由于加速后的离子注入生物体后会产生质量沉积、能量沉积和电荷交换,由此会导致生物材料产生一定的生物学效应。这为农作物的遗传改良开拓了新途径。因此离子束生物技术发展起来以后,在农作物育种和遗传改良中得以广泛应用。关于利用低能离子束生物技术对二倍体水稻及四倍体水稻进行遗传改良的研究已有一些报道[6-8]。本文通过利用低能N+对同源四倍体水稻IR36-4X进行注入处理,在其M2代筛选出了一株多胚苗突变株(“IR36-双” )。通过对“IR36-双”双受精过程及胚胎的发育过程的观察,推测“IR36-双”多胚可能由以下几个来源:①来源于双套胚囊形成的假多胚;②多卵卵器中的卵细胞与类卵细胞分别受精形成多胚;③反足细胞发育形成不定胚;④胚乳细胞发育成胚乳胚状体。“IR36-双”多胚突变体的形成很可能是由于低能离子束的诱变作用引起控制雌配子体发育基因的突变引起的。雌配子体在植物生殖发育过程起着非常重要的作用,它参与诱导花粉管的定向生长、双受精过程及胚和胚乳的发育过程等[9]。植物基因组中包含大量雌配子体表达基因,在雌配子体各个发育时期进行表达。任何一个基因的突变都会引起雌配子体发育的异常或败育。注入离子与生物体内靶分子、原子碰撞、级联碰撞和反冲,不仅发生能量沉积过程,而且发生质量沉积过程和电荷交换过程。大量研究证明,离子在生物体内的能量沉积、质量沉积和电荷交换可以引起染色体的破坏和基因的突变[10-13],从而导致一系列遗传变异现象的发生。本项研究在一定程度上证实了离子注入技术在创造多倍体水稻新种质中的实用性,这将为水稻无无融合生殖种质材料的寻找提供一条新途径。
[1]袁隆平.杂交水稻的育种战略设想[J].杂交水稻,1987,1: 1.
[2]余增亮.离子束生物技术引论[M].合肥:安徽科学技术出版社,1998,1-3.
[3] Yu Zengliang,Yang Jianbo,Wu Yuejin,etal.Nucllns trandmeth,1993,B80/ 8l: 1328.
[4]黄群策,梁秋霞,李玉峰,等.低能氮离子注入同源四倍水稻的生物学效应[J].激光生物学报,2003,12(5):355.
[5]邓鸿德,潭志军,黄逸强.多胚水稻胚粒与同位的观察研究[J].西北植物学报,1992,12(1):1.
[6]王彩莲,慎玫,陈秋方,等.氮离子注入对水稻诱变效应的初步研究[J].核农学报,1995,9(1):13.
[7]戚秀芳,赵成章,杨长登,等.等离子注入对水稻主要农艺性状的影响[J].安徽农业科学,1993,21(2):102.
[8]黄群策,代西梅.杂交水稻,2004,19(3):57.
[9]Yadegari R,Drews G N.The Plant Cell,2004,16: S133.
[10]余增亮,何建军,邓建国,等.离子注入小麦诱变育种的回顾与展望[J].安徽农业科学,1989,39(1):12-16.
[11]Yu Zengliang.IEEE Transactions on Plasma Science,2000,28(1):128.
[12]Du Yanhua,Huang Shenghai,Tang Zheng,eta l.Chin SciBull,1999,44(8):711.
[13]Chen Yu,Jiang Bingyao,Chen Youshan,etal.Radiat Environ Bi-ophys,1998,37: 101.
【注释】
(1)该文曾在《原子核物理评论》 [2007,24(2):]刊出
有关水稻染色体组多倍化研究的文章

低能氮离子束对不同倍性水稻的诱变效应黄群策代西梅摘要对二倍体水稻和同源四倍体水稻进行了低能氮离子束注入处理并对其生物学效应进行了鉴定。由此认为,利用低能离子束注入技术对同源四倍体水稻进行遗传改良的效果值得肯定。在成熟期,以水稻的主要农艺性状为考查对象,统计群体内变异植株出现的频率,以便研究低能氮离子束的诱变效应。......
2023-11-28

换句话说,就是由于TEM自身的不完整性,最终获得的图像与物体之间不可避免地存在着失真现象。图像与物体之间的差,就被称为“像差”。这里主要介绍三种像差的来由。色差的存在对于TEM的会聚能力给出了一个限制。这种焦距与离开磁透镜中心距离相关的像差,被称为球差。这种由磁场分布不均匀而造成的像差对成像质量的影响非常大。这些用于消除像散的线圈组被称为消像散器。......
2023-06-20

闻一多,又名亦多,辈名家骈,字友三。闻愤而撰写《“一二·一”运动始末记》,将惨案真相大白于天下,并为死难四烈士写挽词“民不畏死,奈何以死惧之”。1946年7月11日,民盟中委李公朴遭特务暗杀,特务扬言以40万元买闻人头,并扔恐吓信于其家属。其遗著由朱自清、郭沫若、吴晗、潘光旦、叶圣陶等负责编成《闻一多全集》共4卷,于1948年8月由开明书店出版。......
2023-11-26

若单击“按颜色筛选”项:展开列表,从中可按单元格颜色或按字体颜色对数据进行筛选,如图7-17所示。如果想取消对数据列表中某一列进行的筛选:单击该列的字段名右端的向下箭头,再选中“全选”复选框,然后单击“确定”按钮。如果想取消对数据列表中所有列进行的筛选:单击“数据”选项卡“排序和筛选”组的“清除”按钮。......
2023-11-23

其中,司法统计资料,与《最高人民法院公报》所披露的司法统计数据是一致的。其二,内容全面,该书详细披露了历年司法审判的统计数据。目前,从基层人民法院的统计数据,到最高人民法院的统计数据,都可以通过公共网络获得。......
2023-08-06

在章学诚的方法中,有着严重的哲学危害。将刘歆视为章学诚哲学立场的来源、将其思想视为刘歆思想中隐含着的可能性的富有想象力的展开,是颇具诱惑的。但是,如果认为章学诚的思想导源于对“官师”这个词的分析,那将肯定是荒谬的。事实上,章学诚的整个古代观似乎是对朱筠的写作理想的一种肯定。章学诚习惯性地将对知识的寻求与对知识的使用分别开来,将王阳明的个人道德问题看做整体社会政治组织的问题。......
2023-11-20

表1-1 蒸馏水中不同水分子的摩尔百分含量在水的同位素研究中,通常选择某种水为标准,比较其密度差。天然水的总同位素密度变化于-23r至+21r之间。随着地下封闭性的增强,水的重同位素增加,可达+7r、+8r。一般认为,蒸发作用是促成天然水中同位素分离的主要作用。南极的雪水是地球上最轻的,其大部分样品的总同位素成分低于-13r至-23r,故南极冰是由海洋上空的大气水形成。......
2023-06-30
相关推荐