根据离子束生物技术的特殊性和实用性,我们以低能氮离子束为诱变源,对同源四倍体水稻进行诱变处理,旨在对其诱变的生物学效应进行研究,以便筛选出具有实用价值的同源四倍体水稻新种质。在成熟期,以水稻的主要农艺性状为考查对象,统计群体内变异株出现的频率,以便研究低能氮离子束的生物学效应。......
2025-09-30
离子注入水稻细胞学效应研究(1)
代西梅 张佳佳 杨旭 黄群策
摘要 以水稻品种紫粳二倍体和四倍体为实验材料,以低能氮离子束为诱变源,研究了离子束诱变对水稻根尖细胞染色体的影响.结果发现,低能离子束注入引起了水稻根尖分生区细胞有丝分裂异常,出现许多染色体畸变类型,包括后期染色体桥、落后染色体、染色体断片、中期染色体单价体等.染色体畸变率并不是随着剂量的增加呈现直线上升的趋势,而是有一定的摆动性,但总体趋势是注入剂量越大,畸变率越高.由此可见,离子注入引起水稻染色体异常是其发生遗传性变异的细胞学基础.
关键词 水稻;离子束注入;有丝分裂;诱变;染色体
0 引言
20世纪80年代中期发展起来的离子束生物技术[1],具有独特的技术原理和简单的操作程序,在作物育种中其实用性已经被越来越多的研究结果所证实[2-3]。它具有质量、能量、电荷三位一体的功效,损伤轻,诱变率高,诱变谱宽[4],在诱变育种中取得了不少成果[5-6]。但其基础理论研究仍很薄弱,尤其是从染色体以及蛋白质分子水平开展的研究甚少[7-8]。同时低能重离子与生物物质的相互作用不但涉及能量沉积,而且还包含质量沉积及动量传递、电荷交换等物理过程,因而其作用机制比γ射线复杂得多,致使生物体诱变的作用机制仍未有统一的、合理的、明确的解释。
水稻是世界上重要的粮食作物之一,对其遗传学和细胞学的研究已有上百年的历史。
作者通过对离子束注入处理的水稻与其对照进行细胞学及染色体形态的研究,探讨了离子注入对水稻诱变的特点,并利用离子注入技术提高水稻的突变率,筛选变异材料,用于水稻遗传育种研究。
1 材料与方法
1.1 实验材料
试验中所采用的水稻品种紫粳二倍体及其相应的同源四倍体材料均属本实验室所有,其遗传基础相当稳定。
1.2 离子注入方法
挑选籽粒饱满的水稻成熟种子脱壳,种子胚朝上置于同一个铺有花泥的培养皿中,将其置入从俄罗斯进口的Titan脉冲式离子注入机的靶室中进行氮离子注入。注入剂量分别为4×1017N+/cm2,6×1017N+/cm2,8×1017N+/cm2。每剂量每次处理成熟干种子500粒,重复3次。在靶室中氮离子源的注入能量25 keV,注入时的真空度5×10-2Pa,采用脉冲式注入,束流200mA。未注入的同一批紫粳材料作为对照。
1.3 根尖分生区细胞有丝分裂染色体行为观察
材料准备:将种子浸泡24h后,放置在铺有湿润滤纸的培养皿中,25℃暗培养,生根。固定:幼根长1~2cm时,上午9: 00~11: 00用卡诺固定液(V酒精∶V醋酸=3∶1)固定2~24h,70%酒精清洗后放入70%酒精中4℃保存备用(保存时间一般不超过1年)。
解离:将固定好的材料放入解离液(V无水乙醇∶V37%的浓盐酸= 1∶1)中,室温下解离5~10min。
染色:用蒸馏水清洗数次,彻底洗去解离液,根尖放在解剖镜下找出分生区(一个解离良好的材料,分生区在解剖镜下是不透明的,而成熟区和根冠部分则是透明的),在解剖镜下用刀片把分生区切为2~3部分,使细胞更易着色。然后在载玻片上滴上卡宝品红染色液[9]进行染色,染色时需要在酒精灯上微微加热,染色时间10min。
压片:将盖玻片的一侧与染色液接触,待染色液沿接触面均匀扩散后,再缓慢放下盖玻片,用吸水纸吸取多余的染色液。用拇指以适当的力度按压。用铅笔轻轻敲击盖片,使染色体充分分散。
将压好的片子置于显微镜下观察,找到良好的细胞分裂相各期细胞,对发生染色体异常行为的有丝分裂细胞进行分类统计并取相。每个处理至少观察30个根尖,每个根尖取10个视野进行观察统计。
2 结果与分析
2.1 低能氮离子处理后水稻根尖细胞的有丝分裂过程观察
有丝分裂是一个连续、动态的过程,一般分为5个时期,如图1。在这5个时期中最明显的特征就是染色体呈现出连续、动态的变化。在光学显微镜下,根据染色体的收缩程度、集结情况等特征来确定细胞所处的分裂时期。
离子注入引起染色体结构异常和细胞分裂中染色体的行为改变(图2)。结果表明,在离子注入后的根尖细胞中,出现了一些染色体或染色单体断片(图2b~d)。在分裂后期不能正常向细胞的两极移动,滞留在细胞成膜体附近,形成落后染色体(图2a);具有双着丝粒的染色体,在分裂后期可能受到来自两极的纺锤丝牵引,形成桥式结构(图2e~f),并随着分裂的进行最终导致染色体断裂,也有可能形成运动滞后的染色体。运动滞后的染色体或断片在一定的时限内不能到达细胞的极点,末期核膜重建时不能包被到子核当中,成为细胞中的微核(图2g)。其中断片形成细胞中体积较小的微核,滞后染色体形成细胞中另一类体积较大的微核。因为部分细胞中同时存在多种染色体异常,如多个断片与滞后染色体同时存在,分裂末期可能因相距较远不能包被到同一微核内,使细胞中出现多个微核。
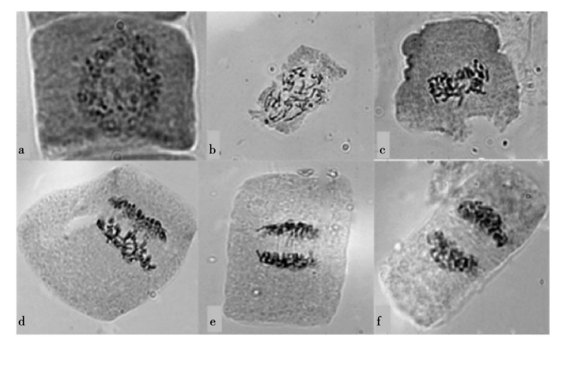
图1水稻根尖细胞有丝分裂过程的显微观察
a:间期细胞; b:前期细胞; c:中期细胞(横切面); d~e:后期细胞; f:末期细胞
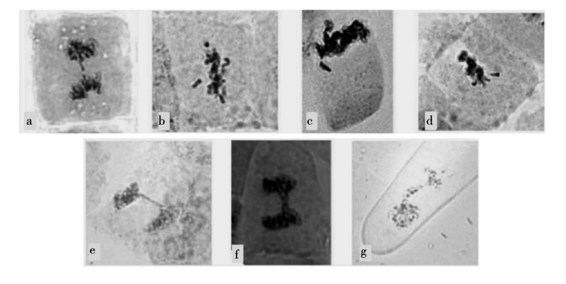
图2 离子注入材料有丝分裂染色体异常行为
a:落后染色体; b~d:染色体片段; e~f:染色体桥; g:微核(https://www.chuimin.cn)
2.2 不同剂量的氮离子注入对水稻根尖细胞染色体畸变率的影响
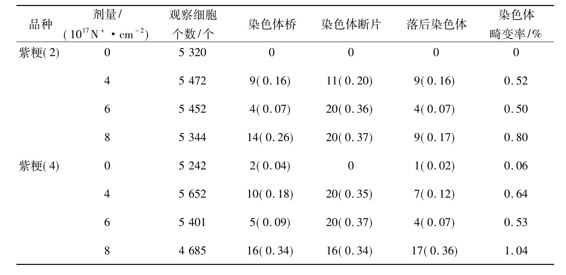
对离子注入处理的水稻根尖细胞有丝分裂进行观察,发现不同水稻材料在不同剂量处理下均出现了染色体桥、染色体小断片和落后染色体等畸变类型,但其畸变率均小于1%,如表1所示。在二倍体和对应的四倍体水稻的根尖细胞中染色体桥、染色体片段和落后染色体的畸变率并不是随着剂量的增加呈现直线上升的趋势,而是有一定的摆动性,但总体趋势是注入剂量越大,畸变率越高。4×1017N+/cm2和6×1017N+/cm2剂量处理,水稻根尖细胞染色体畸变率差别不大,6×1017N+/cm2剂量处理下的染色体畸变率稍低于4×1017N+/cm2剂量处理下的染色体畸变率。而8×1017N+/cm2剂量处理下的染色体畸变率明显提高。从表1中还可以看出,在相同剂量的处理下,紫粳四倍体水稻的畸变率稍高于二倍体水稻的畸变率。
表1 氮离子注入水稻根尖染色体畸变类型及畸变率
3 讨论和结论
通过研究离子束注入对水稻根尖细胞及其染色体形态和结构的影响,探讨了其在水稻诱变育种中的作用及机制。研究结果表明,经过离子束注入后的根尖细胞比对照材料发生染色体异常行为的概率更高。这与前人在银杏[10]、甜菊[11]和小麦[12]中的研究结果一致。有丝分裂后期出现染色体运动滞后的原因,可能主要有以下几个方面:染色体或染色单体断片因没有纺锤丝的牵引,在细胞分裂后期无法正常向细胞的两极运动,滞留在细胞的中央板附近;离子注入处理导致纺锤丝不健全或缺失,使部分染色体不能有效向极移动;由染色体错接形成的具有两个着丝粒的复杂结构,分裂后期难以正常分离,产生向极运动的滞后现象。
染色体桥的出现可能是因为双着丝粒染色体的两个着丝粒分别受到来自细胞两极的纺锤丝牵引,在两组子染色体相互分离时出现桥式结构;或者是因为染色体末端相互粘连引起[13]。
一般认为微核是由有丝分裂后期丧失着丝粒的染色体断片产生的。有实验证明,整条染色体或几条染色体也能形成微核。这些断片或染色体在分裂过程中行动滞后,在分裂末期不能进入主核,便形成了主核之外的核块。当子细胞进入下一次分裂间期时,它们便浓缩成主核之外的小核,即形成了微核。如多个断片与滞后染色体同时存在,它们在分裂末期可能因相距较远不能包被到同一微核内,可使细胞中出现多个微核[14]。
离子束注入引起水稻根尖细胞染色体异常的可能原因是,离子束作为一种新的诱变源,通过质量沉积、能量沉积、电荷作用以及表面蚀刻作用对目标细胞以及细胞内的分子结构造成了不可逆的损伤,这种损伤的过程是通过离子束的物理作用转变为分子上的化学改变,继而影响到生物化学上的功能性改变,这种改变最后被生物体的新陈代谢放大为生物学上的现象。
由此可见,离子注入可以引起水稻染色体异常,这是诱变产生变异部分的原因,也可能是其发生可遗传性变异的细胞学基础。
参考文献
[1]余增亮,王学栋,吴跃进,等.离子注入水稻育种机制初探[J].安徽农业科学,1989,39(1):12-16.
[2]余增亮,霍裕平.离子注入生物学研究述评[J].安徽农业大学学报,1994,21(3):221-225.
[3]余增亮.离子束生物技术引论[M].合肥:安徽科学技术出版社,1998: 1-3.
[4]Yu Zengliang,Yang Jianbo,Wu Yuejin,et al.Transferring GUS gene into intact rice cells by low energy ion beam[J].Nuclear Instruments andmethods in Physics Research B,1993,80/81(2):1328-1331.
[5]Yu Zengliang.The progress of ion beam bioengineering in China[J].Solid State Phenomena,2005,107: 25-30.
[6]宋云.离子束注入小麦诱变效应的研究[D].四川:四川农业大学,2004.
[7]黄群策.离子束介导技术在生物体遗传改良上的发展趋势[J].原子核物理评论,2007,24(1):59-64.
[8]潘伟.7 Li3 +离子束注入小麦的生物学效应和诱变机制研究[D].北京:中国农业科学院,2002.
[9]赵惠玲,王青.改良植物根尖压片法观察染色体[J].太原师范专科学校学报,2001,3: 26-27.
[10]胡惠露,彭镇华,周蜀生.离子注入引起银杏种子M1代染色体畸变的研究[J].安徽农业大学学报,1994,21(3):286-289.
[11]慎玫,王彩莲,陈秋方.氮离子注入甜菊的细胞学效应[J].核农学报,1997,11(3):141-144.
[12]韩榕,杨汉民.辐射敏化剂对离子注入小麦生物学效应的影响[J].核农学报,2003,17(2):85-89.
[13]仪慧兰,姜林.SO2水合物诱发蚕豆(Vicia Faba)根尖细胞染色体畸变效应[J].生态学报,2007,27(6):2318-2324.
[14]杜峰涛,李林.细胞微核形成机制探讨[J].现代检验医学杂志,2007,22(4):19-22.
【注释】
(1)该文曾在《郑州大学学报》 [2011,43(4):]刊出
相关文章

根据离子束生物技术的特殊性和实用性,我们以低能氮离子束为诱变源,对同源四倍体水稻进行诱变处理,旨在对其诱变的生物学效应进行研究,以便筛选出具有实用价值的同源四倍体水稻新种质。在成熟期,以水稻的主要农艺性状为考查对象,统计群体内变异株出现的频率,以便研究低能氮离子束的生物学效应。......
2025-09-30

由此可见,利用低能离子注入技术对同源四倍体水稻进行遗传改良的效果值得肯定,这将为解决同源四倍体水稻结实率难题和挖掘其潜在的利用价值寻找到一个新的突破口。根据离子束生物技术的特殊性和实用性,我们以低能氮离子束为诱变源,对同源四倍体水稻进行诱变处理,旨在对其诱变后的生物学效应进行研究,以便筛选出具有实用价值的同源四倍体水稻新种质。......
2025-09-30

由此认为,同源四倍体水稻的有性生殖能力已经明显变弱。关于二倍体水稻的受精过程的细胞学观察,前人已有报道[5-7]。但是,关于同源四倍体水稻的双受精过程,目前国内外尚未见到公开的文献报道。对二倍体水稻和同源四倍体水稻的双受精过程进行比较研究将有助于了解其生殖特性的差异,这对于从同源四倍体水稻中鉴定和筛选潜在的无融合生殖基因具有重大的现实意义。......
2025-09-30

关键词同源四倍体;双胚苗水稻;形态特征;性状稳定性从全球水稻遗传改良的现状来看,固定水稻杂种优势效应或简化水稻杂种优势利用的技术程序是育种者所面临的重大难题之一。对于同源四倍体水稻群体内所出现的双胚苗突变材料,按照单株筛选法对其进行3个世代的筛选和纯化,待其主要农艺性状稳定后按照试验设计对其双胚苗的形态特征及其性状稳定性进行了研究。......
2025-09-30

离子注入后同源四倍体核雄性不育水稻的育性表达特性黄群策李玉峰摘要以同源四倍体核不育水稻为研究材料,以氮离子束为诱变源完成了离子注入试验。由此认为,氮离子束注入所导致的育性变异在M3代群体内并没有发生进一步的分离。关于同源四倍体核不育水稻的育性稳定性问题前人已经有过公开的文献报道[3]。利用离子注入技术对同源四倍体核不育水稻进行处理后其雄性不育性的变异特征则是值得研究的问题。......
2025-09-30

稻属植物的进化特点及其潜在价值黄群策王书玉张书艮摘要概括了稻属植物的种群特征及进化特点。关键词稻属植物;种群特征;进化特点;染色体组多倍化;产量潜力在植物物种的自然演化进程中,稻是一种起源比较早、进化程度比较高的古老植物类群。稻属植物是禾本科中非常重要的植物种群,在该属内包含有23个物种,它们广泛分布于全球的热带地区和亚热带地区。......
2025-09-30

黄群策等[6]以低能氮离子束为诱变源对同源四倍体水稻进行了遗传改良,在其后代群体内筛选到具有双胚苗特征的新材料为了对同源四倍体双胚苗突变水稻进行有效的遗传改良,郑州大学离子束生物工程河南省重点实验室的研究人员利用无性系诱导技术对其脱分化和再分化特性进行了初步研究,试图为在细胞工程水平研究同源四倍体水稻双胚苗材料的细胞学特性提供技术资料。......
2025-09-30
相关推荐