酶是在活细胞中合成并在胞内或胞外介质中存在的。胞内酶在细胞内存在部位和结合状态比较复杂,因而抽提难度较大。酶的抽提目的是将尽可能多的酶或尽可能少的杂质从原料组织和细胞中引入溶液,以利于酶的纯化。但此法用于酶的大量提取有一定局限性。经丙酮处理的细胞干粉称为丙酮粉。丙酮还能除去细胞膜部分脂肪,更有利于酶的提取。根据酶在细胞内结合状态以及其溶解程度,酶的抽提可分为水溶法和有机溶剂法两种。......
2023-11-22
酶的催化作用主要由其活性中心完成,酶蛋白的构象也与酶的活性密切相关。因此,在制备固定化酶时,必须注意酶活性部位的氨基酸残基不发生变化,避免那些导致酶蛋白高级结构破坏的操作(例如高温、强酸、强碱等)。
固定化酶的制备方法有4种:吸附法、包埋法、共价结合法和交联法(图8-1)。
图8-1 固定化酶的制备方法
具体选择固定化方法时,遵循的原则:
(1)必须维持酶的构象,特别是活性中心的构象。
(2)酶与载体必须有一定的的结合程度。
(3)固定化应有利于自动化、机械化操作。
(4)固定化酶应有最小的空间位阻。
(5)固定化酶应有最大的稳定性。
(6)固定化酶的成本较低。
吸附法分为物理吸附法和离子吸附法。
1.物理吸附法
物理吸附是通过氢键、疏水键和π-电子亲和力等物理作用力将酶固定在不溶性载体表面上的一种固定化方法。常用的载体可以分为有机载体和无机载体两种。
(1)有机载体 淀粉、谷蛋白、丁基或己基-葡聚糖凝胶、纤维素及其衍生物、甲壳素及其衍生物等。例如,用纤维素、膨润的玻璃纸或胶棉膜吸附固定化木瓜蛋白酶、碱性磷酸酶、6-磷酸葡萄糖脱氢酶,吸附容量可达每平方厘米膜70mg蛋白。
(2)无机载体 活性炭、多孔玻璃、多孔陶瓷、酸性白土、漂白土、高岭土、氧化铝、硅胶、膨润土、羟基磷灰石、磷酸钙、金属氧化物等。例如:用微孔玻璃为载体吸附固定化米曲霉和枯草芽孢杆菌的α-淀粉酶和黑曲霉的糖化酶。无机吸附的吸附容量较低,会使某些酶发生吸附变性,而且酶容易在使用中出现脱落,而有机吸附剂很少产生这种状况,吸附量较大。因此有机吸附剂更受人们的关注。
物理吸附法是最简单的固定化技术,只需将酶液与具有活泼表面的吸附剂接触,再经洗涤除去不吸附的酶便能制得固定化酶,此法具有酶活性部位及其空间构象不易被破坏、酶活力损失少的优点,但酶附着在载体上,结合力较弱,且受反应液的pH、温度、底物浓度的影响较大,存在易于脱落等缺点。
物理吸附法主要用于有机溶剂中催化反应的酶,关键是找到适当的载体,不同的载体影响固定化酶的对映体选择性、操作稳定性和酶活力。载体对酶的吸附量与给酶量、吸附时间、pH、表面积及酶的特性密切相关。
2.离子吸附法
离子吸附法是将酶与含有离子交换基团的水不溶性载体以静电作用力相结合的固定化方法。此法的载体有多糖类离子交换剂和各种离子交换树脂,包括阴离子交换树脂和阳离子交换树脂。
(1)阴离子交换剂 常见的有DEAE-纤维素、DEAE-葡聚糖凝胶、ECTEOLA-纤维素、TEAE-纤维素、Amberlite IRA-93等。
(2)阳离子交换剂 常见的有CM-纤维素、纤维素-柠檬酸盐、IRC-50、IR-45、IR-120、IR-200、XE-97、Dowex-50等。
离子交换吸附的优点是酶分子的高级结构破坏少,酶的活性中心不易破坏;制备条件温和,操作简便;经反复使用酶失活后,载体可用酸碱处理再生继续使用。但是,载体和酶的结合力比较弱,容易受缓冲液种类或pH的影响,在离子强度高的条件下进行反应时,酶往往会从载体上脱落。
离子交换吸附法固定酶的效率主要受pH的影响,不同载体在不同pH条件下的固定化效率也会有很大的差异,不同介质下结合效率也不同,因此在酶的固定化条件选择时应切实考虑固定化酶的操作条件,在固定化酶的使用过程中应特别注意pH及离子强度的控制。
包埋法可分为网格型和微囊型两种。前者是将酶包埋于高分子凝胶细微网格内;而后者将酶包埋在高分子半透膜中制备成微囊型。包埋法一般不需要与酶蛋白的氨基酸残基进行结合反应,很少改变酶的空间构象,酶活回收率较高。因此,可以应用于许多酶的固定化,但是,在发生化学反应时,酶容易失活,必须应该严格控制其反应条件。包埋法只适合作用于小分子底物和产物的酶,对于那些作用于大分子底物和产物的酶是不适合的。因为只有小分子可以通过凝胶的网格,并且这种扩散阻力还会导致固定化酶动力学行为的改变。
1.网格型
采用此法的固定化载体有聚丙烯酰胺、聚乙烯醇和光敏树脂等高分子化合物,以及淀粉、明胶、角叉菜胶(卡拉胶)、胶原蛋白、大豆蛋白、壳聚糖和海藻酸钠等天然高分子化合物。前一类常被采用合成高分子的单体或预聚物在酶的存在下聚合的方法,后一类则采用溶胶状天然高分子物质在酶存在下凝胶化的方法。
2.微囊型
用此法制得的微囊型固定化酶其直径通常为几微米到几百微米,颗粒比网格型要小得多,这样有利于底物和产物的扩散。但是,反应条件要求高,制备成本也高。制备方法有如下几种:
(1)界面沉淀法 该法是利用某些高聚物在水相和有机相的界面上形成皮膜将酶包埋的。一般是先将含高浓度血红蛋白的酶溶液在与水不互溶的有机相中乳化,在油溶性的表面活性剂存在下形成油包水的微滴,再将溶于有机溶剂的高聚物加入乳化液中,然后加入一种不溶解高聚物,使高聚物在油-水界面上沉淀析出,形成膜并将酶包埋,最后在乳化剂的帮助下由有机相转入水相。此法条件温和,酶不易失活,但要完全除去膜上残留的有机溶剂很困难。作为膜材料的高聚物有硝酸纤维素、聚苯乙烯和聚甲基丙烯酸甲酯等。此法曾用于固定化天门冬酰胺酶、脲酶等。
(2)界面聚合法 该法是利用界面聚合的原理将亲水性单体和疏水性单体使酶包埋于半渗透性聚合体中。具体方法是将酶的水溶液和亲水单体用一种与水不相溶的有机溶剂制成乳化液,再溶于同一有机溶剂的疏水单体溶液,在搅拌下乳化液中的水相和有机溶剂相之间发生聚合反应,水相中的酶即包埋于聚合体膜内。例如,将含10%血红蛋白的酶溶液与1,6-己二胺的水溶液混合,立即在含1%司盘-85的氯仿-环己烷中分散乳化,加入溶于有机相的癸二酰氯后,使在油-水界面上发生聚合反应,形成尼龙膜而将酶包埋。除尼龙膜外,还有聚酰胺、聚脲等形成的微囊。该法制备的微囊的大小能随乳化剂浓度和乳化时的搅拌速度而控制,制备过程所需时间非常短。但在包埋过程中由于发生化学反应而会引起某些酶失活。此法曾用聚脲制备天冬酰胺酶、脲酶等。
(3)二级乳化法 将一种聚合物溶于一种沸点低于水而且与之不混合的溶剂中,加入酶的水溶液,并用油溶性表面活性剂制成第一个乳化液。此乳化液属于“油包水”型,把它分散于含有保护性胶质如明胶、聚丙烯醇和表面活性剂的水溶液中,形成第二个乳化液。在不断搅拌下,低温出有机溶剂,便得到含酶的微囊。常用的高聚物有乙基纤维素、聚苯乙烯、氯橡皮等。常用的有机溶剂为苯、环己烷和氯仿。此法制备比较容易,酶几乎不失活,但残留的有机溶剂难以完全去除,而且膜也比较厚,会影响底物扩散。此法曾用乙基纤维素和聚苯乙烯制备成过氧化氢酶、脂肪酶等微囊。
(4)液膜法 它是近年来研制成功的一种新型微囊法,基本原理是利用表面活性剂和卵磷脂等形成液膜而将酶包埋。其显著特征是底物或产物的膜透过性不依赖于膜孔径的大小,而只依赖于对膜成分的溶解度,因此可以加快底物透过膜的速度。此法曾用于糖化酶的固定化。
共价结合法是将酶与水不溶性载体以共价键结合的方法。此法研究较为成熟。与载体共价结合的酶功能基团包括:①氨基:赖氨酸的ε-氨基和多肽键N末端的α-氨基;②羧基:天门冬氨酸的β-羧基、谷氨酸的α-羧基和末端 α-羧基;③酚基:酪氨酸的酚环;④巯基:半胱氨酸的巯基;⑤羟基:丝氨酸、苏氨酸和酪氨酸的羟基;⑥咪唑基:组氨酸的咪唑基;⑦吲哚基:色氨酸的吲哚基。最常见的共价键结合反应包括氨基、羧基或酪氨酸和组氨酸的芳环。此法的优点是酶与载体结合牢固,不易脱落;但因反应条件较为剧烈,会引起酶蛋白空间构象变化,破坏酶的活性部位。因此,往往不能得到比活高的固定化酶,酶活回收率一般为30%左右,甚至会影响底物的专一性,制备过程也比较繁杂。
共价键结合法可分为如下几种:
1.重氮化法
此法的原理为,具有芳香族氨基的水不溶性载体先在稀盐酸和亚硝酸钠中进行反应,成为重氮盐化合物。然后再与酶发生偶合反应,得到固定化酶(图8-2)。酶蛋白中的游离氨基、组氨酸的咪唑基、酪氨酸的酚基等参与此反应。特别是酪氨酸含量较高的木瓜蛋白酶、脲酶、葡萄糖氧化酶、碱性磷酸酯酶、β-葡萄糖苷酶等能与多种重氮化载体连接,获得活性较高的固定化酶。常用的载体有:多糖类的芳族氨基衍生物、氨基酸的共聚体、聚丙烯酰胺、聚苯乙烯、乙烯二马来酸共聚体,多孔玻璃、陶瓷等。
图8-2 重氮化芳香族氨基载体与酶的偶联反应
2.烷基化和芳基化法(www.chuimin.cn)
用溴乙酸溴活化的纤维素与酶的偶联反应如下:
该法原理是以卤素为功能基团的载体与酶蛋白的氨基或巯基发生烷基化或芳基化反应而形成固定化酶。常用的载体为卤乙酰、三嗪基或卤异丁烯基衍生物。将纤维素在二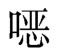 烷-溴醋酸中与溴乙酰相反应后,所形成的溴乙酰纤维素可供胰蛋白酶、糜蛋白酶和核糖核酸酶固定化之用。
烷-溴醋酸中与溴乙酰相反应后,所形成的溴乙酰纤维素可供胰蛋白酶、糜蛋白酶和核糖核酸酶固定化之用。
3.溴化氰法
该法原理是多糖类载体在碱性条件下用溴化氰活化时,产生少量不活泼的氨基甲酸衍生物和大量的亚氨基碳酸酯衍生物。后者再与酶共价结合为固定化酶,其中异脲型是主要生成物。它不局限于酶,可以广泛应用于机体成分的固定化。由于此法能在非常缓和的条件下与酶蛋白的氨基发生反应,它已成为近年来普遍使用的固定化方法。尤其是溴化氰活化的琼脂糖已在实验室广泛用于固定化酶以及亲和层析的固定化吸附剂。其反应式如图8-3所示。
图8-3 溴化氢活化琼脂糖与酶的偶联反应
4.载体交联法
该法原理为载体与酶蛋白发生共价结合或在双(多)功能试剂存在下载体与酶直接发生交联反应而形成固定化酶。常用的载体有氨基乙基纤维素、DEAE-纤维素、琼脂糖的氨基衍生物、壳聚糖、氨基乙基聚丙烯酰胺、多孔玻璃的氨基硅烷衍生物等。最常用的双功能试剂为戊二醛,此外还可使用甲苯-2,4-二异氰酸酯、Tri s等。
5.其他固定化方法
除上述固定化方法外,还可以采用肽键结合法、钛螫合法、硫醇-二硫化物的互换反应、四组分缩合反应等方法来进行酶的固定化。
交联法是使用双功能试剂或多功能试剂与酶分子间进行交联的固定化方法。作为交联剂的有形成希夫碱的戊二醛,形成肽键的异氰酸酯,发生重氮偶合反应的双重氮联苯胺或N,N′-乙烯双马来亚胺等,其中戊二醛最为常用。参与交联反应的酶蛋白的功能基团有氨基、酚基、巯基和咪唑基等。由于交联反应条件比较激烈,固定化酶活回收率一般比较低(30%左右)。但是尽可能降低交联剂浓度和缩短反应时间使之有利于固定化酶活的提高。
上述各种固定化方法都有其优点和缺点(表8-1)。实际应用时,常将两种或数种固定化方法并用。例如,吸附-交联法、包埋-交联法等。对一种酶而言,具体采用何种固定化方法,应作具体分析比较后才能作出选择。
表8-1 各种固定化方法的比较
1.单酶纳米颗粒
单酶纳米颗粒(single enzyme nanoparticles,SENs)是指每个酶分子均被一种纳米级的有机或无机多孔网状聚合物所包围而形成的纳米固定化酶颗粒。由于包埋层非常薄,具有多孔性结构,且有纳米级尺寸的特性,可以很好地分散在溶剂中,因而形成的单酶纳米颗粒与反应底物之间的传质阻力十分小,有效提升了固定化酶的催化活性。单酶纳米颗粒具有良好的催化稳定性和环境抗逆性,且有多种反应形式,可以单独或混合具有协同效应的多种酶进行催化反应。单酶纳米颗粒单体尺寸较小而不易进行回收分离,在应用中可以与其他多孔性材料联合使用,如用磁性颗粒吸附,使其带有磁性以简化其回收利用操作。
2.微波辐射辅助固定化技术
由于不同载体和酶自身的亲水性、溶解性等物化性质不同,固定化过程中存在一定的分散与接触性障碍,微波辐射辅助固定化技术指的是在固定化反应原液准备和固定化反应过程中,对溶液进行微波辐射处理以辅助固定化过程的发生。例如木瓜蛋白酶和青霉素酰基转移酶,两者的蛋白结构尺寸均较大而难以被固定化,通过微波辐射辅助,这两种大分子蛋白酶均能成功且迅速地固定于中细胞硅质泡沫上,并且其蛋白活性也得到了较好的保留。微波辐射在一定程度上会影响酶与载体的结合,导致某些吸附固定化酶发生蛋白脱落,因此在固定化酶的制备过程中应有选择性的应用此技术。
3.无载体固定化技术
无载体固定化是指在没有载体材料存在的情况下,酶分子通过交联或聚集而形成不溶于水的聚合物,使其能够从水溶液中分离实现固定化。即利用含有酶的水溶液与含有表面活性剂的非水相溶液混合,并加入双功能交联剂,通过超声或物理乳化的方法形成微乳化体系。在自固定化的过程中,酶倾向于分布在油水界面上,通过交联剂能使分布在微乳球表面的酶发生聚集而获得疏水性,后除去有机试剂即可获得自固定化的酶颗粒,且由于界面激活效应,得到的固定化酶通常处于激活态而拥有较高的催化活力。该方法在脂肪酶、漆酶以及多种复合酶蛋白等固定化应用中均取得了成功。对比于传统交联固定化技术,新型无载体固定化技术一定程度上克服了固定化酶活性低、易变性、稳定性差的缺点,但相比其他新型固定化酶技术,该方法的性价比无法满足实际工业应用的需求。
4.酶的定向固定化技术
在固定化技术中,研究者们提出一种新型的固体蛋白制剂,通过酶促反应使标记蛋白与目的蛋白结合,在不使用其他化学交联剂的情况下,实现酶的共价固定化,即生物酶介导的定向固定化技术。
增强的绿色荧光蛋白(EGFP)和谷胱甘肽转移酶(GST)是一类模型蛋白,在其C末端用中性谷氨酰胺(Gln)供体底物肽作为标签标记,可通过酶促反应固定在含有酪蛋白涂层的聚苯乙烯表面。另一类则是以自我标记标签蛋白(SNAP)自聚标签为代表的融合标签酶固定化策略,如图8-4所示,将目标酶与SNAP标签蛋白融合表达,可利用标签与载体表面的特定残基形成稳定的共价结合以实现固定化。
图8-4 SNAP自聚标签融合酶蛋白与O-6-苄基鸟嘌呤定向共价固定化策略
这一类新型固定化技术也被称为酶促固定化酶技术(enzymatic immobilization of enzyme),其本质是通过蛋白融合而实现酶蛋白的定向共价固定化,具有设计性强、选择性高等特点,但技术操作相对复杂,目前主要被应用于生物传感器、生物电极的制备领域,该方法在各类生物酶中的普适性和催化应用性还有待进一步研究。
5.化学修饰介导的定向固定化技术
化学修饰介导的固定化是指在酶分子表面氨基酸残基上引入特定基团,使修饰后的酶能与载体表面的功能团发生特定的化学结合,实现酶的定向固定化。目前比较常用的修饰功能团有醛基、叠氮、炔烃等,图8-5所示为一种常见的点击反应,经炔烃修饰的酶分子能与含有叠氮化物功能团的载体发生1,3-偶极环加成反应,形成稳定的化学共价键,Cu(I)是这类化学修饰介导的固定化酶反应中常用的催化剂。化学修饰策略的优势在于可应用于固定化表面缺乏相应共价结合功能团的酶,但这一方法易造成酶蛋白结构改变而影响其催化活性,通过预测修饰位点以及选取条件较温和的反应方式能有效减少固定化酶催化活性的损失。
图8-5 Cu(I)催化叠氮炔环加成反应
6.界面聚合微囊固定化技术
界面聚合指的是一种反应发生在两种互不相容的界面之间的缩聚反应,该反应具有不可逆性;将目的酶溶解在相应的体系中,通过缩聚能形成微囊或微球颗粒将酶蛋白包裹而实现固定化。界面聚合微囊固定化技术最大的优势在于对固定化酶的激活,但微囊的储存和重复利用稳定性仍需进一步增强。
7.其他新型固定化技术
随着固定化技术研究的发展创新,除了以上几种公认分类之外,还有一些新提出的固定化技术,策略独特且具有极大的发展应用潜力。以“智能固定化”技术为例,这种固定化技术利用智能高聚物材料为固定化载体,所制备得到的固定化酶继承了载体所拥有的特性。智能高聚物材料也称为高分子智能材料,在其所处环境条件(温度、pH、压力、磁场等)发生变化而产生刺激时,其物理性质和/或化学性质会发生一定的变化,例如,一些聚合物在温度较低是呈液态,而当温度升高则逐渐固化且具有极强的物理抗性。新型固定化技术的研究种类繁多,很难将其进行精准的分类,通常以固定化酶主要展现出的性质或制备过程中的典型工艺为分类依据。目前新型固定化技术的研究目标主要集中进一步提高酶活力,增强固定化酶环境耐受性、操作稳定性,以及实现酶的精准定向固定化。但新型固定化技术的研究容易陷入制备过程烦琐、生产投入较高的缺陷之中,需要大量基础研究和优化手段来完善,应当适当选择一些工业应用潜力较大的固定化技术进行小规模或中等规模的制备与应用测试,逐步实现固定化酶的实际生产应用。
随着生物技术与材料、化学等学科的不断交叉发展,新的载体修饰方法和新型材料不断涌现,丰富了固定化技术研究的载体来源,涌现一批围绕新型载体展开的固定化策略研究。这一类载体通常具有表面积大、多孔性空间结构、底物/产物亲和性等特征,主要分为新型纳米材料载体、磁性材料载体、传统材料经改造修饰而成的复合新型载体3大类。这3类基于材料创新组成的固定化酶技术具有催化效果好、固定化率高等特点,其主要优势在于对新兴载体的应用,使该技术具有极大的发展潜力与可塑性。另一方面,由于载体的选择和预处理等过程是必要的,该技术的操作过程一般比较复杂,固定化酶的物理形态和适用环境受载体材料的影响极大。
1.新型纳米载体
新型纳米载体是指具有纳米级结构的材料,这类材料具有极大的表面积和良好的分散性,能极大地提高固定化率和反应催化效率,主要包含有多孔纳米金颗粒、纳米管、石墨烯等。使用纳米材料载体制备的固定化酶多应用于电极和生物传感器领域,研究结果显示这类生物传感器能产生更强的信号,拥有更大的检测范围和更高的敏感度。其中,碳纳米管是最具代表性的新型纳米材料之一,1991年被日本学者发现以来,极大地推动了材料制备领域的发展,2010年以来碳纳米管在固定化酶技术中的应用不断涌现,目前在脂肪酶、水解酶、漆酶和多种氧化还原酶的固定化研究中均有大量的应用。
2.磁性材料
磁性材料利用铁、锰、钴及其氧化物等化合物制备的一类具有磁性的材料,其最大优点在于可通过磁力吸引而迅速分离固定化酶,且固定化方法简单,能有效减少资本和工程投入。单一的磁性颗粒一般不直接用于酶的固定化,通常与其他有机高分子聚合物或多孔性无机材料联合使用,以获得较高的固定化率,同时使固定化酶具有磁性,便于分离回收。在我国固定化酶研究领域内,磁性颗粒早在20世纪80年代就被应用于固定化酶的研究工作中,本世纪以来得到了大量应用,至今仍是固定化酶制备的常用材料之一。
3.传统材料经改造修饰而成的复合新型载体
基于传统材料进一步改造修饰的固定化载体通常有较为繁杂的化学修饰,但这种方法具有较强的目的性和方向性,常应用于定向固定化和共固定复合酶的研究中。一些性能优良的传统载体,如多孔硅材料、大孔树脂、分子筛、天然多糖等,经过长期的实验研究已被证明具有较大的固定化潜力,但仍有部分缺陷,如稳定性差、不易回收利用等,通过针对性的改造与修饰克服其应用阻碍,制备出新型的二代载体以促进固定化酶走向工业化应用,是当前固定化领域内的研究热点之一。
有关食品酶学导论的文章

酶是在活细胞中合成并在胞内或胞外介质中存在的。胞内酶在细胞内存在部位和结合状态比较复杂,因而抽提难度较大。酶的抽提目的是将尽可能多的酶或尽可能少的杂质从原料组织和细胞中引入溶液,以利于酶的纯化。但此法用于酶的大量提取有一定局限性。经丙酮处理的细胞干粉称为丙酮粉。丙酮还能除去细胞膜部分脂肪,更有利于酶的提取。根据酶在细胞内结合状态以及其溶解程度,酶的抽提可分为水溶法和有机溶剂法两种。......
2023-11-22

固定化对酶活性的影响:酶活性下降,反应速度下降。固定化酶在一定空间内呈闭锁状态存在的酶,能连续的进行反应,反应后的酶可以回收反复利用。使用载体结合法制成的固定化酶的Km有时发生变化,主要是由于载体与底物间的静电相互作用。从两者比较还可以看出,固定化酶pH曲线比较平缓,也就是固定化酶受缓冲液的影响较小,载体对酶起保护作用。......
2023-11-22

1971年,第一届酶工程会议正式建议采用固定化酶的名称。随着现代生物技术和材料、化工等相关学科的不断发展,酶的固定化技术的发展正逐步由粗放转向精细、由定性转向定量、由无序转向定向,在工业、医学、化学分析、亲和层析、环境保护、能源开发等方面的应用研究,已取得许多重要成果,但高品质固定化酶的获取与有效应用仍是该领域内研究人员追求的最终目标。......
2023-11-22

因而,各种各样的发酵酿造食品均与酶的应用紧密相关。在生产中采用黑曲糖化酶、真菌β-淀粉酶和脱支酶等。目前此法仍在试验阶段,采用的设备为固定床和流化床生物反应器。在酒精生产中,淀粉质原料的蒸煮是一个关键工序。在酿造生产中此酶适用于蒸煮前的调浆工序,其最适温度为90~105℃,pH为5.5~7.0。酶法应用于白酒、黄酒、食醋和酱油的生产中,主要在加曲糖化过程中采用外加糖化酶,可加速糖化工序,便于缩短生产周期。......
2023-11-22

抽提的酶液是否需要进一步经过纯化,要视其应用的要求。食品工业应用的酶如果粗酶液已达到食品级标准要求,特别是卫生指标,也无需进一步纯化。然而,应用于医药、化学试剂级的酶液必须进一步纯化。因此,酶的纯化目的是把粗抽提酶液采用科学纯化方法制备成纯度高的酶制品。酶的纯化方法很多,现根据酶的溶解度、分子大小、电离性质、稳定性和亲和力等方面性质,其方法分述如下。......
2023-11-22

酶促反应速度和普通化学反应一样,可用单位时间内底物减少量或产物增加量来表示。反应速度即图中曲线的斜率。酶反应速度,是对初速度而言。在一定条件下,酶所催化的反应速度称为酶活力。由于反应底物或产物可显示不同吸收光谱,光吸收与浓度成正比,光吸收改变的速率与酶活力也成正比,因而可用分光光度计来进行测定酶反应的情况。......
2023-11-22

从反应工程方面分析,固定化酶反应系统属非均一催化反应。反应产物又从固定化酶活性部位扩散到主体溶液。因此,存在扩散限制,固定化酶不可能得到大环境相同水平的产物。酶固定化后,因载体电荷性质的影响造成酶催化的微环境的变化。一般来说,当反应产物为酸性时由于扩散受到限制而积累在固定化酶所处的催化区域内,使得区域pH降低,必须提高周围反应液的pH,才能达到酶所要求的最适pH。......
2023-11-22

对酶促作用的影响同抑制作用相反,许多酶促反应必须有其他适当物质存在时才能表现酶的催化活性或加强其催化效力,这种作用称为酶的激活作用,引起激活作用的物质称为激活剂。至于无机阴离子对酶的激活作用,在实践中也是常见的现象。若酶原被具有活力的同种酶所激活,则称为酶的自身激活作用。而酶的活性部位往往只能作用于底物的一种解离状态。当温度超过酶的最适温度时,酶蛋白就会逐渐产生变性作用而减弱甚至丧失其催化活性。......
2023-11-22
相关推荐