酶的催化效率高,而且在温和条件下,具有高度专一性和可调节性。例如,人的消化道中如果没有淀粉酶、蛋白酶等起作用,在体温37℃条件下,要消化一日三餐的食物是不可想象的。为了阐明这些特征,必须从酶催化作用本质加以解释。具有足够能量,能发生有效碰撞的分子称为活化分子。活化分子所具有的能量超过反应特有的能阈。为了使反应物分子超越反应的能阈变为活化分子,必需从外部供给额外能量,这种能量称为活化能。......
2023-11-22
对酶促作用的影响同抑制作用相反,许多酶促反应必须有其他适当物质存在时才能表现酶的催化活性或加强其催化效力,这种作用称为酶的激活作用,引起激活作用的物质称为激活剂。激活剂和辅酶或辅基(或某些金属作为辅基)不同,无激活剂存在时,酶仍能表现一定的活力,而辅酶或辅基则为酶的分子组成部分,如果它们不存在时,酶则完全不呈活力。
激活剂种类很多,其中有无机阳离子,如Na+、K+、Rb+、Cs+、NH4+、Mg2 +、Ca2 +、Zn2 +、Cd2 +、Cr3 +、Mn2 +、Fe2 +、Co2 +、Ni2 +、Al3 +等;无机阴离子,如Cl-、Br-、I-、CN-、NO3-、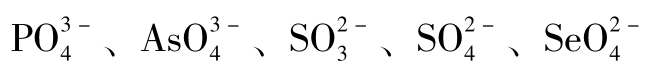 等;有机物分子如维生素C、半胱氨酸、巯乙酸、还原型谷胱甘肽以及维生素B1、维生素B2和维生素B6的磷酸酯等化合物和一些酶。
等;有机物分子如维生素C、半胱氨酸、巯乙酸、还原型谷胱甘肽以及维生素B1、维生素B2和维生素B6的磷酸酯等化合物和一些酶。
(一)无机离子的激活作用
金属离子的激活作用在微生物发酵过程中是一个比较常见的例子,如Mg2 +对酵母葡萄糖磷酸激酶的激活作用如图5-16所示;Mg2 +及Zn2 +对酵母磷酸葡萄糖变位酶的激活作用如图5-17所示。
图5-16 Mg2+对葡萄糖磷酸激酶的激活作用
图5-17 Mg2+及Zn2+对磷酸葡萄糖变位酶的激活作用
从曲线可知,如果缺Mg2 +及Zn2 +时,其反应速度缓慢。增加其金属离子浓度,则反应速度加快。但当这些离子超过一定限度时则反应速度反而减弱。对于酵母磷酸葡萄糖变位酶,当无Mg2 +存在时,其活性仅为15%。Mg2 +浓度在1×10-3~3×10-3mol/L时,其活力达到最大。
一般认为,金属离子的激活作用是由于金属离子与酶结合,此结合物又与底物结合形成三位一体的“酶-金属-底物”的复合物。这里金属离子使底物更有利于同酶的催化部位和结合部位相结合使反应加速进行,金属离子在其中起了某种搭桥的作用。
至于无机阴离子对酶的激活作用,在实践中也是常见的现象。例如,Cl-是淀粉酶活力所必需的因子,当用透析法去掉Cl-时,淀粉酶即丧失其活性;又如Cl-、NO3-、SO42-为枯草杆菌(BE-7658)淀粉酶的激活剂。这些阴离子为酶活力所必需的因子,而且对酶的热稳定性又起保护作用。
(二)酶原的活化
有些酶在细胞内分泌出来时处于无活性状态(称为酶原),它必须经过适当物质的作用后才能变为有活力的酶。若酶原被具有活力的同种酶所激活,则称为酶的自身激活作用。
例如,胰蛋白酶原在胰蛋白酶或肠激酶的作用下,使酶原变为具有活性的酶。这种转变的实质是在酶原肽链的某些地方断裂而失去一个六肽的结果,使得酶原被隐蔽的活性部位显露出来。其作用机制如图5-18所示。
图5-18 胰蛋白酶原的活化(X为特异性部位)
试验测定表明,胰蛋白酶原和胰蛋白酶,都只有一个肽链。就氨基酸组成来说,两者仅有微小的差别。这些都说明酶原变成酶时并不发生重大的改变,活化时只有一个肽键被打开,即在赖氨酸与异亮氨酸之间,在肽链的N-末端部分失去了一个六肽,同时隐蔽的活性基被释放出来或形成新的活性部位。
氢离子浓度对酶反应速度的影响很大。每种酶都有特定的最适pH,大于或小于这个数值,酶活力就要降低,甚至引起酶蛋白变性而丧失活力。若以酶活力或反应速度对pH作图,可得到一个pH-活力曲线(图5-19)。处于曲线最高点处的pH称为最适pH,在最适pH处酶活力最大。每种酶都有其最适pH,这是酶作用的一个重要特征。但是,最适pH并不是一个酶的特定常数,因为它受其他因素的影响,如酶的纯度、底物种类和浓度、缓冲剂的种类和浓度以及抑制剂等的影响。因此,它只有在一定条件下才是有意义的。脲酶对尿素的催化反应,由于缓冲剂的不同,脲酶就显示出不同的最适pH。
pH对酶活力的影响,主要表现为pH改变底物和酶分子的带电状态。(www.chuimin.cn)
1.pH改变底物的带电状态
当底物为蛋白质、肽或氨基酸等两性电解质时,它们随着pH的变化表现出不同的解离状态:带正电荷、带负电荷或不带电荷(兼性离子)。而酶的活性部位往往只能作用于底物的一种解离状态。
图5-19 缓冲剂种类及pH对脲酶的影响
2.pH改变酶分子的带电状态
酶具有两性解离特性。pH的改变会改变酶的活性部位上有关基团的解离状态,从而影响酶与底物的结合。假定酶在某一pH时,酶分子的活性部位上存在一个带正电荷的基团和带负电荷的基团时,此时酶最易与底物相结合。当pH偏高或偏低时,活性部位带电情况改变,酶与底物的结合能力便降低,从而使酶活力降低。例如,蔗糖酶只有当它处于等电点状态时(兼性离子时),才具有最大的酶活力,而在偏酸或偏碱的溶液中酶活力都要降低或丧失。每种酶都有其最适pH,如表5-3所示。
表5-3 几种酶的最适pH
各种酶的反应均有其最适的温度,此时,酶的反应速度最快。与普通化学反应一样,在酶的最适温度以下,温度每升高10℃,其反应速度相应地增加1~2倍。温度对酶反应速度的影响通常用温度系数Q10来表示:
在生理温度下,酶反应的温度系数通常在1.4~2.0。此温度系数一般较无机催化反应和非催化的同样反应小。
当温度超过酶的最适温度时,酶蛋白就会逐渐产生变性作用而减弱甚至丧失其催化活性。一般的酶耐温程度不会超过60℃,但有的酶(来自芽孢菌)的热稳定性比较高。另外,在有的酶中加一些无机离子,可增加其热稳定性。因此,在应用酶制剂前必须做酶的温度试验,找出适合生产工艺要求的最适温度。例如,栖土曲霉(As.3942)蛋白酶的最适温度的选择试验,可采用如下的方法:
将蛋白酶与酪蛋白混合,在不同的温度下保温,测得酶活力的数据,绘成温度对酶活力的曲线,如图5-20所示。
图5-20表明,保温时间在30min以内,45~50℃酶活力最高。随着保温时间延长,最适温度降低。保温120min,在40~45℃酶活力最高。如保温时间为10min,该酶在30~40℃时较为稳定。超过50℃酶活力迅速下降,直至60℃时,酶几乎全部变性失活。
图5-20 温度对As.3942蛋白酶反应速度的影响
试验结果表明,选择酶的最适温度和酶反应的时间有关,反应时间长,则最适温度要低一些。若只是温度选择得高,则酶容易变性失活。在制革厂采用蛋白酶脱毛时,一般选用最适温度40℃为宜。温度过高酶容易失活而达不到脱毛的目的,同时也会产生烂皮的现象;温度过低则酶脱毛时间延长,影响生产效率。由此可知,酶的最适温度不像Km那样为酶的特征常数,它是随酶反应时间变化而改变的。
至于低温对酶促反应的影响,一般地说,在低温下(如0℃左右或更低)酶活力降低,但酶活力不受破坏,一旦升高温度也就能恢复其原有的催化活性。
有关食品酶学导论的文章

酶的催化效率高,而且在温和条件下,具有高度专一性和可调节性。例如,人的消化道中如果没有淀粉酶、蛋白酶等起作用,在体温37℃条件下,要消化一日三餐的食物是不可想象的。为了阐明这些特征,必须从酶催化作用本质加以解释。具有足够能量,能发生有效碰撞的分子称为活化分子。活化分子所具有的能量超过反应特有的能阈。为了使反应物分子超越反应的能阈变为活化分子,必需从外部供给额外能量,这种能量称为活化能。......
2023-11-22

到目前为止,许多酶的一级结构已经研究清楚,有的二级、三级和四级结构也已阐明。其第4个二硫键所连结的第65号和第72号半胱氨酸以及其间的六个氨基酸则位于螺旋环圈的内侧。大多数酶只由一条肽链组成,有的酶有两条、三条或多条肽链组成,这种由数条相同或相似的肽链组成的酶呈四级结构,其中每一条肽链称为一个亚基。一般而言,绝大多数酶是具有催化功能的一类蛋白质。此问题涉及酶的分子结构与催化功能关系问题。......
2023-11-22

酶是在活细胞中合成并在胞内或胞外介质中存在的。胞内酶在细胞内存在部位和结合状态比较复杂,因而抽提难度较大。酶的抽提目的是将尽可能多的酶或尽可能少的杂质从原料组织和细胞中引入溶液,以利于酶的纯化。但此法用于酶的大量提取有一定局限性。经丙酮处理的细胞干粉称为丙酮粉。丙酮还能除去细胞膜部分脂肪,更有利于酶的提取。根据酶在细胞内结合状态以及其溶解程度,酶的抽提可分为水溶法和有机溶剂法两种。......
2023-11-22

根据非水介质酶学研究进展,其主要研究有机溶剂为主的微水有机溶剂中和反相胶束中酶结构与性质,催化动力学、催化条件、反应机制及其应用等内容。有大量实验表明,酶悬浮于苯、环己烷等有机溶剂中并不变性,而且还能表现出催化活性,并认为酶的活性部位结构在水中与在有机溶剂中是相同的。......
2023-11-22

因而,各种各样的发酵酿造食品均与酶的应用紧密相关。在生产中采用黑曲糖化酶、真菌β-淀粉酶和脱支酶等。目前此法仍在试验阶段,采用的设备为固定床和流化床生物反应器。在酒精生产中,淀粉质原料的蒸煮是一个关键工序。在酿造生产中此酶适用于蒸煮前的调浆工序,其最适温度为90~105℃,pH为5.5~7.0。酶法应用于白酒、黄酒、食醋和酱油的生产中,主要在加曲糖化过程中采用外加糖化酶,可加速糖化工序,便于缩短生产周期。......
2023-11-22

酶促反应是一个复杂的化学反应,有的化学物质能对它起促进作用,但也有许多物质可以减弱、抑制甚至破坏酶的作用,后者称为酶的抑制剂,由于抑制而引起的作用称为抑制作用。例如,某些磷化合物对胆碱酯酶的作用和氰化物对黄素酶的作用等。例如,杀虫剂和消毒防腐剂的应用就是由于它们对昆虫和微生物酶的抑制作用。这种抑制作用有特异性,但因变性作用而引起的抑制作用无特异性。......
2023-11-22

20世纪70年代初实现了DNA重组技术,极大地推动着食品科学与工程的发展,也促使酶学研究进入新的发展阶段。现代食品酶学发展有如下几个新的突破:1.酶及细胞固定化技术的开发应用作为一种催化剂,在催化过程中自身不发生变化,可以反复使用。酶及产酶细胞的固定化技术从酶学理论到生产实践得到迅速的发展,引起食品、发酵工业一场大变革。......
2023-11-22

如上所述,酶的催化本质是降低反应所需的活化能,加快反应进行。为了达到减少活化能的目的,酶与底物之间必然需要通过某种方式而互相作用,并经过一系列的变化过程。酶和底物的相互作用和变化过程,称为酶的催化机制。一个良好的电子供体必然是一个良好的亲核催化剂。由于酶分子中可提供一对电子对的基团有His-咪唑基、Ser-OH、Cys-SH等,因此,亲核催化对阐明酶的催化机制具有重要作用。......
2023-11-22
相关推荐