到目前为止,许多酶的一级结构已经研究清楚,有的二级、三级和四级结构也已阐明。其第4个二硫键所连结的第65号和第72号半胱氨酸以及其间的六个氨基酸则位于螺旋环圈的内侧。大多数酶只由一条肽链组成,有的酶有两条、三条或多条肽链组成,这种由数条相同或相似的肽链组成的酶呈四级结构,其中每一条肽链称为一个亚基。一般而言,绝大多数酶是具有催化功能的一类蛋白质。此问题涉及酶的分子结构与催化功能关系问题。......
2025-09-30
按照米氏理论,酶促反应底物浓度的增加是有一个极限的。当底物浓度过高时反应速度又重新下降,这是高浓度底物对反应起了抑制作用。其原因有如下几点:
(1)酶促反应是在水溶液中进行的,水在反应中有利于分子的扩散和运动。当底物浓度过高时就使水的有效浓度降低,使反应速度下降;
(2)过量的底物与酶的激活剂(如某些金属离子)结合,降低了激活剂的有效浓度而使反应速度下降;
(3)一定的底物与酶分子中一定的活性部位结合,并形成不稳定的中间产物。过量的底物分子聚集在酶分子上就可能生成无活性的中间产物,因此,这个中间产物不能再分解为反应产物。其反应式如下:
式中 nS——过量的底物分子;
ES1 +n——无活性的中间产物。
酶促反应是一个复杂的化学反应,有的化学物质能对它起促进作用,但也有许多物质可以减弱、抑制甚至破坏酶的作用,后者称为酶的抑制剂,由于抑制而引起的作用称为抑制作用。
酶的抑制剂有多种:重金属离子(如Ag+、Hg2 +、Cu2 +等)、一氧化碳、硫化氢、氰氢酸、氟化物、有机阳离子(如生物碱、染料等)、碘代乙酸、对氯汞苯甲酸、二异丙基氟磷酸、乙二胺四乙酸以及表面活性剂等。
有的抑制作用可通过加入其他物质或用其他方法解除,使酶活力恢复,这种抑制称为可逆性抑制。例如,抗坏血酸(维生素C)对于酵母蔗糖酶有较强的抑制作用,但加入半胱氨酸后这种抑制即解除。相反,有的抑制作用不能因加入某种物质或其他方法而解除,这种抑制称为不可逆抑制。例如,某些磷化合物对胆碱酯酶的作用和氰化物对黄素酶的作用等。
研究抑制作用的机制无论在理论上还是在实践上都有重要意义。某些物质使生物体引起中毒现象,往往是由于酶或酶系被损害。例如,杀虫剂和消毒防腐剂的应用就是由于它们对昆虫和微生物酶的抑制作用。同时,这个研究还有助于阐明酶的催化本质和机制。因为,抑制作用可以是由于某种抑制剂与酶的活性部位结合,阻碍了中间产物的形成或分解,或由于酶的变性作用等所造成。这种抑制作用有特异性,但因变性作用而引起的抑制作用无特异性。现就对酶的活性有特异性抑制的抑制剂讨论如下。
根据抑制剂与酶结合的情况,又可以分为竞争性抑制、非竞争性抑制、反竞争性抑制和混合抑制等。
(一)酶的竞争性抑制(competitive inhibition)
抑制剂同底物对酶分子的竞相结合而引起的抑制作用称为竞争性抑制。其抑制强度取决于抑制剂和底物对酶分子的亲和力,如图5-11所示。
这种抑制作用,有两个生化反应竞相进行:
其中:I为抑制剂,[EI]为抑制剂与酶结合的无活性中间产物,Ki为E I的解离常数,[E0]为酶的总浓度。根据质量作用定律:
图5-11 竞争性抑制
解出[ES]并消去[EI]
由于vi=K[ES](实际反应速度),而无抑制时的最大速度Vm与[E0]成比例。
因此:
或
由式(5-37)与米氏方程式比较,式(5-37)仅多出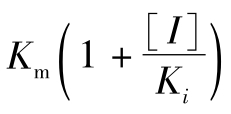 。因此,在竞争性抑制中Km值增加了。
。因此,在竞争性抑制中Km值增加了。
从式(5-37)可知,如果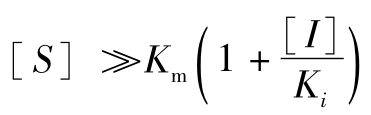 ,则vi便接近于或等于Vm;若Ki值小而[I]值大,则有抑制作用,其抑制程度决定于[S]。正如米氏方程一样,式(5-37)也可用直线来表示。
,则vi便接近于或等于Vm;若Ki值小而[I]值大,则有抑制作用,其抑制程度决定于[S]。正如米氏方程一样,式(5-37)也可用直线来表示。
这里,斜率不是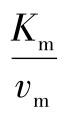 ,而是
,而是 ,即斜率增大了。但截距并未增加(图5-12)。
,即斜率增大了。但截距并未增加(图5-12)。 称为抑制因子。
称为抑制因子。
图5-12 竞争性抑制(https://www.chuimin.cn)
A-无抑制剂 B-有抑制剂
这种抑制的特点是底物浓度增加时,则抑制作用减小,即抑制作用的大小取决于抑制剂的浓度与底物浓度之比。例如,一些金属离子所引起的抑制及丙二酸对琥珀酸脱氢酶的抑制作用即是如此,此类抑制剂往往具有与底物分子相似的化学结构。
(二)非竞争性抑制(non-competitive inhibition)
非竞争性抑制与竞争性抑制有区别,它不受底物浓度[S]的影响,而取决于酶浓度、抑制剂浓度和Ki的大小。抑制剂也不必具有与底物相似的化学结构,因为酶分子的结合基团或部位不是原来与底物结合基团(图5-13)。
图5-13 非竞争性抑制
在非竞争性抑制中,根据质量作用定律,从式(5-34)可得:
或
设:vm为无抑制剂时最大反应速度
vi为有抑制剂时的反应速度
因vm与[E0]成正比,vi与([E0]-[I])成正比,
即:
故
由式(5-39)可知,有抑制剂时,反应速度受Ki和[I]的影响,而与[S]无关。当[I]很小时,则 接近1,即vi≈vm。
接近1,即vi≈vm。
将式(5-39)写成:
代入米氏方程式的倒数式则得:
以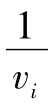 对
对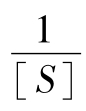 作图得图5-14。由图5-14可知,其斜率和截距都增大了,即各乘以一个抑制因子。
作图得图5-14。由图5-14可知,其斜率和截距都增大了,即各乘以一个抑制因子。
(三)反竞争性抑制(uncompetitive inhibition)
反竞争性的抑制剂I能与酶-底物复合物ES结合,而不与游离酶E结合,其特征是反应的最大速度比未加抑制剂时反应的最大速度低,当以速度的倒数相对底物浓度的倒数作图,所得图线与未被抑制反应的图线平行,如图5-15所示。
图5-14 非竞争性抑制
A-无抑制剂 B-有抑制剂
图5-15 反竞争性抑制
(四)混合抑制
如果抑制剂与酶的结合具有上述抑制作用中的两种以上的抑制,即为混合抑制。
相关文章

到目前为止,许多酶的一级结构已经研究清楚,有的二级、三级和四级结构也已阐明。其第4个二硫键所连结的第65号和第72号半胱氨酸以及其间的六个氨基酸则位于螺旋环圈的内侧。大多数酶只由一条肽链组成,有的酶有两条、三条或多条肽链组成,这种由数条相同或相似的肽链组成的酶呈四级结构,其中每一条肽链称为一个亚基。一般而言,绝大多数酶是具有催化功能的一类蛋白质。此问题涉及酶的分子结构与催化功能关系问题。......
2025-09-30

如上所述,酶的催化本质是降低反应所需的活化能,加快反应进行。为了达到减少活化能的目的,酶与底物之间必然需要通过某种方式而互相作用,并经过一系列的变化过程。酶和底物的相互作用和变化过程,称为酶的催化机制。一个良好的电子供体必然是一个良好的亲核催化剂。由于酶分子中可提供一对电子对的基团有His-咪唑基、Ser-OH、Cys-SH等,因此,亲核催化对阐明酶的催化机制具有重要作用。......
2025-09-30

酶促反应速度和普通化学反应一样,可用单位时间内底物减少量或产物增加量来表示。反应速度即图中曲线的斜率。酶反应速度,是对初速度而言。在一定条件下,酶所催化的反应速度称为酶活力。由于反应底物或产物可显示不同吸收光谱,光吸收与浓度成正比,光吸收改变的速率与酶活力也成正比,因而可用分光光度计来进行测定酶反应的情况。......
2025-09-30

淀粉合成酶是以腺苷二磷酸葡萄糖作为供体,是葡萄糖聚合体通过糖基转移而催化α-1,4糖苷键,起到延长作用。这说明SSSI主要负责支链淀粉B1和A链的合成,且SSSI是B1链的延伸酶。因此,单一SSS同工酶的缺失不会使淀粉合成终止,但能改变支链淀粉的分子结构和淀粉粒形态。淀粉合成酶的活性受温度影响,直链淀粉和支链淀粉在水稻灌浆过程中几乎是同步积累的。......
2025-09-29

酶的专一性主要取决于酶的活性中心的构象和性质,其专一性可分为结构专一性和立体异构专一性。这也是酶区别于一般催化剂的一个重要特征。同时酶也常因温度、pH的轻微改变或抑制剂的存在而使其活性发生改变。(二)酶催化反应动力学1.单底物酶反应动力学底物浓度的改变对酶促反应速率影响比较复杂。当cI增加,或KI减小,都将使KmI值增大,使酶与底物的结合能力下降,活性复合物减少,因而使底物反应速率下降。......
2025-09-30

20世纪70年代初实现了DNA重组技术,极大地推动着食品科学与工程的发展,也促使酶学研究进入新的发展阶段。现代食品酶学发展有如下几个新的突破:1.酶及细胞固定化技术的开发应用作为一种催化剂,在催化过程中自身不发生变化,可以反复使用。酶及产酶细胞的固定化技术从酶学理论到生产实践得到迅速的发展,引起食品、发酵工业一场大变革。......
2025-09-30

酶的催化反应按其底物数可分为单底物和多底物的催化作用,两者反应系统的动力学规律不完全相同。所谓多底物催化是指两个或两个以上的底物参与反应,其动力学方程相当复杂,数学推导也十分烦琐。多底物酶促反应历程复杂,包括连续性机制和非连续性机制。......
2025-09-30

酶学是生物科学和食品科学的基础,懂得酶学才能理解酶在动植物原料及其加工过程中的变化和作用,才能理解食物在体内的生理作用和营养功能。食品酶学的重要特点是基础酶学和食品工程学相互渗透,它是将酶学、食品微生物学的基本原理应用于食品工程并与酶工程有机结合而产生的交叉科学技术。酶学、食品酶学与酶工程三者含义有所不同,但它们之间又能有机联系、互相渗透。......
2025-09-30
相关推荐