突变的lfy基因引起AP3基因表达的下调。一个弱的ufo突变体ufo-11可以造成轮2花瓣不能形成,但是轮3雄蕊正常,说明UFO在轮2花瓣形成中的作用。一个弱的ag突变体ag-4是无限花,具有花萼-花瓣-雄蕊重复分布类型。......
2023-11-20
植物种类中,有的植物是单叶,而有的产生复叶。复叶的类型又有不同的区别,大致可以分为羽状复叶、掌状复叶、三出叶和单身复叶。各种各样的不同大小、不同形状的叶片首先取决于叶片的长与宽,叶片的大小是由表层细胞分裂导致的,追根究底还是由细胞发育过程中起作用的基因控制的。在双子叶植物中,叶的发育沿着基部-茎尖的轴分化,分化顺序遵循以下原则:先分化中脉,然后分化叶片;从中脉向边缘。叶型首先决定于叶面细胞的长与宽;还决定于叶面细胞停止分裂的早晚。
叶型的内容包括单叶、复叶,叶边缘圆滑或锯齿、深裂或浅裂、叶柄有或无,叶柄或长或短,叶宽或窄,大或小。尽管各个物种成熟的叶各种各样,但是叶原基和薄层组织没有延伸的幼小叶形态上在各个物种之间却没有多大的区别,叶的形态发生是在叶原基形成,薄层组织延伸之后的发育阶段。叶结构是由细胞分布决定的,锯齿和裂槽的凹陷是由于细胞分裂的缺乏造成的。各种与细胞分裂与分化有关的基因表达强度和分布以及与极性决定相关基因之间的作用可以对叶形造成的千变万化的影响。
KNAT1和AS1、AS2及SE基因直接的互作影响叶型的形成。图9.30、图9.31显示了拟南芥叶片发育中KNAT1基因的过量表达造成叶片形状的改变,叶边缘形成突起和裂片。分生组织活动异常,叶柄缩短或消失(Lincoln et al.,1994;Chuck et al.,1996)。侧生器官决定基因AS1/2、SE的突变同样造成叶片形状的改变(图9.32)。AS1和AS2抑制KNAT1在叶脉的表达。se和as1或as2的双突变在叶子大部分区域失去对KNAT1的抑制作用,在叶子凹槽处对KNAT1的表达抑制消失。说明SE也影响KNAT1的表达(图9.33)(Ori et al.,2000)。AS2具有近轴表达特性,在叶中抑制KNAT1、KNAT2、KNAT6的表达,但对STM的表达没有影响。过量表达AS2使远轴特性转变成近轴特性(图9.34,Lin et al.,2003)。

图9.30 KNOXⅠ类基因对叶型的影响(Lincoln et al.,1994,ⓒASPB)(严海燕修饰)
BLH(BEL1-LIKE HOMEODOMAIN)成员有13个,都可以与KNOX1类蛋白形成复合物,包括KNAT1和STM,SAWTOOTH1(BLH2/SAW1)和SAWTOOTH2(BLH4/SAW2)在侧生器官表达,负调控KNAT1表达。单突变表型不明显,双突变叶锯齿和卷边在较晚期(第八片叶以上)增多,KNAT1表达异常(图9.35,from Kumar et al.,2007)。
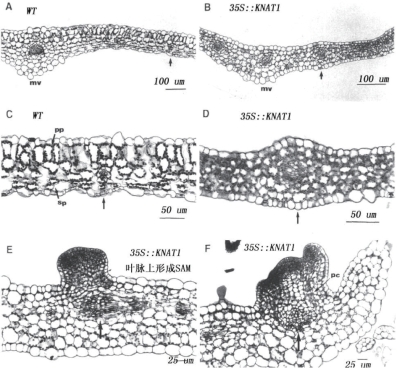
图9.31 KNAT1对叶片组织发育的影响(Chuck et al.,1996,ⓒASPB)
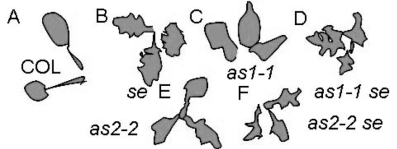
图9.32 AS1/2/SE对叶型的影响(Ori et al.,2000)(严海燕绘)
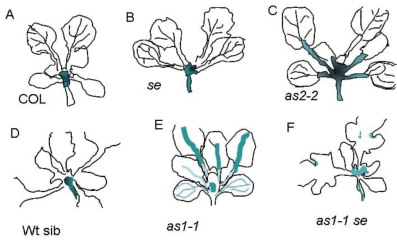
图9.33 AS1/2/SE对KNAT1在叶片中表达分布的影响(Ori et al.,2000)(严海燕绘)
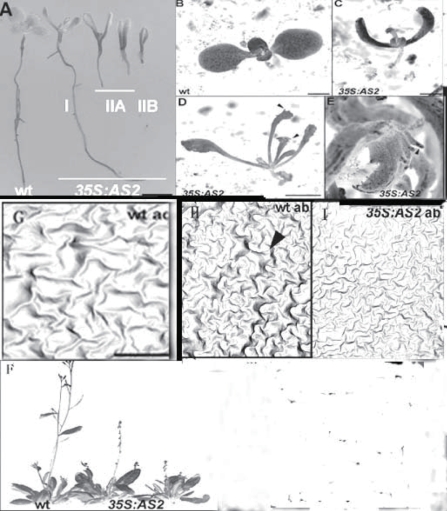
图9.34 AS2过量表达对叶型的影响(Lin et al.,2003,ⓒASPB)
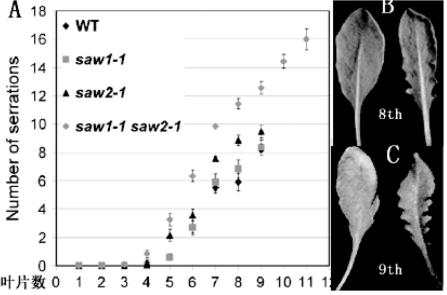
图9.35 BLH基因SAW1/2对叶型的影响(Kumar et al.,2007,ⓒASPB)
KNOX基因对分生组织的功能是必需的,然而叶原基中KNOX功能的抑制也是叶形态建成必需的。在35S启动子控制下,KN1与肾上腺皮质激素受体区域连接,恒定共表达,没有甾醇激素时该融合蛋白在细胞质中,一旦施加甾醇激素DEX(steroid dexamethasone),融合蛋白可以进入细胞核发挥作用,但这时其作用能否进行,取决于与之相互作用的各种因子的存在状态。这种情况排除了对KN1转录表达控制的调节作用。处于2~7部位的叶原基对DEX的处理敏感,并随着剂量的变化发生相应的反应。处理后叶出现裂生,缺乏叶柄、叶片生长减少,叶柄变宽导致无叶柄现象,而叶柄变宽的部位,除了中心维管束外还有平行的小维管束。在叶柄以上叶片部位,维管束分支散开,每支维管束通向一个叶边缘的突出点。叶边缘维管束的分布和结构也决定了叶边缘的形状。一般而言,维管束在叶边缘的连接圆滑,叶边缘形状也圆滑,维管束在叶边缘呈尖状突出连接,叶边缘也呈现齿状突出(图9.36,Hay et al.,2003)

图9.36 叶脉、叶型与KN1的关系(Hay et al.,2003,ⓒASPB DEX诱导后的35S:KN1-GR叶片)
BLADE-ON-PETIOLE1(BOP1)和BOP2编码BTB/POZ(Broad-Complex,Tramtrack,Bric-a-Brac/POX virus Zinc finger),与Cullin-3蛋白作用,可能属于经蛋白质降解酶途径降解的蛋白(Hepworth et al.,2005)。BOP1在拟南芥侧生器官通过抑制KNOX I类基因的活性控制侧生器官的发育(Ha et al.,2003),BOP1/2作用重叠,它们单独过量表达都引起叶形态的异常(图9.37,Ha et al.,2007),bop1 bop2双突变体b1b2叶柄变宽,叶型细长,与侧生器官极性因子AS1/AS2(a1/a2)的三突变组合叶型变化多样,一部分叶子的部分成线状,另一些较宽。而远轴极性因子KAN1KAN2双突变k1k2与a1或a2的三突变组合叶型变化最为急剧,叶子成为窄带状。b1b2与k1k2四突变叶型不规则(图9.38,Ha et al.,2007)。从不同组合突变体的叶柄维管束分布和极性看,AS1/2(a1/a2)和BOP1 BOP 2(b1/b2)都影响木质部和韧皮部在叶柄中的两侧对称性,a1a2k1/k2三突变组合导致木质部为中心、韧皮部围绕木质部的辐射对称,而b1b2k1k2导致木质部韧皮部相间排列,或木质部内韧皮部外、或韧皮部外木质部内多个维管束(3个)平均围绕中心分散分布,成辐射对称,有些类似于单子叶茎中维管束的分布(图9.39,Ha et al.,2007)。
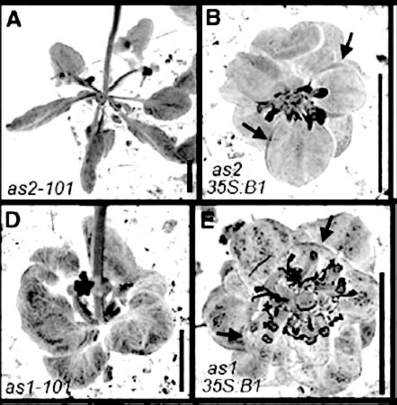
图9.37 BOP1过量表达的叶型变化(Ha et al.,2007,ⓒASPB)(严海燕修饰)

图9.38 BOP1/2、AS1/2、KAN1/2突变体不同组合对叶型的影响(www.chuimin.cn)
(Ha et al.,2007,ⓒASPB)(严海燕修饰)
TCP家族转录因子是最近发现的在植物发育多个阶段和器官发生中起重要作用的调控因子(参见第一章)。在分生组织范围和特性上是负调控因子(Aguilar-Martínez and Sinha,2013)。在叶子的起始和发生过程中,I类TCP结合在STM启动子上,抑制STM、KNAT1、KNAT2、CYCA1;1、CYCA2;3、AS1表达,影响叶子的起始。Ⅱ类TCP3抑制边缘特性基因CUC2、CUC3的表达,与AS2相互作用,调控KNAT1和KNAT2的表达。TCP3还激活AS1、MiR164、IAA3/SHY2、SAUR的表达,间接抑制CUC和STM的表达,从而抑制细胞分裂和控制叶边缘形态(Aguilar-Martínez and Sinha,2013)。JAW位点的MiR319a抑制Ⅱ类TCP中AtTCP2、AtTCP3、AtTCP4、AtTCP10、AtTCP24的表达,从而影响叶形态建成(Aguilar-Martínez and Sinha,2013)。
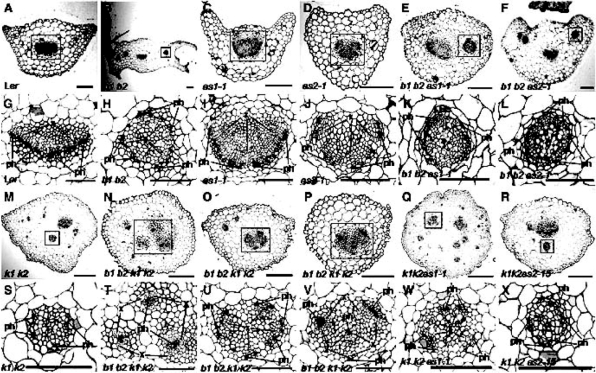
图9.39 BOP1/2、AS1/2、KAN1/2突变体不同组合对叶柄维管束分布和极性的影响(Ha et al.,2007,ⓒASPB)
复叶的发育与单叶不同。在复叶发育中起关键作用的基因是豌豆的UNIFOLIATA(UNI),金鱼草中的FLORICAULA(FLO),苜蓿SINGLE LEAFLET1(SGL1,图9.40,Wang H et al.,2008)与拟南芥的LEAFY(LFY)类似(Wang H et al.,2008;Champagne et al.,2007;Gourlay et al.,2000)。豆科植物中一个很大的分支中KNOXI类蛋白缺乏反向重复(inverted repeat-lacking clade,IRLC),不与复叶发育相关。这类IRLC植物中FLO/UNI在复叶的形成中对复叶中小叶原基的形成起关键作用。在非IRLC类豆科植物大豆中,FLO/LFY类基因表达减少导致微量小叶数目减少,个别复叶变为单叶,具有一定程度的作用,不影响全局。而KNOX I基因在非IRLC中起主要作用(图9.41,Champagne et al.,2007)。KNOX I在IRLC植物苜蓿中过量表达导致小叶数目增加(Champagne et al.,2007)。说明一些FLO在复叶的植物中对KNOX也有一定作用(Tattersall et al.,2005)。番茄叶也是复叶,番茄KNOX I类基因LeT6在复叶形成中起关键作用,过量表达LeT6导致多重复叶的形成(Janssen et al.,1998)。LeT6的功能需要AS1类基因LePHAN的作用(Kim M.et al.,2003)。这种KNOX I-ASI类因子的相互作用也体现在其他植物。Zhou等(2014)在紫花苜蓿中通过突变体杂交和基因表达分析等发现,与叶背腹极性密切相关的PHAN基因不受STM和BP等KNOX I基因的影响,反过来phan突变体中KNOX基因在叶原基和叶柄中的表达与野生型有明显差异(图9.42)。这说明不同类型的植物中,KNOX和FLO的作用程度不同,与进化和环境适应性有关。

图9.40 SG1决定复叶性状(Wang et al.,2008,ⓒASPB)

图9.41 KNOX基因在非IRLC复叶中的表达分布(A-E)和大豆FLO类基因RNAi抑制后的叶型(F、G)(Champagne et al.,2007,ⓒASPB)
另一类特殊的中空叶的形成则是通过细胞程序化死亡完成。细胞程序化死亡在叶发育过程中装饰叶边缘(Gunawardena et al.,2004)。水生植物Laceplant成熟叶片纵向与横向叶脉之间都是空洞(图9.43,Gunawardena et al.,2004)。
图9.44显示了Laceplant叶经过细胞程序化死亡形成中空网状叶的过程。阶段一,图9.43A~D,叶纵向卷曲,没有穿孔迹象。
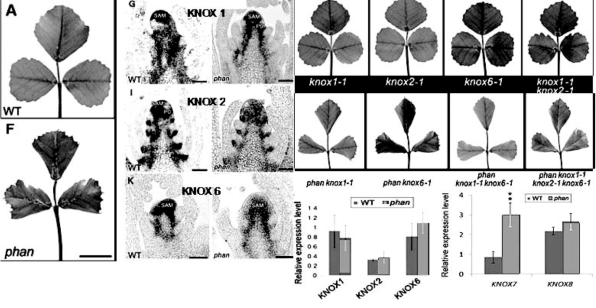
图9.42 紫花苜蓿中PHAN与KNOX对叶片极性的影响(Zhou et al.,2014,ⓒASPB)(严海燕修饰)
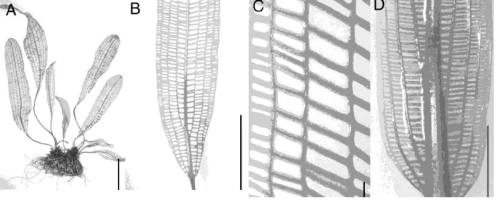
图9.43 成熟和发育中Lace Plant叶的形态(Gunawardena et al.,2004,ⓒASPB)
(A)全植物、(B)和(C)成熟叶显示纵向与横向脉。(D)穿孔前的未成熟叶(stage 2)
阶段二,图9.44 E~H,在穿孔位置的中心,第一个细胞起始PCD,由于失去花青素和叶绿素呈透明状。(H)与叶脉相邻的叶肉细胞保持色素。
阶段三,图9.44 I~P。第一个细胞经历PCD降解并在孔位点中心形成开口(I~K)。在L、M和P,细胞碎片,包括完整的核保留在孔边缘。L相差显微镜下显示的核。(M)用4,6-diamidino-2-phenylindole染色的同一核。(N)到(P)是扫描电镜早期孔形成图片。一些孔延伸成片。(O)表皮细胞壁降解的早期阶段。(P)表皮层降解后的完整核。
阶段四,图9.44 Q~T。叶子扩张时穿孔变大。穿孔边缘可见细胞碎片和完整的核。
阶段五,图9.44U~X。成熟叶V和W显示穿孔边缘的叶肉细胞转化成为延长的表皮细胞。X显示穿孔边缘残留的细胞壁填充了酚类褐色化合物。
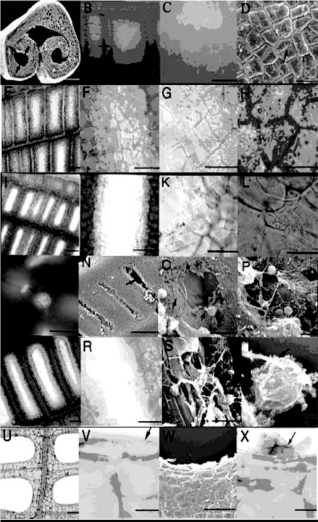
图9.44 Lace Plant叶发育阶段Gunawardena et al.,2004,ⓒASPB
有关植物发育生物学的文章

突变的lfy基因引起AP3基因表达的下调。一个弱的ufo突变体ufo-11可以造成轮2花瓣不能形成,但是轮3雄蕊正常,说明UFO在轮2花瓣形成中的作用。一个弱的ag突变体ag-4是无限花,具有花萼-花瓣-雄蕊重复分布类型。......
2023-11-20

早期顶端中心区域的组织分化由决定分生组织中心的基因STM、WUS和侧生相关基因在特定区域和特定时间的限制表达决定。STM始终在顶端分生组织表达,在促进早期子叶的分离中起重要作用。决定子叶分离的CUP SHAPED COTYLEDON 1、CUC2、CUC3基因的表达需要MP和PIN1的活性,后两者都与生长素运输有关,进一步证明生长素在顶端分区中的作用。说明乙酰辅酶A羧化酶在两侧极性形成过程中起重要作用。......
2023-11-20

WUS开始在所有顶端的亚表皮层表达,最后限制到茎分生组织更中心和更深的区域。WUS表达的精确调控对顶端类型的形成很关键。WUS所在区域是未分化干细胞中心区域内。CLV1/CLV2受体分布范围决定CLV3的作用范围。STM在胚发生的后球形阶段胚顶端的中心区域独立于WUS表达,是含有三氨基酸延伸区域同源盒[three amino acid loop extension,homeodomain]区域和MEINOX区域的HD-KNOX蛋白,作用目标是核内的DNA。......
2023-11-20

根冠由中柱和外围细胞组成,分别由相应的起始细胞形成。根冠分化的最后一步包括最外层细胞从根冠分离。由于被黏液包围,边界细胞其余部分与根尖紧密连接。豌豆根尖和边界细胞排出物中含有一百多种蛋白。边界细胞受到内外因素的影响,根冠边界细胞分离的类型、方式和数目依植物种的不同变化,但在科的水平稳定。根冠边界细胞分离的方式依赖根尖分生组织的类型。植物激素影响边界细胞的释放。......
2023-11-20

种子由来自两个二倍体合子发育形成的胚、三倍体胚乳和母本的种皮组成。胚发育过程中胚乳和种皮对种子的大小有重要作用。从合子开始的胚胎发生过程中,细胞内物质分布和基因表达不对称分布的状态随着不对称分裂造成子细胞不对称和分化状态不同,相应状态随着有丝分裂传递到后续的子代,决定未来细胞的分化结果,这种在分裂后代传递分化决定因素的作用,称为细胞衍生作用。整个植物的发育中细胞衍生作用和组织位置效应贯穿其中。......
2023-11-20

开花植物中,胚囊的种类有四孢子起源、二孢子起源、单孢子起源,即使是单孢子起源,核在胚囊内迁移的数目和位置决定了中心细胞的核数目,从而决定受精后胚乳的倍性。图6.9介绍了不同进化水平的植物胚囊结构、中心细胞核数目和双受精后胚乳的倍性。下面以双子叶植物拟南芥和单子叶植物玉米为代表介绍胚乳的形成过程和机理。受精时一个来自花粉管的单倍体雄核进入中心细胞,三个核融合形成三倍体原胚乳核。......
2023-11-20

细胞分裂素对韧皮部的形成是必需的。wol突变体根和胚轴维管束没有韧皮部形成,中柱细胞层减少。WOX9在中部区域形成中起重要作用。甾醇类物质影响胚的分化,编码甾醇还原酶类家族的FACKEL基因的突变使胚生长迟滞,形状停止在心形胚状态,与油菜甾醇突变体表型相似。中部区域在辐射方向分化,从中心的中柱向外形成皮层和表皮。在发育过程中表达保持在维管组织。......
2023-11-20

位点印记指从DNA结构或染色体结构上对基因的控制表现为母方或父本的表型。它们的突变体表型相似,未受精突变体胚乳和果实发育,种子不育;受精突变体种子胚乳过量繁殖,细胞化延迟,胚发育终止,最后种子不育。反之,野生型母本与met1-3/+父本杂交,大小种子各占一半,说明雄配子中MET1功能的丧失使父本印记的生长抑制基因表达,引起胚乳和种子大小减小。......
2023-11-20
相关推荐