周缘分生组织在局部区域强烈的分裂活动,从周围区域形成侧生器官原基,包括花原基和叶原基或者腋芽原基。茎尖分生组织的干细胞状态和数目的维持依赖于严格的基因表达调控。在SAM的最中心位置的干细胞的细胞分裂不仅发生频率低,而且其分裂后产生的基础细胞向外向下的移动和分化最终到周围区域并参与最终的器官建成。茎顶端分生组织各区域之间基因的表达具有特异性和相互作用,表现出细胞分裂和组织分化的位置决定性。......
2023-11-20
Reddy等人采用即将进入细胞周期M的标记基因cyclinB1;1::GFP显示茎顶端分生组织和花芽顶端分生组织中原基最初起始细胞的位置(图9.10),发现起始细胞的发生和分布在L1层和L2层是单独进行的。Grandjean等人(2004)对拟南芥茎顶端分生组织的细胞分裂、生长和分化进行了活体观察和分析。他们用生长素抑制剂NPA抑制侧生器官的发育,获得了未分化的生长顶端。
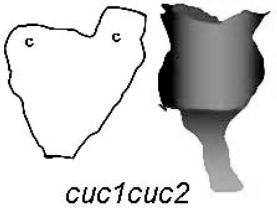
图9.8 CUC对子叶形成的作用(Aida et al.,1999)(严海燕绘)
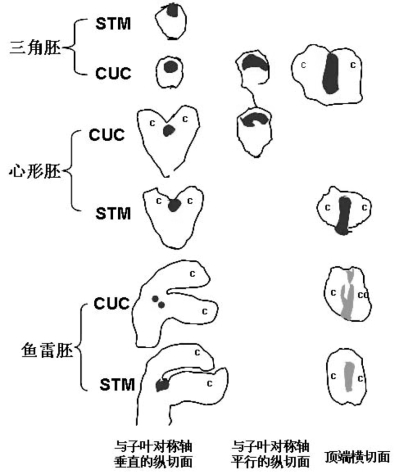
图9.9 CUC2与STM在SAM表达的相对位置关系(Aida et al.,1999)(严海燕绘)
拟南芥茎顶端分生组织侧生原基的形成速度大约每24小时形成一到两个侧生原基(图9.11A~D,Grandjean et al.,2004)。侧生原基的形成和增大通过从分生组织聚集新的细胞和侧生原基中已有细胞的有丝分裂两个阶段进行,每个周期小于24小时(图9.12A~D,Grandjean et al.,2004)。新的侧生原基细胞的聚集表现在ANT在新的细胞的表达(图9.11E~F)。各侧生原基平均分裂指数相当。但原基从P2-P3的转变期细胞指数急剧上升,24小时可达193%。L1、L2和中间区域的变化相似(Reddy et al.2004)。
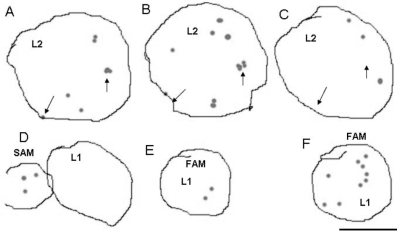
图9.10 茎顶端分生组织中原基起始细胞的分布(Reddy et al.,2004)(严海燕绘)
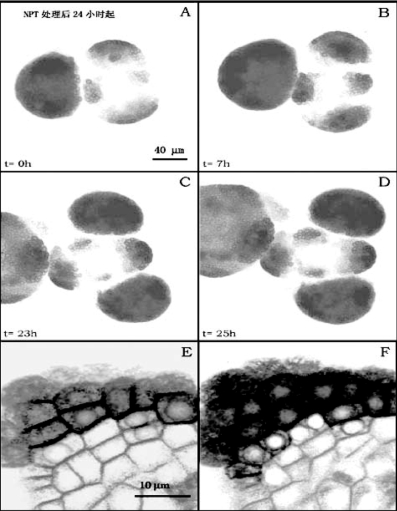
图9.11 叶序形成和细胞分化
(Grandjean et al.,2004,ⓒASPB原基用ANT::GFP标记)(严海燕修饰)

图9.12 SAM分裂频率的不均性(Grandjean et al.,2004,ⓒASPB)
茎顶端细胞分裂的方向与原基形成的突起方向一致,分裂轴向与近-远轴向垂直的较多,初次分裂多是这个方向(图9.13,Reddy et al.,2004)。细胞分裂频率在茎顶端分生组织中心区域(CZ)远低于周围区域(PZ),每个区域内单个细胞之间分裂频率也不同(图9.12,Grandjean et al.,2004;Reddy et al.,2004)。中心区域每24小时平均细胞增加率为39.8%,周围区域每24小时细胞增加率为81.1%。相邻细胞间的分裂周期率不同。24小时内一个细胞不分裂,另外一个细胞分裂几次(图9.12)。细胞分裂快慢以细胞周期或者细胞分裂指数衡量,各侧生原基的平均分裂指数在初期相当,但从P2-P3的转变中发生变化。P2细胞周期长度在24~36小时,在向P3转变中急剧降低到12~18小时。这种变化在L1、L2和中间区域具有相似性(Reddy et al.,2004)。细胞周期长度的分布范围与细胞分裂指数一致。细胞周期长度的范围从12~18小时跨越到90~96小时,多数细胞分裂时间为12~36小时(Reddy et al.,2004)。
从细胞周期看,侧生原基内细胞周期长度变化的范围在36~72小时。光照后72小时内的基因表达趋势中,与细胞分裂有关的周期蛋白cyclin B1;1和cyclin D3;3在6小时处表达量达到高峰,1小时处cyclinB1;1有一个小峰,可能与CZ中原基的起始分裂有关(López-Juez et al.,2008)。用细胞质分裂抑制剂(不抑制DNA合成)Oryzalin、DNA合成抑制剂Aphidicolin和Hydroxyurea处理未形成侧生原基和刚形成侧生原基的生长顶端,分别在不同时段观察原基中细胞分裂、扩张和分化的情况。Oryzalin处理的细胞不分裂,但DNA仍然合成,细胞扩张。Hydroxyurea(H)处理的细胞分裂和DNA合成都被抑制,细胞大小不变,不再扩张,但仍然合成RNA和蛋白质,可以进行细胞分化(Grandjean et al.,2004)。观察显示,细胞分裂的停止不影响细胞分化,没有细胞分裂的早期仍有CZ区衍生的细胞表达ANT,转变进入侧生原基(Grandjean et al.,2004)。
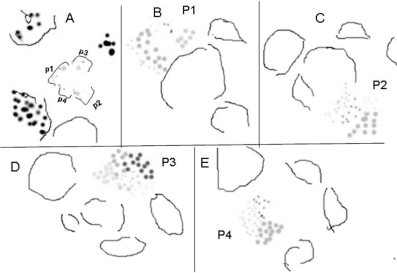
图9.13 侧生原基形成过程中细胞衍生途径(Reddy et al.,2004)
(严海燕绘。图中每一类小点标志着来自同一个细胞)(www.chuimin.cn)
细胞分裂有一系列标记基因,例如CYCD3、CYCB2、CYCA2.1和CYCA2.2等可以用于表征细胞分裂调控状态。Yang等(2013)在水稻中发现一个ge(giant embryo)突变体,GE基因编码内质网定位的CYP78A家族的P450单氧裂解酶。突变体具有超大种子,胚和胚乳发育平衡调控异常,SAM显著变小。胚胎发育过程切片显示由于ge突变体中OSH1(KNOX-I基因)和组蛋白H4的表达变化,SAM中干细胞不能维持未分化活性。GE的超量表达造成水稻种子变大和叶片变长,说明GE基因具有促细胞生长的作用。基因表达分析表明CYCD3等细胞周期调控基因表达比野生型均提高,说明突变体SAM的缺失可能是由于细胞周期调控异常所致。
侧生原基的突起是由于细胞的不等分裂和细胞定向扩张造成的。在原基内、原基边缘和原基之间细胞分裂的频率和周期长度不同(表9.1,Reddy et al.,2004)。P2到P3的转变期侧生原基与中心区域之间细胞分裂缓慢(图9.14A,C),细胞不等向扩张,侧生原基明显与顶端分生组织分离(图9.14D~G),形成独立的侧生原基,标志着侧生器官发生的起始(Reddy et al.,2004)。
表9.1 茎顶端分生组织各侧生原基转化过程中细胞分裂情况(Reddy et al.,2004)
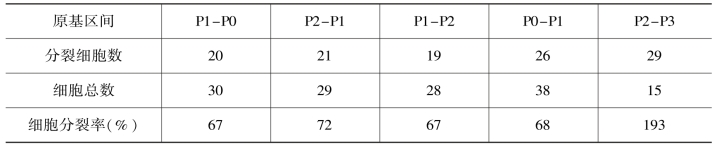
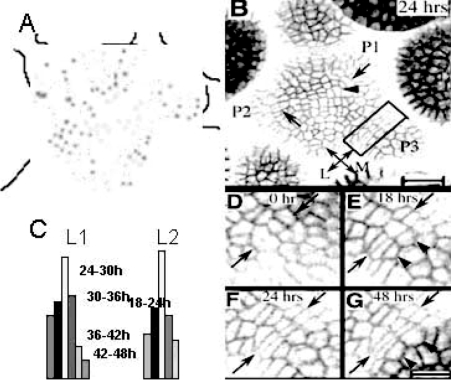
图9.14 茎顶端分生组织细胞周期类型分布和侧生原基与中心区之间细胞的定向扩张(Reddy et al.,2004)(严海燕修饰、绘)
拟南芥Kip-related proteins(KRP)对细胞周期调控关键基因CDK有负调控作用(Jun et al.,2013)。KRP3的超量表达植株不仅具有裂叶,各个器官变小和结实率降低等性状,而且SAM显著变小并且具有不同的细胞类型分布。统计数据显示KRP3超表达植株SAM中细胞变大,数目变少,平均细胞染色体倍性增高,显示了细胞分裂和细胞周期调控异常。
生长素的不均一分布对于SAM的维持和叶原基或花原基的发育都很重要,生长素转运蛋白PIN1的表达是影响生长素分布的关键因子。在以短柄草为代表的草本植物中发现sister of PIN(SoPIN1),它与PIN1,PIN2等在SAM中的定位不同,在生长素的运输中参与不同部位的运输功能(O'Connor et al.,2014)。这种进化中发生的基因家族进化和功能上的分化保证了植物体内生长素分布的精细调节(图9.15)。Wang等(2014)在拟南芥和番茄中分离到pid-9突变体,PID9为AGCⅢkinase,参与调控PIN1的分布和生长素的侧向运输。pid-9突变体PIN1蛋白在SAM中分布异常,影响了侧生原基的发育,造成与aux lax1 lax2三突变体类似的表型(图9.16)。
拟南芥ERECTA基因家族,包括ER、ERL1、ERL2三个基因,均编码LRR(leucine rich repeat)受体激酶。er erl1 erl2三突变体中PIN1蛋白在SAM和新的叶原基中的分布异常,SAM表层L1和L2细胞纵向延伸受阻,细胞横向膨大,SAM明显小于野生型,叶原基产生速度变慢,叶序发生变异(图9.17,Chen et al.,2013)。ER受体激酶对WUS基因具负向调控作用,这种作用与CLV1-CLV3对WUS的调控是并行的,在HD-ZIPⅢ与ER的双突变体中,由于WUS基因的显著上调造成SAM的显著增大和花序分生组织中细胞命运的改变,这进一步证明WUS在顶端分生组织发育和侧生器官形成中的关键作用(Mandel et al.,2014)(参见第一章)。
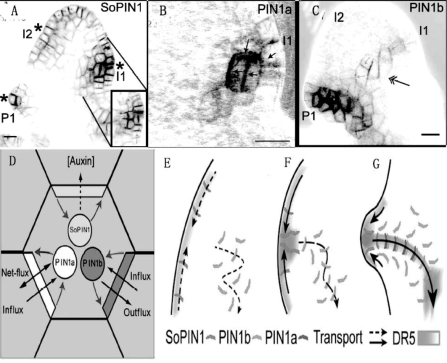
图9.15 SoPIN与PIN1、PIN2共同参与SAM中生长素运输
(O'Connor et al.,2014,ⓒASPB)(严海燕修饰)

图9.16 AtPID9对侧生原基分生组织生长素分布的调控
(Wang et al.,2014,ⓒASPB)严海燕修饰)
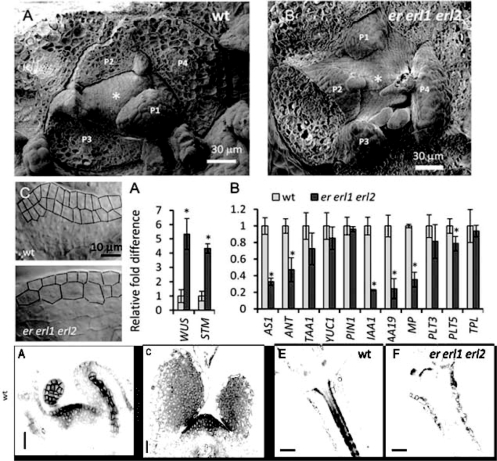
图9.17 ERECTA家族基因影响PIN1的表达和SAM及叶原基的发育(Chen et al.,2013,ⓒASPB)
有关植物发育生物学的文章

周缘分生组织在局部区域强烈的分裂活动,从周围区域形成侧生器官原基,包括花原基和叶原基或者腋芽原基。茎尖分生组织的干细胞状态和数目的维持依赖于严格的基因表达调控。在SAM的最中心位置的干细胞的细胞分裂不仅发生频率低,而且其分裂后产生的基础细胞向外向下的移动和分化最终到周围区域并参与最终的器官建成。茎顶端分生组织各区域之间基因的表达具有特异性和相互作用,表现出细胞分裂和组织分化的位置决定性。......
2023-11-20

侧根从主根中柱的中柱鞘起始,生长素在中柱鞘的特定区域积累,诱导相关区域的细胞分裂,形成侧根起始细胞。凡是影响生长素运输和分布的因素都影响侧根的形成。细胞分裂素在侧根起始细胞中的存在抑制侧根的形成,与生长素作用相拮抗。另一个研究证明了仅仅是机械弯曲,不依赖重力和生长素就能造成侧根形成的起始。......
2023-11-20

叶脉是叶片中支持叶结构、提供营养物质的维管束网络,是植物叶结构的基本骨架,决定了叶片的形状。叶脉网络结构的发育和建成从叶原基开始,始终伴随着叶的发育和形态建成,是叶片发育和形态建成的关键组成。从叶原基开始生长素决定维管束形成是通过叶原基表皮和幼叶边缘表皮中生长素会聚点及已存在的维管束相对位置决定的。......
2023-11-20

只有与静止中心接触的起始细胞受到影响,表明从静止中心短距离发射信号保持周围起始细胞的干细胞活性。生长素通过控制影响胚根发育的一系列关键基因起作用。突变体对生长素反应,但生长素反应元件DR5只在高浓度下反应,表明反应强度降低。与生长素运输有关的载体和蛋白对根的发育有影响。......
2023-11-20

在胚发生阶段,根的原分生组织已经形成一定结构,萌发时分生组织开始分裂,胚根沿轴向伸展,分生组织的细胞数目增加、繁殖速度增加。到成熟根阶段,这部分组织发育成原分生组织。这些原分生细胞的衍生细胞发育形成中心区细胞和轴柱根冠细胞。植物的根系结构在不同的发育阶段和环境中形态结构不同。维管束又由中柱鞘、木质部、形成层和韧皮部组成,不同的植物在不同的发育阶段和环境中其根中各种组织的分布和结构有不同。......
2023-11-20

植物的花粉成熟后,被释放出来,不同的植物通过不同的传粉机制,将花粉传播到雌蕊上。营养核用于为花粉的萌发和花粉管的生长或两核花粉中生殖核的进一步分裂提供营养。风媒花粉与以动物为媒介的花粉和柱头在结构上大不相同。花粉到达柱头后,与柱头发生相互识别和相互作用后萌发,花粉管进入柱头,并深入花柱,在花柱内受到雌蕊中各种因素和信号的导引,向胚珠生长,最后通过珠孔,在胚囊内释放两个精子。......
2023-11-20

位点印记指从DNA结构或染色体结构上对基因的控制表现为母方或父本的表型。它们的突变体表型相似,未受精突变体胚乳和果实发育,种子不育;受精突变体种子胚乳过量繁殖,细胞化延迟,胚发育终止,最后种子不育。反之,野生型母本与met1-3/+父本杂交,大小种子各占一半,说明雄配子中MET1功能的丧失使父本印记的生长抑制基因表达,引起胚乳和种子大小减小。......
2023-11-20

叶的生长分化建立在细胞分裂和分化的基础之上。生长素在器官发生中起主要作用,细胞分裂素在生长素诱导的器官发生中起修饰作用。器官发生中细胞分裂素通过影响生长素运出载体的分布改变生长素的分布,从而改变生长素反应的区域。在叶中不同部位,不同的因子与KNOX I类基因相互作用,抑制和调节细胞分裂和分化活动。......
2023-11-20
相关推荐