干细胞具有细胞分裂少、未分化的原始分生细胞特性,传统植物学中称为原分生组织。WUS在干细胞区直接与分化有关转录因子基因的启动子结合,抑制它们的转录。过量表达WUS,将在器官基数上过量。而限制WUS分布范围的CLV信号转导系统任一元素的失效都会导致WUS范围扩大,相应器官数目增多。由SUPER1编码的YUCCA5过量表达引起游离IAA和生长素反应增加,造成生长素过量的表型。......
2023-11-20
茎顶端分生组织几个区域的特性分别由几个关键基因决定,光、生长素和细胞分裂素等激素通过多种途径调控这些关键基因,细胞内各种表观遗传调控以及各种表达水平的调控协同作用,共同修饰调节顶端生长。
茎顶端分生组织中心区域未分化细胞的标志基因WUSCHEL(WUS)基因(图9.1)能抑制干细胞的分化,从而保持分生细胞在一定的数量水平。拟南芥wus突变体丧失维持茎尖分生组织细胞数量的功能,形成一个形态异常、功能缺失的茎尖分生组织。茎尖分生组织分化少许的几片叶子以后,因为分生细胞耗尽而停止了生长(Laux,1996)。WUS在胚发育早期在生长素分布的浓度较低区域表达。在早期到晚期球形胚和心形胚以及愈伤组织诱导的前胚上,生长素运出载体PIN1与WUS共表达。当子叶分开,茎顶端分生组织形成时,只有WUS分布在表皮下分生组织中心区域。生长素与WUS的共表达说明生长素可能对WUS的表达起诱导作用。
WUS的分布范围通过CLV3和CLV3类似的CLE信号肽与识别它们的几个不同的细胞膜上的受体激酶复合体CLV1/CLV1复合体、CLV2/CRN复合体以及BAM等的协同调控,对WUS的表达范围进行抑制或促进,使WUS限制在中心区域,保持一定的干细胞数目。WUS与CLV系统的反馈调控环是控制茎尖分生组织正常功能的重要调控手段。
茎顶端分生组织中生长素水平见光后急剧下降,细胞分裂素活性上升(López-Juez et al.,2008)。细胞分裂素受体AHK2和AHK4在茎和花顶端分生组织介导细胞分裂素作用,AHK2介导不依赖CLV的途径诱导WUS的表达,而AHK4介导依赖CLV的途径诱导WUS的表达。细胞分裂素诱导A类和B类ARR的表达,A类ARR5被AHK在ASP区域磷酸化,可能通过这种磷酸化作用负调控细胞分裂素的信号传导,ARR5也抑制WUS的表达。WUS反过来抑制ARR5的活性,激活CLV3的表达,高水平细胞分裂素抑制CLV1的表达,而CLV3和CLV1形成复合体抑制WUS的表达。细胞分裂素通过AHK4抑制CLV1的表达降低CLV1/CLV3复合体对WUS的抑制,促进WUS的表达(Gordon et al.,2009)。
WUS与CLV3的转录水平也受到表观遗传修饰的调控。Yue等(2013)发现拟南芥skb1突变体通过H4R3me2-组蛋白H4上第3位精氨酸双甲基化修饰,调控可以与CLV1形成异源复合体的CRN蛋白的表达,skb1中WUS和CLV3的表达也同时降低,造成SAM宽度降低的表型。
Schuster等(2014)从拟南芥中分离到bHLH类转录因子HEC基因家族,包括HEC1、HEC2、HEC3三个基因。HEC1处于WUS-CLV3反馈环上游,以背景特异方式抑制WUS和CLV3的表达,三突变体的SAM显著变小,HEC基因与SPT(bHLH类转录因子)存在体内互作,转录组分析表明HEC基因还调控与细胞分裂素反馈调控相关的ARR7、ARR15等基因的表达。
microRNA通过对WUS和CLV3等基因的转录和翻译抑制影响SAM的发育,例如由AGO1复合体和miR165/166通过负调控HD-ZIPⅢ,影响WUS-CLV3信号途径和SAM干细胞的维持(Tucker et al.,2013)。ZLL/AGO10与AGO1具有相拮抗的关系。SQN(SQUINT)基因编码拟南芥Cyclophilin-40类似蛋白,修饰ZLL/AGO10,属于FLETSCHE(FHE)1~5五个位点中的FHE2,它们的序列和表达在拟南芥不同的生态型种中发生变异,最终影响WUS-CLV3(Tucker et al.,2013)。
Knauer等人(2013)在拟南芥中通过正向遗传学分离到enh146突变体,鉴定为miR394的错义突变。enh146 ago10双突变体造成98%的植株缺失SAM,由于错义突变,miR394不能负调控靶基因LCR(leaf curling responsiveness)。LCR为F box蛋白,与26S蛋白酶体介导的蛋白质降解有密切关系,抑制WUS-CLV3信号途径。miR394通过RNAi方式下调SAM远端细胞层中LCR蛋白的表达水平,从而影响SAM中细胞信号途径和分化的发生。
茎顶端分生组织的另一个必需基因是Shoot meristemless(STM)。STM编码含有MEINOX三个氨基酸环的HD转录因子,其MEINOX区域与BLH(Bel1-like homeodomain)类型的转录因子中的BELL区域结合,形成异源聚合体,这种结合对于它们进入细胞核是必需的。STM属于KNOX基因家族中的类型I基因,KNOX I类基因具有促进细胞分裂和延长的特性(Lenhard et al.,2002;Douglas et al.,2002)。不同的KNOX基因在不同的部位与不同的因子相互作用,被限制在特定区域表达,促进相应部位的细胞分裂和器官发育。拟南芥KNAT1(又称BP,BREVIPEDICELLUS)、2、6、STM(Shoot meristemless)是KNOX I类基因,在茎顶端分生组织表达。玉米的(KNOTTED1)KN1与拟南芥KNAT1和STM最相似,与KNAT1在结构上相似,在功能上与STM相似。玉米的KN1基因是第一个克隆出来的同源盒基因,以后类似KNOTTED的基因(KNOTTED1-like homeobox)称为KNOX基因。拟南芥KNAT3、KNAT4、KNAT5、KNAT7是Ⅱ类KNOX基因。
STM在茎顶端分生组织中心区域和周围区域表达,不同部位表达量受到相应区域各种不同因子的控制。STM诱导催化细胞分裂素CK合成有关酶的基因IPT7(isopentyltransferase)、细胞分裂周期蛋白CYCB1;1、CYCD3、边界基因CUC1、CUC2、CUC3、降解CUC的miR164a、降解赤霉素的GA2ox1等基因的表达,降低合成赤霉素的GA20ox1的表达,提供一个高细胞分裂、低细胞分化的环境(Spinelli et al.,2011)。STM还诱导KNAT1和KNAT2的表达,抑制侧生器官发育促进因子AS1(ASYMMETRIC LEAVES1)的表达(Lenhard et al.,2002)。细胞周期调控蛋白CYCD3激活周期蛋白依赖的激酶cyclin-dependent kinases(CDKs),通过RETINOBLASTOMA RELATED(RBR)蛋白的磷酸化直接进入S期,促进细胞的有丝分裂,同时抑制细胞内复制和分化。CYCB1;1促进细胞由G2进入M期,从而促进细胞分裂。CK也促进CYCD3、KNOX等基因的表达(图9.6)。同属于KNOX家族蛋白的KNAT1/BP,KNAT2在抑制细胞分化和维持干细胞数量上与STM有类似的功能,但是对于CK的需求有所不同(Scofield et al.,2013)。相比之下,WUS虽然诱导干细胞特性,但不诱导KNAT1、KNAT2的表达和细胞分裂。STM和KNAT1/BP具有不依赖高水平CK、CYCD3、WUS活性,直接诱导SAM的从头形成,KNAT2无此作用。STM和WUS共同维持干细胞分生区的特性(Lenhard et al.,2002)。
KNAT6在茎顶端分生组织的周围区域表达,在胚发育中表达时期晚于STM,与STM作用重叠,共同保持分生组织特性。KNAT2不具有这个作用(Belles-Boix et al.,2006)。KNAT1和PNY(PENNYWISE,KNOX类基因)在花序顶端分生组织限制KNAT6和KNAT2的表达,保证花序形态的正常(Ragni et al.,2008)。茎顶端分生组织中KNAT1可能具有相似的作用。STM和KNAT1的作用部分重叠(Souček et al.,2007)。BELL转录因子BHL3和BHL9在SAM特定位点表达并可与STM结合,因此赋予STM不同的功能(Aida et al.,1999;Cole et al.,2006)(www.chuimin.cn)
SEU和SLK处于包括STM、BP/KNAT1、KNAT2等KNOX I基因的上游,通过对这些基因的调控影响生长素在SAM的分布和形态建成。seu slk2双突变体缺失SAM,子叶既小且窄,STM、BP、KNAT2、KNAT6等KNOX I基因表达均比野生型有显著下降(图9.6)(Lee et al.,2014)。
拟南芥KNAT1、KNAT2在茎顶端分生组织普遍表达,生长素类对KNAT1在茎顶端分生组织的表达没有明显影响,细胞分裂素和光扩大KNAT1在茎顶端分生组织的表达范围(Souček et al.,2007)。KNAT基因的表达也受到其他上游基因的调控,并且影响赤霉素在顶端分生组织的分布。玉米半显性突变extra cell layers1(xcl1)导致茎顶端分生组织多层表皮细胞形成,更多细胞加入叶原基的形成,茎顶端分生组织区域减小,KN1活性受到部分抑制,参与赤霉素降解的GA2ox表达提高,而参与赤霉素合成的GA20ox没有明显变化(Kessler et al.,2006)。烟草中KNOX基因Nicotiana tabacum homeobox 15(NTH15)在SAM顶端分生组织的原生分生区域抑制赤霉素合成酶基因GA20ox的表达,保持原分生组织的未分化状态(Sakamoto et al.,2001)。
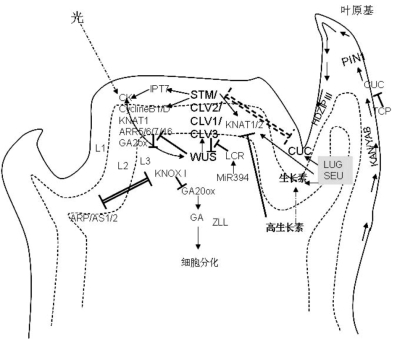
图9.6 茎顶端分生组织基因调控网络示意图(严海燕绘)
L1层的细胞分裂类型影响茎顶端分生组织的保持。玉米野生型KN1在茎的皮层表达并运输到表皮,在SCR启动子控制下分布在L1、L2、L3层(Kim JY.et al.,2002),拟南芥KNAT1、KNAT2、STM蛋白也可以从茎顶端分生组织内部向L1进行单向细胞间移动(Kim JY.et al.,2003)。KNOX同源盒区域的功能足以完成KNOX蛋白质和mRNA的细胞间移动功能(Kim JY.et al.,2005)。
在茎顶端分生组织的周围区域,拟南芥YABBY类蛋白FILAMENTOUS FLOWER(FIL)和YAB3决定侧生器官远轴特性,这两个蛋白的突变引起侧生器官中KNOX类基因STM、KNAT1、KNAT2的去抑制,同时部分恢复stm突变体的表型(Kumaran et al.,2002)。ANT(AINTEGUMENTA)与FIL和YAB3启动子结合,三突变或双突变叶和花极性异常,叶和植株个体减小(Nole-Wilson and Krizek,2006)。FIL和YAB3与LEU(LEUNIG)、LUH(LEUNIG-HOMOLOG)、SEUSS和SEUSS相关蛋白形成复合体,对胚性茎顶端分生组织的起始、胚后茎顶端分生组织的保持、叶子的近轴和远轴特性都起着重要作用(Stahle et al.,2009)。转录因子KANADI和YABBY共同控制叶片远轴特性。KANADI类的KAN1、KAN2、KAN3在器官发生中具有重叠作用,共同决定远轴特性,抑制HD ZIPⅢ类的PHABULOSA(PHB)、PHAVOLUTA(PHV)、REVOLUTA(REV)的近轴功能(Eshed et al.,2004)。HD ZIPⅢ类基因PHB、PHV、REV、CORONA(CNA)和远轴转录因子KAN在发育的胚中都通过影响PIN1的分布,影响生长素反应。kan1、kan2、kan3突变体PIN1在侧向有额外分布,导致侧生原基形成(图9.7),植株形态异常(Izhaki and Bowman,2007)。一类小ZIP蛋白ZPR3\ZPR4与PHB等HD ZIPⅢ类蛋白在ZIP区域结合,形成异源聚合体,负调控HD ZIPⅢ类的活性,zpr3-2 zpr4-2双突变体分生组织活性改变,干细胞保持异常。PHB正调控ZPR3的表达(Kim Y.et al.,2008)。
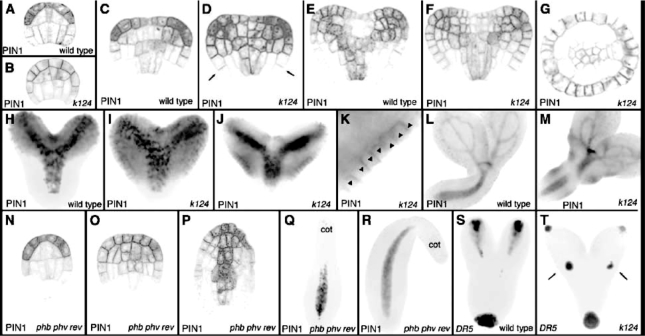
图9.7 近轴和远轴类基因对PIN1表达分布的影响(Izhaki and Bowman,2007,ⓒASPB)(严海燕修饰)
一批边界基因在茎顶端分生组织与子叶或侧生原基的分离中与STM等基因一起发挥重要作用。CUP-SHAPED COTYLEDON(CUC)三个同源类似基因具有重叠作用,在茎顶端分生组织与子叶和侧生原基的边界分离中,共同保持分生组织的结构和子叶的分离(Aida et al.,1999;Vroemen et al.,2003;Belles-Boix et al.,2006)。cuc1和cuc2的双突变子叶完全融合,呈杯状(图9.8)。PIN1和MP表达影响CUC1和CUC2的表达分布,pin1mp双突变体CUC1表达范围扩大,CUC2表达范围缩小,表明PIN1和MP在外侧抑制CUC1的表达,在内侧促进CUC2的表达(Aida et al.,2002)。在胚发生早期的球形胚和心形胚阶段,CUC2的表达区域与STM的表达区域在L1层下的区域重叠(图9.9,Aida et al.,1999),CUC1和CUC2的表达对STM的表达是必需的,双突变体胚中STM不表达。STM表达后抑制CUC2的表达。当有活性的STM发挥功能时,CUC2在STM活跃区域下调表达,只剩在STM不表达的周围区域表达,这时进入鱼雷期,子叶分开,与顶端分生组织形成边界,CUC在此区域表达(图9.9,Aida et al.,1999;Vroemen et al.,2003)。TCP类基因在SAM和叶边缘限制CUC的分布范围(参见第一章)。
有关植物发育生物学的文章

干细胞具有细胞分裂少、未分化的原始分生细胞特性,传统植物学中称为原分生组织。WUS在干细胞区直接与分化有关转录因子基因的启动子结合,抑制它们的转录。过量表达WUS,将在器官基数上过量。而限制WUS分布范围的CLV信号转导系统任一元素的失效都会导致WUS范围扩大,相应器官数目增多。由SUPER1编码的YUCCA5过量表达引起游离IAA和生长素反应增加,造成生长素过量的表型。......
2023-11-20

成熟雌蕊有两种心皮融合形式,其小室由中心隔膜分离。雌蕊的中间区域保持相对的未分化状态,两侧发育成包括胎座分生活性在内的组织。BEL1和其他因子对珠被形态特性有正的决定作用,缺乏可导致AG占支配地位,导致心皮样结构的出现。包括胎座、胚珠和隔膜的中间区域缺失。......
2023-11-20

位点印记指从DNA结构或染色体结构上对基因的控制表现为母方或父本的表型。它们的突变体表型相似,未受精突变体胚乳和果实发育,种子不育;受精突变体种子胚乳过量繁殖,细胞化延迟,胚发育终止,最后种子不育。反之,野生型母本与met1-3/+父本杂交,大小种子各占一半,说明雄配子中MET1功能的丧失使父本印记的生长抑制基因表达,引起胚乳和种子大小减小。......
2023-11-20

WUS开始在所有顶端的亚表皮层表达,最后限制到茎分生组织更中心和更深的区域。WUS表达的精确调控对顶端类型的形成很关键。WUS所在区域是未分化干细胞中心区域内。CLV1/CLV2受体分布范围决定CLV3的作用范围。STM在胚发生的后球形阶段胚顶端的中心区域独立于WUS表达,是含有三氨基酸延伸区域同源盒[three amino acid loop extension,homeodomain]区域和MEINOX区域的HD-KNOX蛋白,作用目标是核内的DNA。......
2023-11-20

早期顶端中心区域的组织分化由决定分生组织中心的基因STM、WUS和侧生相关基因在特定区域和特定时间的限制表达决定。STM始终在顶端分生组织表达,在促进早期子叶的分离中起重要作用。决定子叶分离的CUP SHAPED COTYLEDON 1、CUC2、CUC3基因的表达需要MP和PIN1的活性,后两者都与生长素运输有关,进一步证明生长素在顶端分区中的作用。说明乙酰辅酶A羧化酶在两侧极性形成过程中起重要作用。......
2023-11-20

只有与静止中心接触的起始细胞受到影响,表明从静止中心短距离发射信号保持周围起始细胞的干细胞活性。生长素通过控制影响胚根发育的一系列关键基因起作用。突变体对生长素反应,但生长素反应元件DR5只在高浓度下反应,表明反应强度降低。与生长素运输有关的载体和蛋白对根的发育有影响。......
2023-11-20

顶端基部极性在合子分裂前合子中就已经确立。受精、光、重力等因素可以诱导褐藻黑角菜属海藻Fucus合子中极性的建立。合子是由卵细胞和精子融合而成,二者所携带已存在的各种因子在合子中发挥作用,是合子发育的基础。在卵细胞和合子中干细胞特性基因WOX2和WOX8中就已经共同表达,WOX8与这种极性分布和不对称分裂有关,受WRKY2激活而转录。显示的肌动蛋白在合子中受精后5~6小时和15小时后的分布。......
2023-11-20

在胚发生阶段,根的原分生组织已经形成一定结构,萌发时分生组织开始分裂,胚根沿轴向伸展,分生组织的细胞数目增加、繁殖速度增加。到成熟根阶段,这部分组织发育成原分生组织。这些原分生细胞的衍生细胞发育形成中心区细胞和轴柱根冠细胞。植物的根系结构在不同的发育阶段和环境中形态结构不同。维管束又由中柱鞘、木质部、形成层和韧皮部组成,不同的植物在不同的发育阶段和环境中其根中各种组织的分布和结构有不同。......
2023-11-20
相关推荐