根毛的发生分为起始和生长两个主要时期。ROP蛋白定位于起始位点,并在根毛生长过程中一直位于生长顶端,直到生长停止。根毛起始位点细胞壁pH值降到4~5,激活伸展素蛋白,疏松细胞壁,形成膨胀和突出生长,根毛其余区域有目标的分泌生长。永久性GTP结合态的ROP突变造成根毛的气球形态。钙离子浓度梯度、pH值、ROS在根毛的周期性变化可能反映了这种调控作用。......
2023-11-20
1.心皮特性和数目的决定
心皮构成雌蕊,其特征是胚珠、柱头组织、花柱组织、瓣细胞、隔膜原基。心皮特性和数目是在花分生组织阶段开始确定。心皮的分化由以AGAMOUS为主的C类基因与其他基因的相互作用控制形成。但是心皮在特定条件下也可以不依赖AG发育,发育成不完全心皮,YABBY类CRABSCLAW(CRC)基因在心皮特性上也起着一定作用。
心皮相当于侧生器官,其数目由AG和WUS的分布范围决定,决定干细胞分化的WUS可以通过促进AG的表达影响心皮数目,在花分生组织过量表达WUS与过量表达AG时都表现出多心皮现象(Ikeda et al.,2009)。
影响WUS分布范围的CLVATA信号途径的组成成分也同样决定心皮数目。拟南芥野生型果实具有2个心皮(图7.9A),clv1突变的果实具有4个心皮(图7.9B),clv2-3突变的果实具有5个心皮(图7.9C),雌蕊柄延长。clv3-2突变平均每朵花有6.7个心皮。CLV1类受体激酶(BARELY ANY MERISTEM)bam1、bam2与clv3-2的三突变心皮数减少为4.3,clv2-1 bam1-1 bam2-1三突变心皮数为3.8,bam1-1 bam2-1与clv1-4、clv1-7、clv1-11三突变的心皮数分别为8.97、7.44、8.65(DeYoung and Clark,2008)。
SHOOT MERISTEMLESS(STM)编码建立分生组织需要的同源蛋白。stm杂合体植物可以部分抑制clv3增加的心皮数目,它们通过细胞分裂和扩张作用协同进行器官起始。POLTERGEIST(POL)也可抑制clv表型,使分生组织大小恢复正常,减少额外心皮数目。心皮数目也可以被superman(sup)突变体分配到心皮发育的不同改变花分生组织的比例而改变。Superman突变体中,雄蕊数目的增加以心皮的减少为代价(Roeder and Yanofskya,2006)。
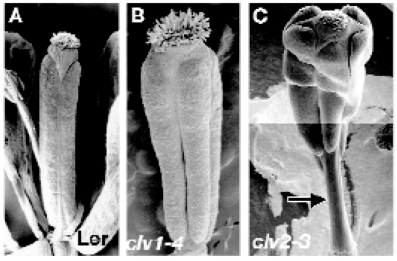
图7.9 CLAVATA基因控制心皮数目(Roeder and Yanofskya,2006,ⓒASPB)
ap2-2 ag-1双突变体第一轮心皮仍保持多心皮专一组织。spt-2 ap2-2 pi-1 ag-1四突变体外轮心皮的心皮边缘有属于心皮结构的胚珠突起,但完全缺乏柱头和花柱细胞。crc-1 spt-2 ap2-2 pi-1 ag-1突变体花中CRC的移去消去了外轮器官多数其余心皮特性。
STM/WUS/CLV在心皮数目的决定中所起的作用进一步说明三者的协调作用在分生组织的分布和特性决定中起重要作用,也体现了在植物形态建成中的一般性规律。
2.ERECTA(ER)控制果实的形状
ERECTA(ER)编码富含亮氨酸重复序列受体蛋白激酶。内质网蛋白和两个疏水区域形成信号肽和一个跨膜区域。C末端细胞内区域编码假定的丝氨酸/苏氨酸激酶催化区域。细胞外区域含有20个富含亮氨酸重复序列(LRRs)。MAPK激酶系列磷酸化途径在ER下游起信号传导作用,其中包括MEKK1-MKK2-MPK4和MKK1-MPK4。几个WRKY家族的转录因子是MAPK作用的目标(Terpstra et al.,2010)。两个ER类似基因ERECTA-LIKE(ERL)基因ERL1、ERL2与ER具有相似的结构和重叠的功能,它们共同作用,在植物形态上起重要作用。整个ER家族基因的突变导致严重矮化、心皮延长受到抑制(Shpak et al.,2004)。ER在细胞分裂素对顶端分生组织的调控中起着缓冲作用,整个ER家族基因突变的幼苗茎顶端形态和CLV3对细胞分裂素的处理反应剧烈(Uchida et al.,2013)。突变体在干细胞数目增多的同时,伴随着叶数目的减少,而clv3突变体干细胞数目增多的同时,叶数目并不减少,说明ER在茎顶端分生组织细胞到侧生原基形成的分配中起作用(Uchida et al.,2012)。而ER家族的突变体中,PIN1、生长素反应部位、ARF5、IAA1、IAA19在茎顶端分生组织的分布都发生改变,且ER对PIN1在茎顶端分生组织中未来叶原基主脉部位分布和未来叶维管束的形成都是必需的(Chen et al.,2013)。ER还参与AS1AS2复合体对叶近轴特性的作用(Xu et al.,2003)。
ER在茎顶端分生组织强表达,在花发育的1~3阶段在整个花分生组织表达。在阶段4~6,表达限制在雄蕊和雌蕊。阶段6 ER在整个雌蕊表达(图7.10 D)。到阶段8,表达在整个花中减少。很可能ER作为细胞外信号受体促进细胞分裂和扩张,因此控制果实形状。野生型Columbia(Col)果实没有er突变。果实长而狭窄,Landsberg erecta(Ler)果实带有er突变,果实短而宽。(图7.10A)。Col果实顶端瓣收缩(图7.10B),Ler果实顶端瓣变钝(图7.10 C)(Roeder and Yanofskya,2006)。
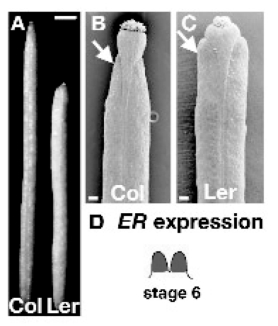
图7.10 ERECTA控制心皮的形状(Roeder and Yanofskya,2006,ⓒASPB)
3.决定种子散发的瓣边缘特性基因
SHATTERPROOF(SHP)决定瓣边缘促进特性,SHP1和SHP2基因对瓣边缘的木质化层和分离层的分化具有重叠的决定作用。shp1 shp2双突变体不能开裂。原因是瓣边缘没有木质化层,所以不能开裂(图7.11F)(Roeder and Yanofskya,2006)。
SHATTERPROOF基因编码两个关系很近的MADS家族转录因子,87%相同的SHP蛋白功能性重叠,没有一个单突变有异常表型。SHP基因有几乎相同的表达类型。SHP在胚珠发育过程中与SEEDSTICK(STK)MADS-box基因的作用相重叠。AG可以在体外结合到SHP2启动子一个位点,表明AG心皮特性的决定是通过促进SHP基因表达(Roeder and Yanofskya,2006)。
在发育过程中,SHP表达分布发生变化。发育早期,SHP基因广泛表达在雌蕊中。阶段10,SHP的表达延伸到瓣边缘、胎座框、隔膜和发育中胚珠,弱表达也延伸到瓣边缘(图7.12A)。阶段12,SHP表达专一地限制在瓣边缘(图7.12B),也在发育中胚珠继续表达。阶段17 SHP继续在瓣边缘表达,但不在胚珠表达(图7.12C)(Roeder.and.Yanofskya,2006)。
番茄中SHP的类似基因是Tomato AGAMOUS-LIKE1(TAGL1),其分子生物学功能与拟南芥的SHP不同,转入拟南芥后不能弥补SHP功能的缺失。但TAGL1在番茄中同样决定果实的扩张和成熟,这种特性是与促进果实的发育和种子繁殖的最终目标是一致的,说明在进化中SHP类基因的功能与种子散发是一致的,随着物种进化其功能也发生变化(Vrebalov et al.,2009)。
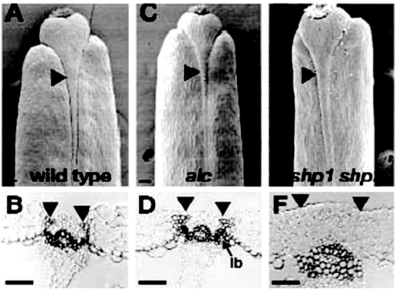
图7.11 SHP决定瓣边缘木质化层的形成(Roeder and Yanofskya,2006,ⓒASPB)
(A)阶段17野生型果实顶端SEM,箭头为瓣边缘。(B)用木质素专一的间苯三酚(phloroglucinol)染色的胎座框区域的横切片。箭头示瓣边缘的木质化层。(E)shp1 shp2果实顶端瓣边缘仍很明显,而基部瓣边缘不明显。(F)在shp1 shp2果实基部瓣边缘木质化层不能分化。在果实顶部附近有木质化层细胞。
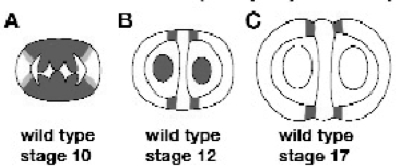
图7.12 SHP在发育过程中表达模式的变化(Roeder and Yanofskya,2006,ⓒASPB)
ALCATRAZ(ALC)基因编码basic helix loop helix(bHLH)转录因子,决定瓣边缘分离层细胞的特性,防止分离层细胞的木质化(图7.13)。alc突变体木质化桥(lb)将胎座框的维管系统和木质化层连接起来,分离层的发育受到影响,en b层阻止果实的开裂(图7.11D)。alc突变体不开裂表型比shp1 shp2程度轻些(Roeder and Yanofskya,2006)。
ALC在野生型果实中表达也随发育时期变化,阶段14,ALC在瓣和瓣边缘表达(图7.13A)。阶段16,ALC专一地限制在瓣边缘表达(图6.13B)。阶段17,ALC在胎座框的外围细胞中也在瓣边缘表达(图7.13 C)。阶段18,ALC在分离层的几层内层细胞表达(图7.13 D)(Roeder and Yanofskya,2006)。
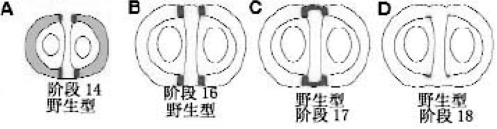
图7.13 ALC在野生型果实中的表达类型(Roeder and Yanofskya,2006,ⓒASPB)
INDEHISCENT(IND)编码一个bHLH转录因子。多数bHLH蛋白碱性区域含有一个关键的谷氨酰胺,与DNA结合位点CA碱基接触,但在野生型IND蛋白中这个谷氨酰胺被丙氨酸替代。酵母中IND可以与ALC作用,这两个蛋白可能通过异质二聚体化特化分离层。IND在瓣边缘专一化中决定木质化层的形成。野生型果实中IND在阶段12到阶段17在瓣边缘区域表达,与同一时期SHP在瓣边缘区域表达分布一致(图7.14)(Roeder and Yanofskya,2006)。

图7.14 IND在发育中果实中的表达分布(Roeder and Yanofskya,2006,ⓒASPB)
ind突变整个果实木质化层不能分化(图7.15)。ind alc双突变果实一样缺乏木质化层。在ind单突变果实中瓣边缘在顶端和基部不明显。ind shp1 shp2三突变果实瓣边缘轮廓进一步减少,瓣边缘木质化层缺乏,且离胎座框后退几个细胞,说明SHP1和SHP2在瓣边缘发育中也起作用。在ind alc shp1 shp2四突变体中瓣边缘发育进一步减少,en b层后退几个细胞到瓣,说明ALC在瓣边缘发育中的一些作用独立于IND和SHP(Roeder and Yanofskya,2006)。
不开裂Canola植物canola(Brassica napus and Brassica rapa)有两个IND类似物,BIND1和BIND2,导致canola的不开裂。说明瓣边缘特性的决定机制在植物中具有相似性(Roeder and Yanofskya,2006)。
除了上述决定瓣边缘木质化层的IND和决定分离层的ALC以及与两者都有关的SHP之外,决定瓣壁特性的FRUITFUL(FUL)和决定脊特性的REPLUMLESS(RPL)基因分别在瓣壁和脊侧限制瓣边缘特性的形成,确定瓣边缘特性的边界(Roeder and Yanofskya,2006)。FUL基因与AP1基因同属AP1或SQUA家族,AP1与花瓣形成有关,花瓣和心皮都是由叶进化而来,具有结构和功能的相关性(图7.16~图7.18)(Litt and Irish,2003)。
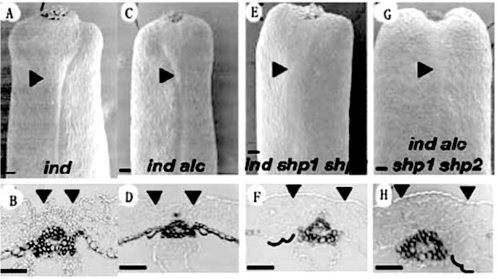
图7.15 ind alc shp1 shp2对瓣边缘特性的作用(Roeder and Yanofskya,2006,ⓒASPB)
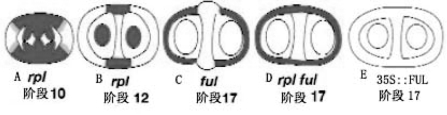
图7.16 RPL、FUL SHP对ALC基因表达的调控(Roeder and Yanofskya,2006,ⓒASPB)
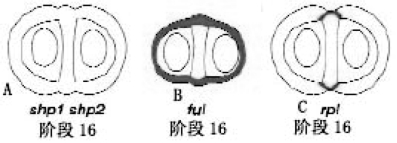
图7.17 RPL、FUL对SHP基因表达的调控(Roeder and Yanofskya,2006,ⓒASPB)
Roeder和Yanofskya提出了转录因子网络调控专一化瓣边缘特性的作用机制解释模型(图7.19)。SHP、IND和ALC共同形成一个非线形网络,特化瓣边缘形成。SHP正调控IND和ALC。IND和ALC可能通过形成异质二聚体决定分离层特性,而IND决定木质化层特性。瓣中SHP、IND、ALC都被FUL负调控,不能表达,从而把瓣边缘形成活性限制在瓣的边缘,同样,RPL在胎座框负调控SHP、IND和ALC,把瓣边缘形成活性限制在胎座框边缘。ind alc shp1shp2 ful四突变体中,在缺乏FUL活性时瓣发育多数方面都能进行,FUL不直接影响瓣发育多数方面。同此相似,shp1 shp2 rpl三突变体中胎座框发育不受RPL的直接影响。RPL和FUL主要功能是将瓣边缘的分化精确定位在瓣和胎座框之间的一条带,保证果实的适当打开(Roeder and Yanofskya,2006)。
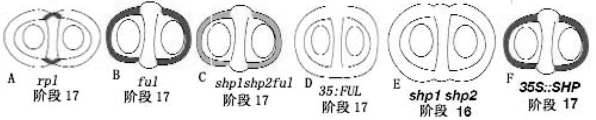
图7.18 RPL、FUL SHP对IND基因表达的调控(Roeder and Yanofskya,2006,ⓒASPB)
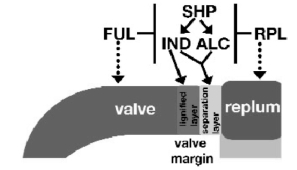
图7.19 转录因子网络调控特化瓣边缘特性模型(Roeder and Yanofskya,2006,ⓒASPB)
4.决定瓣发育的基因
果实的瓣在种子发育时包被和保护种子。瓣由子房壁衍生,当果实延长时必须大幅度扩展,允许种子生长。当果实成熟时,瓣在瓣边缘分离,落离果实,释放种子。除了AG是决定瓣形成的一个基因外,FUL也是与瓣形成密切相关的基因。FUL是MADS box家族延伸成员,与APETALA1和CAULIFLOWER花分生组织特性基因密切相关,ap1calful三突变表现无花表型,具有重叠功能。FUL对瓣边缘特性基因SHP、ALC、IND进行负调控,ful突变体果实不能正确扩展和分化,很小,有的瓣裂开,有的花柱的异常延长,胎座框增大扭曲,瓣细胞小而圆,瓣中没有保卫细胞分化。ful突变体中SHP、ALC、IND三个基因受到的抑制被消除,可以在整个果实表达,导致木质化异常和细胞生长的异常,从而使果实的生长受到抑制(图7.20)。当逐个消除ful突变体中SHP、ALC、IND的作用时,它们单个基因在瓣中的作用被消除,果实生长被逐步恢复,进一步说明FUL在瓣中的主要作用是抑制SHP、ALC、IND的表达(图7.20)。在五基因突变体中,果荚特性得到了90%的恢复。这时的果荚表层突起,内表皮细胞没有充分增大,表明除了FUL将边缘特性基因限制在边缘表达外,果荚的分化对FUL还有需要或还有其他因子的作用(图7.20)。35S::FUL果实由于阻碍瓣边缘木质化层形成。胎座框区域外层细胞分化成瓣细胞。而包括维管束在内的胎座框内层细胞仍存在,整个果实周围被瓣细胞覆盖。果荚不开裂(Roeder and Yanofskya,2006)。
表皮是决定果实形态的重要因素,阶段17野生型(Ler)瓣表皮细胞细胞延长,间隔分布有保卫细胞(箭头)(图7.21 A)。ful突变体瓣细胞延长受到抑制,瓣细胞小而圆,细胞分裂活性增加,瓣中没有保卫细胞分化,保卫细胞复合体缺乏,内部中果皮木质化异常高(图7.21 B)。消除SHP功能使表皮瓣细胞出现几个保卫细胞(图7.21 C)。消除ALC功能部分恢复瓣细胞的延长,但不形成保卫细胞(图7.21 D)。细胞壁木质化后,限制细胞延长,从而限制果实伸长。因此异常部位的木质化,限制果实的生长。
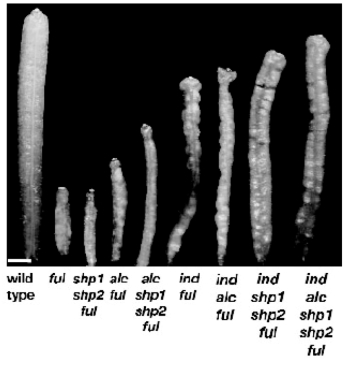
图7.20 SHP、ALC、IND、FUL基因对果实发育的作用(Roeder and Yanofskya,2006,ⓒASPB)
SHP和ALC功能都消除使瓣细胞延长恢复更多一些(图7.21E)。移去IND作用可以在很大程度上恢复ful果实中瓣细胞的延长和保卫细胞的形成(图7.21F)。IND ALC两个基因都失活与ind单基因突变相似(图7.21 FG),进一步证明IND与ALC在调控上的线性关系。如SHP、ALC、IND作用全部去除,表皮瓣细胞与野生型瓣细胞相似(图7.21 I)。瓣细胞分化在ful突变体中通过移去瓣边缘特性恢复。可见在果实表皮形态建成上FUL、SHP、ALC、IND基因的相互作用(Roeder and Yanofskya,2006)。
果皮内木质化层的正确分布是果实正常发育和开裂的另一个重要因素。FUL、SHP、ALC、IND基因的相互作用在其中起着重要作用。
内果皮en b是果荚内第二内层细胞,在阶段17中间木质化而具有刚性。En b是参与开裂的三层细胞之一,与果荚边缘的分离层和木质化层一起进行开裂活动。如果实成熟,外果皮干化收缩,刚性的En b张开,使心皮脱落(Roeder.and.Yanofskya,2006)。(www.chuimin.cn)
野生型果实瓣边缘(lm)木质化层和内果皮en b(lv)层木质化,但中果皮细胞(m)没有木质化(图7.22A)。决定瓣边缘木质化的基因SHP、ALC、IND的消除使en b层木质化从胎座框缩回几个细胞(图7.22B)。FUL、SHP、ALC、IND功能全部消除,en b层不能木质化(图7.22C)。消除FUL,失去对决定木质化基因SHP、ALC、IND的抑制,中果皮异常木质化(图7.22D)。过量表达促进木质化的基因SHP,果实中果皮也异常木质化(图7.22E)。IND活性从ful突变体瓣的移去恢复木质化类型,只有en b层木质化,中果皮没有木质化(图7.22F)。FUL在果皮中除了胎座框以外的地方控制基因表达(图7.22G),如消除了SHP、ALC、IND的作用,FUL在瓣的表达区域从胎座框缩回几个细胞(图7.22H),FUL表达区域的收缩与图7.22B中en b细胞层木质化的收缩相关,这种收缩可能是有脊因子迫使FUL活性区域收缩,说明FUL、IND、ALC、SHP都对en b层木质化有贡献(Roeder and Yanofskya,2006)。
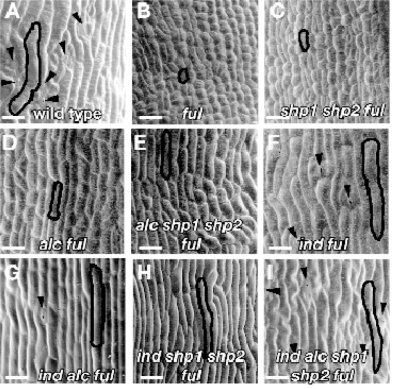
图7.21 SHP、ALC、IND、FUL基因对果实表皮发育的作用(Roeder and Yanofskya,2006,ⓒASPB)
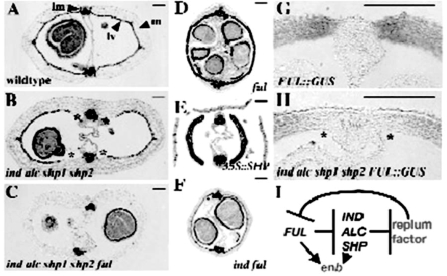
图7.22 FUL、IND、ALC和SHP对果皮木质化的作用(Roeder and Yanofskya,2006,ⓒASPB)
用木质素专一的间苯三酚(phloroglucinol)染色,横线100 μm
Roeder和Yanofskya提出了en b层木质化的模型(图7.22 I)。IND、ALC、SHP负调控假设的胎座框因子,它反过来负调控FUL。FUL、IND、ALC、SHP都促进en b层木质化特性。
其他基因如AG参与了en b层的特化,ag ap2双突变体没有en b层的分化。
5.决定果脊发育的基因
果脊是开裂后雌蕊同果实保持连接的部位,位于雌蕊中部,每个果脊包含一层外层细胞和中心的维管束结构,果脊同隔膜(septum)连接,将果荚隔为两室。一些基因直接控制果脊的发育。
REPLUMLESS(RPL)编码BELL1家族的同源盒蛋白,与KNOX家族的基因在同源盒区域相似,但没有KNOX家族上游的MEINOX、ELK、GSE区域。特定BELL家族蛋白能与特定KNOX家族蛋白结合,起功能调控作用。因为在节间的延长功能和分生组织中的功能,又有PENNYWISE(PNY)、BELLRINGER(BLR)和VAAMANA(VAN)的名称。其也在胚珠、茎、叶、根、茎端分生组织中表达。RPL位于核中,和KNOX家族的基因STM、KNAT1、KNAT2和KNAT6相互作用,限制KNAT2和KNAT6的表达,knat6的突变使rpl果脊的表型恢复正常。但与KNAT3、KNAT4、KNAT5无作用。RPL也结合到AG的调控元件,负调控AG的表达。RPL基因将瓣边缘的发育限制在脊的边缘。rpl突变体果脊外层细胞失去果脊特性,具有果荚边缘细胞木质化的特性。其他部位不变(图7.23)(Roeder and Yanofskya,2006;Ragni et al.,2008;Byrne et al.,2003)。
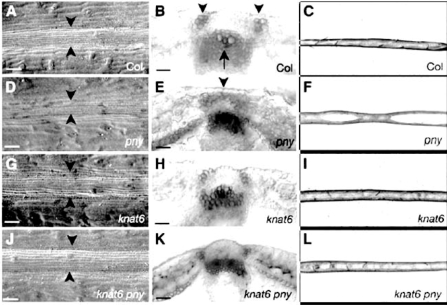
图7.23 RPL基因决定果脊特性(Ragni et al.,2008,ⓒASPB)
B、E、H、K中深色为木质化细胞(严海燕修饰)
RPL::RPL-GUS在阶段12(BC)和阶段16(A)雌蕊的胎座框强表达(图7.24)。移去SHP的功能使果脊部位恢复正常,进一步说明RPL的功能不是必需,而是抑制其他基因的表达(图7.25)。
RPL在果脊中的功能与FUL在果荚中的功能平行,SHP基因决定果荚边缘的特性,开始广泛表达,以后逐渐限于由RPL和FUL控制的果脊和果荚之间的狭窄的带中,保证了边缘带的分化,使果荚开裂能够进行。果荚和果脊中rpl和ful突变能够恢复相应组织的特性,说明这两个基因并不直接决定相应组织的特性,不是相应组织形成的必需基因,而是通过对决定这两个组织边缘带分化特性的SHP基因的负调控,决定边缘带的位置,其上游基因包括了AG和WUS(Roeder and Yanofskya,2006)。
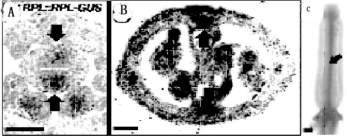
图7.24 RPL基因的表达分布(Roeder and Yanofskya,2006,ⓒASPB)

图7.25 RPL基因对果脊形成的作用不是必需的(Roeder and Yanofskya,2006,ⓒASPB)
6.果脊的分生组织功能
果脊是由心皮边缘融合而成,是花粉管进入子房生长的基质和通道,是未来胚胎和种子发育的基础,承载着繁殖发育的功能。胎座框和隔膜是果脊发育形成的重要组织。果脊组织胚胎发育的基础胎座以及后来胚胎发育的关键结构胚珠特定组织区域一直具有分生组织特性,包括干细胞和其周围分生区域。在珠心区域表达分布的WUS影响决定珠被发生的基因ANT的空间分布,其信号传导体系控制胚珠发育(Groβ-Hardt et al.,2002)。
CUP-SHAPED COTYLEDONS(CUC)在胎座框和隔膜的形成中起着将器官与相邻器官和分生组织分离的作用。cuc1 cuc2双突变体子叶融合在一起,茎分生组织不形成;隔膜不能融合,上半部外果脊组织缺乏。雌蕊发育早期,中部脊组织存在,但后期不能扩张,隔膜不能融合。50%的cuc-1/+cuc2/cuc2隔膜融合不完全。所以CUC1和CUC2的作用是重叠的。CUC1和CUC2编码两个相关的植物专一性的NAC domain家族的转录因子,在器官之间的边界表达。在隔膜原基生长过程中,在内脊和隔膜中部表达,直到阶段11,12,在果脊中不表达(Roeder and Yanofskya.,2006)。
7.对果实整体构型的基因网络调控
在器官极性建成的建立过程中,决定侧生器官极性的Filamentous Flower(FIL)和YABBY3(YAB3),以及促进侧生器官生长的JAGGED(JAG)通过促进FUL和SHP的表达影响瓣和瓣边缘特性,RPL除了抑制瓣边缘基因SHP、IND、ALC在胎座框(脊)的表达外,也抑制FIL、YAB3、JAG在胎座框(脊)的表达,从而将瓣和瓣边缘特性限制在胎座框以外(Dinneny et al.,2005)。FIL和YAB3单突变不影响开裂表型,双突变果实不开裂,顶部瓣边缘区域缺乏木质化细胞,基部瓣边缘区域过度木质化,同时瓣区域enb失去木质化特性(Dinneny et al.,2005)。在果实发育中,四种YAB家族蛋白CRC、INO、FIL、YAB3既有不同的作用,也具有共同的作用(Meister et al.,2005)。
8.柱头、花柱、隔膜和转移通道的融合和形成
拟南芥有两次融合事件,一是发生在中间组织的心皮融合,包括果脊和隔膜原基。第二次融合是两个中脊融合形成隔膜,及花柱形成实体圆柱。融合后花柱中心和隔膜中间分化出运输管道,LEUNIG(LUG)、TOUSLED(TSL)、STYLISH、SPATULA、CRABS CLAW、AINTEGUMENTA(ANT)参与了柱头、花柱、隔膜、运输管道的形成和雌蕊的融合,其中有基因的相互作用(Roeder and Yanofskya,2006)。
lug突变在天生的心皮尖部融合和后生的隔膜融合中都是缺陷的。LUG编码一个转录共抑制因子,类似于酵母的TUP1和果蝇的Groucho,带有两个富含谷氨酰胺的区域和7个WD重复,不含DNA结合区域,但位于细胞核,与果蝇和小鼠中LIM结合1/CHIP类似蛋白SRUSS(SEU)共同作用,可能通过组蛋白去乙酰基酶HDA19、介导组分MED14(SWP)、CDK8(HEN3),抑制RNA聚合酶Ⅱ的功能,而负调节AG的表达(Sridhar et al.,2004;Gonzalez et al.,2007)。LUG在心皮果荚中表达很弱,但在维管组织、发育中胎座和胚珠中表达。在花的前两轮,lug突变体顶端有四个未融合的突出。两个是中间的花柱和位于顶部柱头上的突起,另两个突起是果荚的两个突起,顶端缺陷在早期(时期7)探测到。lug的隔膜向外生长但不融合(图7.26)(Roeder and Yanofskya,2006)。
AINTEGUMENTA(ANT)促进新形成的器官原基的细胞繁殖。ant突变类似于弱的lug突变。lug ant双突变完全不融合,缺乏中间组织,有两个羊角状的果荚,胚珠、胎座、隔膜、果脊完全缺乏,包括侧生维管组织和果荚表皮组织。果荚不受影响,发育正常(图7.26)。说明lug ant共同影响中间组织的形成。由于lug对其他花器官的同源影响,内侧第一轮花萼也被转变成角形未融合心皮(Roeder and Yanofskya,2006;Liu et al.,2000)。
TOUSLED(TSL)基因编码核丝氨酸苏氨酸蛋白激酶,影响雌蕊顶端组织发育。TSL基因在果实发育阶段11仅在花柱和瓣的上半部表达,到阶段13,表达仅限于花柱(Roe et al.,1997;Roede and Yanofskya,2006)(图7.27H、I)。tsl突变顶端组织减少,不能融合。tsl顶端分生组织分化减少,花柱和隔膜不能融合,柱头突起减小成为心皮边缘多变的碎片,柱头突起和花柱内细胞数目都减少,心皮数目一到四个,只有花柱碎片和柱头分化(Roe et al.,1997;Roede and Yanofskya,2006)(图7.27)。TSL激酶活性在G2/M相和G1相升高,tsl突变引起细胞周期中TSL激酶活性类型异常,有丝分裂周期蛋白CYCB1;1表达水平升高,表明TSL抑制CYCB1;1的表达。TSL还参与核小体组装蛋白ASF1、组蛋白H3、SANT/MYB蛋白TKI1磷酸化过程,揭示TSL在染色质代谢过程中的作用,可能通过染色质修饰调控基因表达(Ehsan et al.,2004)。

图7.26 LEUNIG参与心皮的融合
(A)lug果实示柱头(s)上瓣的角样突起(h)。(B)未融合的lug雌蕊顶端近观。有两个内侧柱头表面(s)和两个稍后从瓣突出的角型结构(h)。(C)lug ant双突变示两个完全未融合的第四轮角型心皮(Roeder and Yanofskya.,2006,ⓒASPB)
tousled leunig双突变顶部组织减少。tsl和lug在雌蕊数目和减少和融合性降低方面的一致性说明它们可能在同一途径中作用。双突变表型加重,表明它们的作用可能重叠(Roede and Yanofskya,2006)(图7.28)。
PERIANTHIA(PAN)基因编码一个bZIP转录因子,在野生型拟南芥的顶端分生组织、花分生组织、每一轮花器官原基、胚珠原基表达(Chuang.et al.,1999)。perianthia突变花器官数目和花型都改变,雌蕊顶部融合延迟(Running and Meyerowitz,1996)。pan突变对雌蕊发育影响较小。tousled perianthia双突变形成未融合的雌蕊(Roede and Yanofskya,2006)。
STY1和STY2在发育雌蕊顶端表达,在那里形成花柱和柱头,决定柱头和花柱的发育。STY1和STY2编码C3HC3H锌指蛋白,与RING指相似,参与蛋白和蛋白之间的作用,也具有核定位信号和IGGH区域,属于拟南芥一个10基因家族,包括SHORT INTERNODES(SHI)、LATERAL ROOT PRIMORDIUM1(LPR1)。sty1单突变影响较小,sty2单突变对雌蕊没有影响。双突变中花柱突起朝周围边缘生长,柱头突起朝向各种方向;雌蕊中隔膜顶端减小或不存在,花柱中木质部减少。STY1或STY2的过量表达引起果荚花柱细胞的异常分化。STY1过量表达,雌蕊形成异常表皮脊,在其附近形成维管组织木质部扇。异常花柱阻止果荚开裂,果实打开(图7.29)(Roeder and Yanofskya,2006)。最近研究表明,STY1作为转录因子调控生长素合成途径中关键基因YUC4的转录表达,从而影响生长素水平和组织的生长(Eklund et al.,2010)。
SPATULA(SPT)编码一个碱性bHLH(helix-loop-helix)转录因子,其表达与发育时期和作用部位相一致,从阶段6到阶段11传输管道发育的阶段在相应区域表达(图7.30),是传输管道发育必需的基因。阶段6雌蕊原基呈球形细胞团。阶段8内部中间区域中脊生长形成隔膜。雌蕊顶部柱头和花柱发育。阶段11形成隔膜,包括发育中传输管道、胚珠原基。阶段13 SPT在除了外果皮细胞以外瓣和阶段17的瓣边界表达。spt突变体中没有传输导管,中间组织异常,隔膜顶部形成传输导管的细胞缺乏。因此花粉管生长受阻,少于1/4的胚珠受精。花柱、柱头、隔膜生长减少,心皮顶端不融合。开花期spt花柱狭窄,柱头顶端突起少。果实生长时由于侧生扩展果实更平坦,成为压舌板状(Roeder and Yanofskya,2006)。SPT的表达受生长素反应因子ETTIN的负调控,不受CRC和AG的调控(Alvarez and Smyth,1999;Heisler et al.,2001),
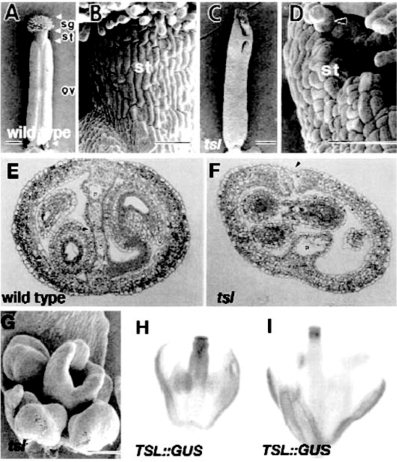
图7.27 TOUSLED基因的作用(Roeder and Yanofskya,2006,ⓒASPB)。
(A)阶段13野生型雌蕊。柱头区域(sg),花柱(st),子房(ov)。(B)阶段13野生型柱头(st)近观。(C)阶段13tsl-1雌蕊顶端未融合,柱头突起数目减少。(D)阶段13tsl-1雌蕊顶部近观。远轴花柱细胞在顶端存在,也在雌蕊内部边缘存在。(E)野生型雌蕊横切面示隔膜融合。(F)tsl-1雌蕊横切面示隔膜不能融合。(G)阶段9 tsl-1雌蕊顶端已经不平。(H)阶段11 TSL::GUS报告基因在花柱和上部瓣表达。(I)阶段13 TSL::GUS基因表达限于花柱。

图7.28 tsl与lug及pan的相互作用(Roede and Yanofskya,2006,ⓒASPB)。
(A)未融合的具有四个突起的lug雌蕊顶端。两个中间(m),两个侧面(l)。(B)tsl lug双突变只有一个心皮。有两个突起,一个侧面和一个中间。(C)tsl lug双突变有两个心皮,在雌蕊基部融合,但未融合的角顶部没有柱头组织。(D)阶段13双心皮的pan雌蕊。(E)阶段10 tsl pan双突变显示具有胚珠原基的未融合的心皮(箭头)。(F)成熟tsl pan花有两个未融合的心皮(c)
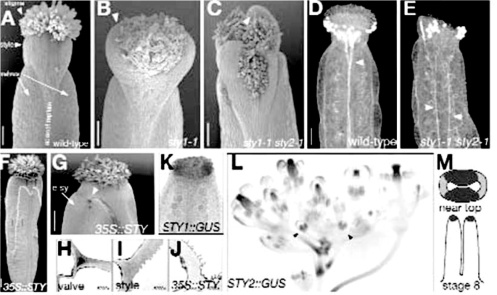
图7.29 STY决定花柱发育(Roeder and Yanofskya,2006,ⓒASPB)
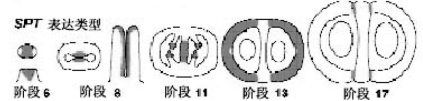
图7.30 SPT决定传输管道发育(Roede and Yanofskya,2006,ⓒASPB)
SPT也在spt突变体的花瓣、雄蕊、胚珠、种子附着位点、幼叶、托叶、茎成熟髓、侧生根冠表达,但未见异常。这表明可能有未知因子与SPT有重叠功能,或bHLH常形成异聚体,可能共同作用(Roeder and Yanofskya,2006)。
CRC编码具有一个锌指和一个helix-loop-helix的YABBY家族的转录因子。在雌蕊侧面表达,发育阶段7、8时在表皮和内部表达明显,阶段10时在脊部表达减少。在阶段12时在外表皮的表达已经检测不到(图7.31)。CRC(35S::CRC)的恒定表达形成实心雌蕊,在萼片边缘形成心皮样结构,表明CRC是心皮特化途径的控制因子。CRC基因突变阻止花柱和胚珠上部融合,简化的花柱每边向内弯曲,形成螃蟹爪样结构,蜜腺缺乏,果实更短更宽。胚珠偶尔从脊向外伸出,表明突变体缺乏离轴-近轴极性(Alvarez and Smyth,1999;Bowman and Smyth,1999;Roeder and Yanofskya,2006)。CRC的转录表达受BC类花决定基因以及SEP的共同控制,在蜜腺和心皮处表达。在A类突变背景下SHP1/2基因可促进CRC的表达(Lee et al.,2005a)。在被子植物中CRC类似基因的功能较为保守(Lee et al.,2005b;Fourquin et al.,2007)。

图7.31 CRC决定果实形状(Roeder and Yanofskya,2006,ⓒASPB)。雌蕊心皮侧面切片
spt crc双突变雌蕊几乎完全不融合,只有基部融合。边缘组织包括柱头突起、花柱、胚珠、隔膜减小,只有果荚正常。SPT的表达不受crc突变影响,而spt突变增加CRC的表达(Roeder and Yanofskya,2006)。
有关植物发育生物学的文章

根毛的发生分为起始和生长两个主要时期。ROP蛋白定位于起始位点,并在根毛生长过程中一直位于生长顶端,直到生长停止。根毛起始位点细胞壁pH值降到4~5,激活伸展素蛋白,疏松细胞壁,形成膨胀和突出生长,根毛其余区域有目标的分泌生长。永久性GTP结合态的ROP突变造成根毛的气球形态。钙离子浓度梯度、pH值、ROS在根毛的周期性变化可能反映了这种调控作用。......
2023-11-20

转录因子对基因表达的调控同样是十分重要的。这些转录因子之间发生复杂的相互作用。AG转录因子是在花分生组织中决定雄蕊和雌蕊特性的基因,从其表达开始到果实形成,一直表达,但其所受的调控和与其结合的因子在雄蕊和雌蕊是不同的,且随着果实形态的变化,表达的数量和位置发生变化,受到调控的因素及与其作用的各种因子在不同的时期和部位也发生变化,从而决定相应区域的分化结果。......
2023-11-20

表观遗传包括了DNA的甲基化与染色质修饰。表明MET1进行的DNA甲基化对发育的胚中生长素梯度的建立和保持是必需的。PIN1是生长素流出载体,参与生长素梯度的建立,在met1突变胚中也均匀分布,说明DNA甲基化也影响PIN1的表达。通过影响生长素分布和与组织分化有关基因的表达,基因组DNA甲基化控制胚极性的建立。PcG中的PRC2和PRC1在KNOX类基因表达调控方面起重要作用,如PRC2成员CLF对STM、PRC2成员FIE、PRC1成员TFL2/LHP1对STM、KNAT1、KNAT2的表达都有调控作用。......
2023-11-20

植物的花型除了上述基因控制外,还有其他一些基因在对称性和各花部的形状、大小等方面起作用。两侧花型是进化上较高级的花,背腹特性的形成也是由相应区域基因的特异表达所控制。②RAD基因抑制DIV基因在花分生组织背部的表达。相对于野生型,过量表达CYC基因的拟南芥花瓣细胞大小增加,花瓣大小增加。BOP基因的过量恒定表达在侧生器官边界区域上调LATERAL ORGAN BOUNDARIES和ASYMMETRIC LEAVES2的表达,而bop突变体中这些基因表达下调。......
2023-11-20

只有与静止中心接触的起始细胞受到影响,表明从静止中心短距离发射信号保持周围起始细胞的干细胞活性。生长素通过控制影响胚根发育的一系列关键基因起作用。突变体对生长素反应,但生长素反应元件DR5只在高浓度下反应,表明反应强度降低。与生长素运输有关的载体和蛋白对根的发育有影响。......
2023-11-20

在胚发生阶段,根的原分生组织已经形成一定结构,萌发时分生组织开始分裂,胚根沿轴向伸展,分生组织的细胞数目增加、繁殖速度增加。到成熟根阶段,这部分组织发育成原分生组织。这些原分生细胞的衍生细胞发育形成中心区细胞和轴柱根冠细胞。植物的根系结构在不同的发育阶段和环境中形态结构不同。维管束又由中柱鞘、木质部、形成层和韧皮部组成,不同的植物在不同的发育阶段和环境中其根中各种组织的分布和结构有不同。......
2023-11-20

表观遗传是通过染色质结构影响基因表达并可遗传,但不涉及DNA序列的现象。对组蛋白进行甲基化修饰的就有以果蝇为代表的Polycomb group和trithorax group复合物。果蝇中的PcG复合物有POLYCOMB REPRESSIVE COMPLEX 1、2,果蝇trxG复合物至少有三类,PcG对HOX的表达起抑制作用,而TrxG作用相反。PcG和trxG都含有SET区域,为甲基化酶活性区域。PRC1复合物在有些物种不存在,有些物种中其结构成分发生变化。EMF1、LHP1和RAWUL可能是植物中PRC1的组成成分。......
2023-11-20

植物的花粉成熟后,被释放出来,不同的植物通过不同的传粉机制,将花粉传播到雌蕊上。营养核用于为花粉的萌发和花粉管的生长或两核花粉中生殖核的进一步分裂提供营养。风媒花粉与以动物为媒介的花粉和柱头在结构上大不相同。花粉到达柱头后,与柱头发生相互识别和相互作用后萌发,花粉管进入柱头,并深入花柱,在花柱内受到雌蕊中各种因素和信号的导引,向胚珠生长,最后通过珠孔,在胚囊内释放两个精子。......
2023-11-20
相关推荐