通过花粉外壁后,花粉管需要穿过柱头进入花柱,有些柱头和花柱是一体,有些需要穿过柱头表面的表皮和突起外壁再进入花柱。在花粉粒对柱头附着的干柱头类型,突起决定花粉管进入花柱传输通道的位点。其他物种中,有化学信号提供花粉管进入花柱细胞外基质ECM的导向。移区突起也阻止相适配的花粉进入柱头。角质酶抑制剂减少花粉管进入柱头的机会。酶解进入柱头被精确调控,以防止病原或不适当的进入。......
2023-11-20
花粉落在柱头上,识别附着、水化、萌发、延伸,进入传输道(transmitting tract,TT)。花粉管在纵隔上出现隔膜(septum,S),长到胚珠柄(funiculus,f)并进入珠孔,使卵和中心细胞受精(Edlund et al.,2004)(图5.1)。
雌蕊作为花粉筛在不同的阶段使雌蕊上不亲和或不适宜的花粉停止发展,只允许特定的花粉进入雌蕊,帮助花粉萌发,并引导花粉管生长,完成双受精过程。花粉(花粉管)和雌蕊之间相互作用,共同完成受粉和双受精的整个过程。
同种的异花授粉花粉和柱头之间一般都是亲和的,而由于多数植物的雌雄同花特性使自花授粉成为可能,为了排除自交造成的品种退化的可能性,这些植物进化了自交不亲和(Self incompatible,SI)的机制。自交不亲和由一个单一多态的基因位点决定,花粉和雌蕊分别控制花粉和雌蕊特性的S位点的重组决定了对花粉的拒绝。不同种之间的花粉和雌蕊之间通常是不亲和和不适宜的,但还是有亲和的种间杂交现象,说明了自交不亲和机理的多样性和复杂性(Hiscock and Allen,2008)。
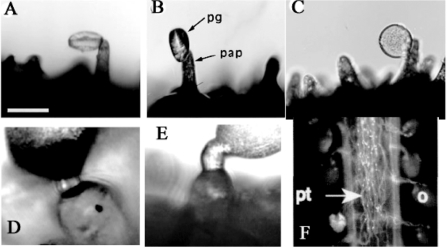
图5.1 花粉与柱头相互作用的几个阶段(Iwano et al.,2007;Lush et al.,1998;Hülskamp et al.,1995,ⓒASPB)
注:ABC为油菜花粉粘着吸水,DE为烟草花粉萌发和穿透,F为拟南芥花粉管生长。
1.识别附着
花粉和柱头的形状、结构的匹配是第一个识别的因素(图5.2),花粉的含水性和柱头的含水性也是一个重要特性。
花粉在柱头上的附着由花粉和柱头相互作用决定,其中包括了柱头分泌物、突出物结构和成分,及花粉外壁和外被结构和成分的相互作用。
用拟南芥和矮牵牛花粉同时对拟南芥柱头授粉,大量拟南芥花粉附着在柱头上,矮牵牛花粉很少附着。用不同进化关系物种的花粉施加在拟南芥柱头上,进化关系越远,花粉附着强度越低(图5.2)。
用拟南芥、Artemesia douglasiana、Cynodon dactylon、Poa pratensis、Quercus agrifolia花粉外壁碎片对拟南芥柱头授粉,然后用1%吐温20洗一小时后比较柱头上残留花粉外壁,结果显示,只有拟南芥花粉外壁碎片大量留在拟南芥柱头上,Artemesia douglasiana、Quercus agrifolia只有零星小点留在柱头上,其余全部从柱头上洗干净(Zink et al.,1999)。
花粉在干柱头上的附着是由花粉特性决定的。在湿柱头上附着受分泌物的帮助,分泌物在百合中是水性的,在烟草和矮牵牛中是脂溶性的。
拟南芥花粉的迅速附着由花粉外壁(exine)的生物物理和生物化学因素决定,由于时间短暂,迅速附着不可能是蛋白-蛋白之间的作用(Edlund et al.,2004)。之后,花粉外被的脂和蛋白复合物移动到花粉-柱头接触面上形成“脚”。柱头表面蛋白也对附着有贡献。这阶段进行蛋白-蛋白之间的相互作用。包括花粉外被蛋白和油菜S位点相关蛋白(Slocus-related protein,SLR1)之间高度选择的相互作用(图5.3)(Edlund et al.,2004)。
图5.3是花粉粒(P)和一个柱头突起(S)的透射电镜图,图中显示了花粉外被、内壁(intine)、外壁(exine)、柱头细胞壁、柱头角质层。富含脂类物质的脚在两者表面集聚。这里覆盖柱头角质的表层不明显(Edlund et al.,2004)。

图5.2 拟南芥的柱头对花粉的选择性和影响因素(Zink et al.,1999,adapted with permission by Development)
(A)拟南芥花粉附着
(B)矮牵牛花粉附着
(C)花粉应用在拟南芥柱头上n10分析。一般单子叶花粉附着力低于双子叶花粉。
油菜SLR1和S位点糖蛋白(S-locus glycoprotein,SLG)是柱头表达的S位点相关的糖蛋白,它们在遗传位点上不连锁,但序列高度相似,和花粉外被蛋白相互作用。作用之前,花粉外被基质和柱头表面基质充分混合,SLR1和slr1花粉在柱头的附着强度相同。SLR1和花粉外被蛋白的结合,加强了细胞之间的粘着力。两种蛋白的抗体都能减少花粉附着。每种蛋白都分别与花粉外被中的特定蛋白结合。SLR1与SLR1-BP(Binding protein)结合,SLG与PCP-A1(Pollen coat proteins)结合,通过花粉蛋白与柱头蛋白的这种特异化学结合和非特异的物理融合,增强花粉到柱头的附着。花粉管在花粉粒中形成,穿过“脚”到柱头表面,将花粉系到柱头上。当花粉不相配时,花粉管的进一步生长受到阻止。另一种干柱头植物白薯Ipomoea trifida也有相似的SI决定机制。自交不亲和花粉停止在柱头上(Edlund et al.,2004;Hiscock and Allen,2008)。
没有柱头分泌物的情况下,花粉外被对附着起很大作用,分泌物从花粉外被流出到柱头上,在柱头和花粉之间形成“脚”,起粘着作用。拟南芥无花粉外被的突变体eceriferum(cer)花粉在柱头的黏着受到影响。纯化的花粉外壁碎片可以附着在柱头上(Zink.et al.,1999)。花粉外被和柱头分泌物中都有脂酶,分泌物相互融合,帮助花粉管进入柱头(Zink.et al.,1999;Edlund et al.,2004;Hiscock and Allen,2008)。
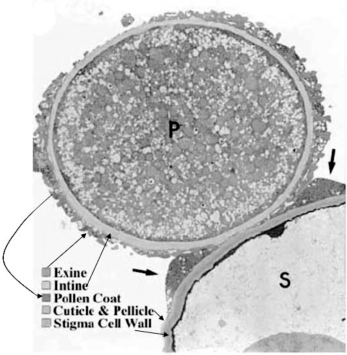
图5.3 花粉在柱头上附着脚的形成(Edlund et al.,2004,ⒸCASPB)
2.花粉的水化
十字花科植物在干柱头上的水化需要与突起接触,在花粉外被的帮助下从外壁流到两者接触区域。拟南芥、油菜(Brassicaceae)、禾本科草、罂粟的柱头都是干柱头,自交不亲和类型油菜是孢子体型,禾本科草、罂粟是配子体型。
柱头表皮由角质层覆盖,水和大分子物质可通过,可防止病原入侵,对花粉管穿透形成障碍。
拟南芥花粉外被含有与一小套蛋白一起的长链或短链脂类分子,包括6个脂肪酶和富含甘氨酸和一个脂类结合区域的油脂蛋白。拟南芥花粉外被长链脂类分子合成的突变影响水化,加入三乙酰甘油可恢复水化。油菜花粉外被结构与此相似。油菜油脂或外被结构的破坏可延迟或阻止花粉水化。应用外源脂类可以绕过花粉水化的控制(Edlund et al.,2004)。Hiscock和Allen认为,花粉外被脂类在水化过程中的作用可能是在花粉柱头连接介质中建立一个水势梯度,指导花粉管生长(2008)。
在脂类提供水吸收通道的同时,蛋白质可能起调节作用。油菜水化过程依赖连续的蛋白质合成。拟南芥和油菜花粉外被都有富含甘氨酸的油脂蛋白(Glycine-rich olesin-domain protein,GRP),已经证明拟南芥花粉外被中的GRP17是水化必需的。拟南芥GRP和一组花粉外被脂酶,具有种和品种间变异性,可能在种和亚种间花粉专一性识别中起作用(Hiscock and Allen,2008)。拟南芥特别是花粉外被上脂和油脂蛋白对水化是必需的(Edlund et al.,2004),柱头表面角质层上有很薄的膜样蛋白层突起,对相容花粉的进入是必需的,去污剂或蛋白酶都能阻止花粉管进入柱头。
花粉外被中脂类基质在自交不亲和中也起作用。编码拟南芥花粉外被长链脂类分子合成的酮酯酰辅酶A合成酶基因FIDDLEHEAD的突变影响花粉的发育。相容性花粉可以帮助非相容性花粉在柱头上水化,但这种作用很有限(Hiscock and Allen,2008)。
油脂蛋白是双亲性蛋白,在种子中分布在油脂体表面,控制油脂体的大小。严海燕假设,花粉和柱头间的油脂蛋白也具有双亲性,它们通过与脂类的结合形成水和油两种界面,大量脂类通过脂酶的修饰,与油脂蛋白相结合,形成以油脂为背景的连接花粉和柱头的水通道。而这种油脂蛋白和花粉外被脂酶,由于具有种和品种间变异,很可能通过亲和性的识别限制不亲和花粉和柱头间水通道的形成,在水化一步进行自交不亲和的限制。(www.chuimin.cn)
花粉降落在湿柱头时水迅速围绕花粉粒聚集,花粉通过与柱头接触面的“脚”或干柱头突起从柱头吸收水分、营养和其他小分子。柱头上水通道分子的表达提供了从柱头迅速释放水到花粉的可调控通道。柱头表皮可能对水可渗透。花粉的水化受到时间空间上的调控。不适当的水化可造成灾难性的结果。干柱头植物中花粉水化调控可作为不亲和花粉授粉的障碍(Edlund et al.,2004)。
湿柱头分泌有饱和和不饱和三酰甘油,或主要是可溶性碳水化合物,大量蛋白质,分泌活跃期表面角质层破坏,维管活性增强。柱头分泌活动是花粉捕捉和附着的重要手段,同时也能使病原菌陷于其中,起着防卫作用,柱头分泌高水平活性氧可能与此有关(Hiscock and Allen,2008)。
烟草是湿柱头。烟草花粉外被上没有油脂样蛋白。这种湿柱头的水化由柱头因子决定(Bots and Mariani,2004)。
烟草花粉浸没在纯化的脂或柱头分泌物中,附近提供水环境,花粉管在靠近两相界面的萌发孔处形成。说明水的直接作用。烟草缺乏富含脂类的花粉外被突变也使柱头上水化不能进行或不能萌发。缺乏外被的花粉在高湿度能够水化,但缺乏轴向信息,萌发点相对于柱头具有随机性。人们提出了脂和水在引导花粉管在柱头上生长和进入传输管道的假设,在柱头脂质基质中水的分布受到控制,水流向花粉的途径决定了花粉管生长的途径(Edlund et al.,2004;Hiscock and Allen,2008)。
而在另一种湿柱头植物百合中,柱头分泌物是富含碳水化合物的水相,花粉管生长方向由两种多肽化学蓝素(chemocyanin)和柱头/花柱富含半胱氨酸的附着素(stigma/stylar cysteine-rich adhesin,SCA)引导,化学蓝素是一种含铜蛋白,作为化学信号指引花粉管生长方向,SCA本身没有方向指导作用,但可以增强化学蓝素的方向指导作用(Reviewed by Hiscock and Allen,2008)。SCA可被花粉管内吞进入细胞内,外源游离的泛素处理花柱可以促进SCA的内吞,进而促进百合花粉管附着(Kim et al.,2006)。百合含有的Ankyrin重复序列的蛋白lily ankyrin repeat-containing protein(LlANK)是泛素连接酶,存在于膜包被的细胞器,对花粉萌发和生长是必需的(Huang et al.,2006)。三者之间是否有联系,值得进一步研究。
最近发现干柱头植物拟南芥柱头分泌物中也有和百合化学蓝素相似的植物蓝素(plantcyanin),与花粉管生长有关,过量表达引起种子结实减少,花粉管生长异常。可能植物蓝素的导向机制在干柱头和湿柱头中机制相似(Reviewed by Hiscock and Allen,2008)。
3.花粉的萌发
花粉水化和花粉管萌发可以很快发生,时间在一个小时内不等,依赖于花粉在花药开裂时干化的程度。
草本花粉从不完全脱水。离开花药时代谢活性中等。这使水化在落到柱头上后几分钟很快萌发。相反,百合花粉释放时干化程度很高,在极端环境下能存活,但落到适当的柱头上水化后花一个小时萌发。
拟南芥和油菜的三核花粉粒附着在干柱头上后,发生化学结合,生物化学变化,代谢活性增加,RNA合成,花粉管从萌发孔出现,穿透柱头,在细胞间生长,分泌果胶酶(Edlund et al.,2004)。
图5.4显示拟南芥授粉早期事件的结果。①花粉外被移动到花粉与柱头接触点,在两个表面形成脚,用脂类染料FM1-43可观察到。②花粉管从花粉外壁伸出,进入柱头突起,用细胞壁染料刚果红(Congo red)可见。③花粉管在突起的细胞壁之间弯绕进入花柱,不被刚果红染色(Edlund et al.,2004)。
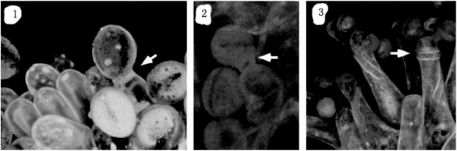
图5.4 拟南芥授粉早期事件(Edlund et al.,2004,ⓒASPB
柱头接受花粉的时间期限是在不同的物种授粉后一个小时到几天不等。柱头接受花粉的能力受几个因素的影响:①通过粘着捕捉花粉的能力。②使花粉水化的能力。③使花粉萌发的能力。
恰当的花粉发育时期是接受花粉能力的关键时期,不成熟的柱头或衰老、退化的柱头都不能提供完全正常的授粉过程。前者停止在水化前,后者不能生长。柱头角质表皮的破裂和角质酶或其他脂酶的作用帮助花粉进入柱头(Edlund et al.,2004)。
水化使花粉利用大量预先合成的mRNA激活代谢过程,营养细胞的细胞质和细胞骨架重新组织,花粉变成极性化细胞,将其细胞质和细胞骨架组织到与柱头接触处,支持管的伸出。这些变化发生在水化后几分钟到几十分钟,细胞骨架围绕核形成纤丝状,并且细胞骨架向花粉管萌发处极化分布。将营养核重排使之在生殖核前进入柱头。将线粒体和多糖颗粒集结在花粉管头部。选择质膜颗粒将胼胝质沉积在萌发位点(Edlund et al.,2004;Hiscock and Allen,2008)。到花粉管生长点的可能的传导极性信号有水、脂、离子、肽。一种五氨基酸、硫酸化的肽段(Phytosulphokine),在花粉少量情况下诱导萌发。这个肽段的假定受体是一个120 kU和一个160 kU糖基化膜蛋白(Edlund et al.,2004)。
花粉管内,Ca2+在花粉管尖部聚集,向后形成递减的浓度梯度,这种梯度对管尖部生长的速度和方向的信号调节起着中心作用。其他离子如H+、Cl-、K+的浓度梯度在花粉管生长延伸过程中也经历与花粉管延长速率震荡相似的周期性震荡(Hiscock and Allen,2008)。
极化信号触发RHO OF PLANTS1(ROP1)的聚集,它是一个参与F-actin动力学、在花粉管尖建立梯度的GTP结合蛋白。同ROP1协同作用的有ROP INTERACTING CRIBCONTAINING1蛋白,分布于生长中的花粉管尖,它们的功能集中在分泌颗粒的传递(Edlund et al.,2004)。
其他分布在管尖部位的蛋白与细胞极性的建立有关。延长的蕨类植物根尖有一种annexin与根尖小泡外分泌有关,表现了依赖钙的与磷脂结合的反应,影响细胞骨架和潜在的依赖电压的钙离子通道活性。
在花粉内部相对于外部信号建立了极性后,花粉管要伸出外壁,根据物种特点,或从萌发孔伸出,或直接突破花粉外壁。黑麦和桉树在萌发孔处的内膜被溶解,突破孢粉外壁。拟南芥花粉有三个萌发孔,花粉管常精确地从与柱头接触的外壁处萌发(Edlund et al.,2004)。
花粉管萌发需要三种条件:①降解花粉壁的酶。②通过局部凝胶膨胀力。③聚集的膨胀压。
综合机理可能是在花粉柱头接触处部分降解的外壁上膨压或凝胶膨胀力比别处容易突破(Edlund et al.,2004)。
4.柱头花粉之间的活性氧、活性氮信号传导
动植物中活性氧(Reactive oxygen species,ROS)、活性氮尤其是NO是各种信号传导途径中的关键组分。在花粉管生长和花粉柱头相互作用中也发现了它们的作用。
千里光(Senecio squalidus)中的柱头专一的过氧化物酶(stigma-specific peroxidase,SSP)只在柱头突起表达,SSP蛋白在突起表面的细胞质不连续分布。用ROS敏感荧光染料DCFH2-DA染色,在共聚焦显微镜下,千里光柱头活性氧水平远高于其他物种,而且ROS主要限制在柱头突起部位。过氧化氢清除剂丙酮酸钠可以减少突起上的ROS水平,说明过氧化氢是突起上主要的ROS。拟南芥柱头突起同样也有高水平的ROS/H2O2,对从单子叶到双子叶植物的20种被子植物的干柱头和湿柱头进行鉴定,发现所有柱头上都有ROS积累。这些结果说明ROS可能是SSP的底物(Reviewed by Hiscock and Allen,2008)。鉴于在保卫细胞质膜上的超极化Ca2+依赖渗透通道可被ROS调节的事实,Mori和Schroeder提出ROS激活Ca2+通道,引发多种信号传导通路的激活(Mori and Schroeder,2004)。根毛和保卫细胞中,NADH氧化酶介导活性氧的产生(Mori and Schroeder.,2004)。百合花粉管中NAD(P)H浓度的波动与花粉管生长的高峰一致,NAD(P)H氧化酶抑制花粉管的生长,同时,线粒体聚集的区域活性氧水平最高(McKenna.et al.,2006)。
同样用DCFH2-DA检测了柱头上花粉的NO水平,发现花粉的NO水平远高于柱头。在已经检测的10个单子叶和双子叶植物中所有花粉都有NO形成。用NO处理柱头,DCFH2-DA染色大大减少,而花粉在柱头的附着和发育同样减少DCFH2-DA染色。花粉释放NO。这说明花粉中NO释放到柱头上引起柱头ROS的消失,Hiscock和Allen推测NO是相容的花粉释放的解除柱头防御物质ROS的方式(Reviewed by Hiscock and Allen.,2008)。在蕨类植物Ceratopteris richardii单细胞孢子中,NO和NO的清除剂都能使cGMP依赖的极性生长丧失,但它们作用方式相反,鸟苷酸环化酶和磷酸二酯酶同样以相拮抗的方式使钙依赖的细胞极性丧失,NO和cGMP都在重力引起的极性生长信号的下游(Salmi.et al.,2007)。百合花粉管的生长方向可被NO通过cGMP途径改变,NO在花粉管的过氧化物酶体产生,负调控花粉管生长方向(Prado et al.,2004)。
有关植物发育生物学的文章

通过花粉外壁后,花粉管需要穿过柱头进入花柱,有些柱头和花柱是一体,有些需要穿过柱头表面的表皮和突起外壁再进入花柱。在花粉粒对柱头附着的干柱头类型,突起决定花粉管进入花柱传输通道的位点。其他物种中,有化学信号提供花粉管进入花柱细胞外基质ECM的导向。移区突起也阻止相适配的花粉进入柱头。角质酶抑制剂减少花粉管进入柱头的机会。酶解进入柱头被精确调控,以防止病原或不适当的进入。......
2023-11-20

贺春燕,王有科,李捷,张广忠;第二届中国林业学术大会——S9 木本粮油产业化,2009在田间试验条件下,研究了氮磷钾5种配比对5年生盛果期枸杞生长及产量的影响。齐晓燕,张广忠,张新春,张玉华《林业实用技术》 2013 第8期用不同浓度的硼酸处理桃树优良品种中油五号、中油七号、双喜红、武井早生、83-1等5种桃树花粉,采用琼脂培养基发芽和显微照相法测定其花粉萌发率及花粉管生长速度,研究硼酸对桃花粉生活力及萌发速度的影响。......
2023-11-27

GABA对花粉管的指引属于长距离指引。野生型未授粉雌蕊在花柱中积累低水平的GABA,从柱头经花柱到子房室量浓度梯度增加,为花粉管生长提供GABA梯度。同时也为花粉管生长提供能量和营养物质。然而NO信号传导突变体Atnos1花粉可以在野生型雌蕊中正常生长,反之花粉管生长异常。烟草的柱头是湿柱头,实心花柱,花粉管生长穿过分泌区域细胞的细胞间空间,内有分泌细胞的排出物。......
2023-11-20

雄蕊由花药和花丝组成。花药的发育从功能结构上包括小孢子发生和配子体发生两个阶段。小孢子发生在花发育阶段1到7,包括花药发育、组织专一化、减数分裂;配子体发生在花发育阶段8~14,包括小孢子从四分体释放,成熟为花粉粒。spl/nzz突变体表现为:珠心和花粉囊不能形成,是在雌雄蕊发育中都起作用的转录因子。......
2023-11-20

3D CNNs模型在两种条件下的训练收敛速度如图5.5 所示,对比实验结果见表5.3。使用3D CNNs 模型在SBU-Interaction 数据集上进行动作识别可获得96.76%的平均识别率,通过迁移学习动作识别率可提高到97.42%,充分验证迁移学习在3D CNNs 模型上的可行性和有效性。......
2023-10-28

本文主要以身份证的ID信息为实例,研究在管理信息系统的设计中采用ID信息识别技术的问题。因此,确保身份识别的安全性和正确性对应用系统的安全是至关重要的。......
2023-12-04

目前,将神经网络应用于图像识别的文献很多[1,2],但用于服装图像的情感语义识别和检索还几乎没有,而本章及第4、第5章正是采用了神经网络对男西装图像情感语义识别和检索问题进行了探讨。图3-1男西装图像样本神经网络训练和入库的流程图3-3男西装图像情感语义检索的流程BP神经网络是一种按误差逆传播算法训练的多层前馈网络,是目前应用最广泛的神经网络模型之一。......
2023-08-23

花粉营养细胞的主要活性是合成和组装花粉管细胞壁,花粉管中动态细胞骨架对花粉管的生长是必需的。肌动蛋白是传递尖部生长需要和延长所需的极性化微纤丝形成的组成成分,是花粉生长有关细胞骨架主要成分。肌动蛋白多聚化本身对花粉管生长起综合作用,抑制肌动蛋白多聚化的试剂抑制花粉管延长。由于每个相应的图像聚焦于花粉管皮层区域,只有朝尖端的运动被观察到。......
2023-11-20
相关推荐