胚珠中形成雌配子和雌配子体,受精后发育形成种子。珠心由大孢子母细胞形成并进行减数分裂形成单倍体的大孢子,即大孢子发生过程。大孢子四分体继续分化形成结构性的雌配子体,即雌配子体发生的过程。图4.13拟南芥胚珠和胚囊的结构雌蕊发育的两个关键过程是大孢子发生和雌配子体形成。大孢子发生和雌配子形成在不同的物种中发育类型不同。......
2023-11-20
1.胚珠发育调控
(1)胎座(Placenta)的定位和形成
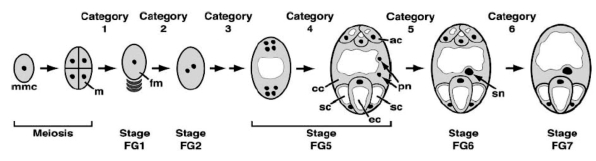
图4.14 拟南芥雌配子体发育阶段(Yadegari.and Drews,2004,ⓒASPB)
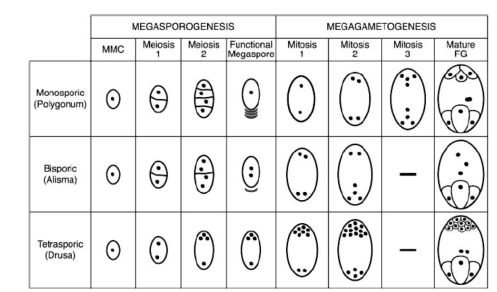
图4.15 雌配子体的类型(Yadegari.and Drews,2004,ⓒASPB)
胎座是心皮上特化的分生组织区域,由此形成胚珠。成熟雌蕊有两种心皮融合形式,其小室由中心隔膜分离。中脊是由心皮边缘部分融合形成,子房发育中两侧中脊向内生长融合形成隔膜。胎座部分由中脊靠侧面的部分形成(图4.12,图4.16)。心皮是分生细胞保持和类型决定的关键结构。雌蕊的中间区域保持相对的未分化状态,两侧发育成包括胎座分生活性在内的组织(Skinner et al.,2004)。
(2)胚珠结构特性的形成
胎座和胚珠由心皮形成,AG是决定心皮形成的转录因子,可能控制包括胚珠在内雌蕊的所有结构的形成。然而过量表达AG使胚珠变成心皮样结构。
BEL1编码同源盒蛋白,影响胚珠特性。bel1突变体在珠被处围绕珠心形成无形状的领状结构,野生型拟南芥中,开花期时AG表达下降,但bel1突变体AG积累,表明BEL1对AG具有抑制作用。突变体开花后异常结构继续生长,形成子房、花柱、柱头的结构,并继续形成一套次生胚珠,这也说明AG对胚珠特性形成也有作用。bel1突变体的合点特征消失。合点处BEL1的表达可能克服AG的过度作用。另外1%的agbel1ap2三突变体出现正常珠被(图4.17),说明有其他基因也决定胚珠形成(Skinner et al.,2004)。
BEL1和其他因子对珠被形态特性有正的决定作用,缺乏可导致AG占支配地位,导致心皮样结构的出现。与AG进化上相似的SHATTERPROOF1(SHP1)、SHP2、SEEDSTICK(STK,又名AGL11)在促进胚珠特性上有共同的功能,SHP1、SHP2在决定瓣边缘特化的功能上可取代AG,所有四个基因都有决定胎座和胚珠特性的功能。shp1shp2双突变表型没有显著变化,但stk胚珠在胚柄处不形成分离层,比野生型形成更多的细胞。shp1shp2stk三突变除了stk单突变胚柄的变异外,远端形成心皮样结构(图4.17)。BEL1和AG-SEP二聚体结合,抑制WUS在合点区域的表达,促进INO控制的外被的发育(Skinner et al,2004;Brambilla et al,2007)。
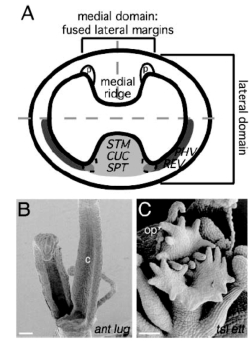
图4.16 心皮边缘组织的发育(Skinner et al.,2004,ⓒASPB)
A.拟南芥雌蕊的横切面。顶部是结构组分,底部是表达类型。中间区域(The medial domain)由侧部边缘自然融合形成(被垂直线分开)。内部中间区域由中间脊和胎座(p)组成。STM、CUC1、CUC2、SPT在中间区域表达,与PHAVOLUTA和REV在胚珠原基形成的胎座表达区域重叠。这种重叠对胎座的形成非常重要。两边的中间区域向内生长,最后融合形成隔膜。
B.ant-9 lug-3双突变未融合的心皮。包括胎座、胚珠和隔膜的中间区域缺失。Bar=100μm.C.tsl-1 ettin-2双突变体胚珠原基(op)在无其他心皮结构下形成Bar=50μm.
SEP3(AGL9)在胚发生前一直在胎座和胚珠原基表达,SEP1/sep1sep2sep3突变胚珠表型与stkshp1shp2胚珠相似,STK、AG、SHP1、SHP2与SEP蛋白形成多聚体复合物,是外被特性基因。STK-SEP-SHP复合体起着稳定BEL1-AG-SEP复合物的作用,控制珠被的形成。不同物种中这种作用是保守的。例如,矮牵牛FLORAL BINDING PROTEIN7 FBP7和FBP11之间有90%的相似性,属于AG系列,是STK的类似基因,表达模式与STK、SHP1、和SHP2相似。FBP7、FBP11与SEP的类似蛋白FBP2、FBP5相互作用;水稻STK类似蛋白OsMADS13与SEP相关蛋白OsMADS24、OsMADS45相互作用(Skinner et al,2004;Colombo et al,2008)。
(3)原基的向外生长
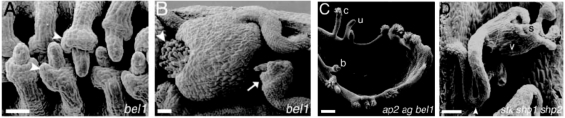
图4.17 胚珠特性决定基因的相互作用(Skinner et al.,2004,ⓒASPB)
(A)bel1-1花发育阶段12胚珠在两层珠被处有一个无形态的细胞领(箭头)。
(B)开花(anthesis)后,领状细胞继续生长成心皮状。这种次生心皮上可见到柱头乳突。一些胚珠开花后停止生长并降解(箭头)。
(C)ap2-6 bel1-3 ag-1三联突变体中,胚珠在心皮样花瓣上形成。这些胚珠通常是未分化的结构(u)。尽管通常是钟形结构(b),心皮样结构carpelloid(c)的胚珠也能形成。
(D)三联突变体stk shp1 shp2开花后的胚珠。一个胚珠柄支撑突变体远端形成的瓣样(v)和花柱样结构(s)。箭头标记珠柄远端。(A)(B)Bars=100μm(C)(D)50μm
与茎顶端分生组织中侧芽起始时边界与茎顶端分生组织的分离以及胚发育中子叶与顶端分生组织的分离相似,胚珠原基的起始由CUC基因决定。SHOOT MERISTEMLESS(STM)、CUP-SHAPED COTYLEDONS1(CUC1)、CUC2在分生组织初始原基之间表达,与分生组织保持有关。胚发育早期CUC1和CUC2促进STM表达,当STM发挥功能时抑制CUC2的表达,使之在STM不活跃的周围表达(Aida et al.,1999)。CUC1和CUC2也是决定心皮边缘原基(Carpel margin meristems,CMMs)形成的重要调节基因,通过控制STM的表达,来维持分生组织活性(Kamiuchi et al.,2014)。
充足的能量供给在胎座细胞分裂和向外延伸中起重要作用。huellenlos(hll)突变体因失去活性线粒体核糖体蛋白,表现出短而退化的原基。ant(aintegumenta)突变体有正常的原基但外被异常,ant、hll双突变体有短的原基和突变的胚柄。hll也表现与short integuments 2(sin2)基因的相互作用(Skinner et al,2004)。ANT编码一个具有APETALA2(AP2)结构域的转录调控因子,控制器官发育起始和促进细胞分裂(Klucher et al.,1996),在心皮的中间区域表达,与该区表达的STM所起的抑制分化的效果相平衡(图4.14),对拟南芥胚珠原基在近轴的起始是必需的(Skinner et al,2004;Schneitz et al,1998b)。LEUNIG(LUG)编码与Tup1/Groucho和Ssdp/Chip蛋白家族序列相似的共转录调控子(Conner and Liu,2000;van Meyel et al,2003)。ANT与LUG是转录共抑制子,抑制AGAMOUS(AG)活性。但antlug失去中脊并不是AG过量表达造成,而是失去ANT和LUG共有刺激雌蕊中间脊区域细胞繁殖的作用所造成。此外,它们在胎座和胚珠持续表达,促进胎座生长、胚珠原基形成(Skinner et al,2004)。
SEUSS(SEU)基因在功能上与LUG有许多共同之处。SEU与LIM区域结合蛋白家族基因相似,也编码一个共转录调控子。SEU通过LUG中的LisH/LUFS区域与之结合形成复合物,参与抑制AG在花被的表达(van Meyel et al,2003;Sridhar et al,2004;Sridhar et al,2006)。拟南芥还有三个类似SEU的基因SEUSS-LIKE(SLK),在胚珠起始中SLK1、SLK2在ANT\SEU\LUG控制的过程中不可缺少,例如,slk1slk2双突变增强lug胚珠和花缺陷的表型(Bao et al.,2010)。在雌蕊和根发育中最适的生长素信号传导需要SEU和SLK1的功能,推测通过生长素途径在侧生器官和胚珠数目决定方面起作用(Bao et al.,2010)。SEU和SLK作用的另一条途径是通过其下游基因PHABULOSA(PHB)、REVOLUTA(REV)和CRABS CLAW(CRC)(Azhakanandam et al,2008)。
CRC基因编码YABBY家族的蛋白,早期在心皮内部径向和胎座相邻处表达,这部分CRC不表达造成胚珠数目减少,可能通过离轴信号传递或限制STM和其他KNOX基因的表达直接决定胎座和原基的起始。SEU与ANT在子房促进CRC基因的表达,在雌蕊顶端中脊区域抑制CRC基因的表达(Azhakanandam et al,2008;Skinner et al,2004)。
PHB和REV在雌蕊阶段6的中脊和近轴侧生区域表达,可能与胎座的形成及胚珠的起始有关。SEU与ANT对它们的这种表达有促进作用(Azhakanandam et al,2008)。NZZ抑制PHB在珠心的表达(Sieber et al,2004)。
YAB1/FIL基因与ANT基因可能功能重叠,fil ant双突变雌蕊中脊几乎完全丧失,AP3表达减少,AG表达异常,AP3和AG的表达变化在seu ant双突变雌蕊中没有出现,说明SEU和YAB1功能的不同(Azhakanandam et al,2008)。YAB1/FIL、SEU、LUG、CRC可能是在雌蕊中脊发育过程中起重要作用的多蛋白复合体的部分组成成分。此外还发现SPATULA(SPT)、TOUSLED(TSL)等基因的突变引起边缘区域变异(Azhakanandam et al,2008)。分生组织因子相互作用,以促进侧生器官近轴特性分生组织形成的方式促进胎座的形成。在中间区域表达的STM和稍晚表达的REV可能是这类基因(Skinner et al,2004)。
(4)胚珠原基的类型决定
胚珠原基远近信息确定三个分化区域:远端成为珠心区,将形成大孢子和胚囊。中间是合点区,珠被形成区。近端是胚柄形成区。
面对柱头的一端称为顶端(gynoapical),面对花托的一端称为基部(gynobasal)。这个方向代表沿雌蕊轴向的方向,与胚珠近轴远轴方向垂直。沿雌蕊轴向的胚柄和外珠被的区别生长引起S形胚珠的形成。
WUS(wuschel)同源盒蛋白在茎、花和根顶端分生组织、胚发生中植物干细胞的保持和发生中是关键因子。在胚珠发育中,WUS在珠心表达,然后通过信号传导控制相邻区域合点部位基因表达和组织分化,决定珠被的起始(Groβ-Hardt et al.,2002)。WUS表达高峰与珠被起始时期一致。CLV1只在分生组织中表达,在胚珠中不表达。用CLV1:WUS转基因分析,转基因植物完全缺乏珠被(图4.18)。使用ANT启动子,WUS在合点和远端胚柄按照ANT的模式异常表达,导致多层珠被样结构形成(图4.19)。珠被的多层性和远轴胚柄区化体现了ANT表达的特点。说明野生型中WUS和ANT之间的空间关系也决定珠被的正确起始位置(Skinner et al,2004)。
ANT决定珠被的起始和生长,在胚珠原基早期表达,在胚珠发育第二阶段,珠被起始前限于远端胚柄和合点表达;珠被细胞开始分裂后则限于珠被原基和远端胚柄表达。ant突变体在合点处只有一点突起(图4.18)。
珠被在胚珠原基的近远轴上起始的位置由NOZZLE/SPOROCYTELESS(NZZ/SPL)核蛋白决定。nzz/spl突变导致胚珠上珠心位置的缩短,代表了珠被在胚珠原基近远轴上位置向远轴方向移动,与此相一致的变化是胚柄的延长。这种变化与ANT在远轴表达区域扩张相一致,即nzz/spl引起ANT异位表达(图4.20),说明NZZ限制ANT使其表达不超过合点,NZZ通过对ANT的负调控决定珠被起始的位置(Skinner et al,2004)。

图4.18 ant和CLV1:WUS胚珠表型
(B)ant胚珠不能形成珠被,限制合点细胞扩张形成脊(C)珠被没有生长。c,chalaza;f,funiculus;ii,inner integument;n,nucellus;oi,outer integument.Bars=25μm.(Skinner et al.,2004,ⓒASPB)
 (www.chuimin.cn)
(www.chuimin.cn)
图4.19 WUS ANT空间关系决定珠被位置is,integument structures;(Skinner et al.,2004,ⓒASPB)
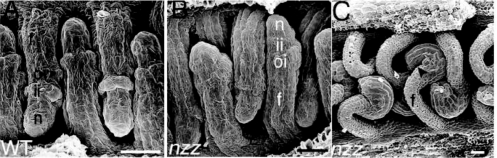
图4.20 NZZ控制珠被起始位置
(A)野生型(B)阶段2-Ⅰ外被刚起始,内外珠被起始位置更靠远端。(C).nzz-2突变体花药期胚珠,外被向远轴端移动导致珠柄延伸(Skinner et al.,2004,ⓒASPB)。
(5)外珠被起始和方向
YABBY蛋白INNER NO OUTER(INO)决定外珠被的起始。INO在外被起始前阶段2-I,只在外被起始的位置、胚珠的雌蕊基部表达。外被在内被起始后接着形成,因此可能依赖内被起始的位置和INO表达的位置。INO不仅建立胚珠的极性,也提供外珠被的远轴特性(图4.21)。锌指转录因子SUPERMAN(SUP)抑制INO在雌蕊基部以外区域的表达(Meister et al,2002;Skinner et al,2004)。

图4.21 INO启动子控制的表达在不同发育时期保持在外被区域(Skinner et al.,2004,ⓒASPB)
(6)外珠被的延伸
外珠被发育对细胞分裂和扩张较敏感;外珠被生长时期有限,不受精可导致胚珠退化;形态发生的微小异常可造成雌性不育。
外珠被和内珠被协调生长,lug、tsl、seuss(seu)突变体外珠被生长延迟或减少,内珠被过度扩张(图4.22)。TSL是核Ser/Thr蛋白激酶,可能在信号传递中起作用。LUG和SEU一起作为转录抑制因子作用。这些突变体的内珠被过度生长也可能是由于外珠被生长减少而引起的机械影响。影响细胞分裂和扩张的基因也影响珠被的延伸。short integuments 2-1(SIN2)是线粒体DAR GTPase,与核糖体大亚基形成有关(Hill et al,2006),维持珠被发育中的细胞分裂(Skinner et al,2004)。dicer-like1(dcl1,以前称为short integuments1)使珠被近远轴向的细胞延长缩短。DCL1 RNaseⅢ/RNA helicase调控miRNA活性,说明miRNA参与与发育有关基因的翻译调控(Golden et al,2002)。核蛋白TSO1与细胞延伸方向和细胞板的形成有关(Skinner et al,2004)。
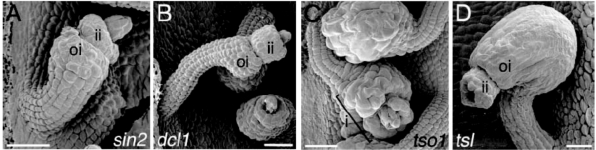
图4.22 花药发生时期胚珠外被细胞繁殖和扩张的突变体
(A)sin2-1外被细胞未成熟就停止分裂。(B)dcl1-7突变体外被细胞数目正常,但不能扩张。(C)tso1-3外被细胞有异常的细胞扩张和分裂。(D)ts-1突变体外被细胞繁殖减少,内部细胞过度繁殖,导致突出外被。(Skinner et al.,2004,ⓒASPB)
2.大孢子发生和雌配子体的形成
水稻中决定进入小孢子发生细胞数目的MSP1(MULTIPLE SPOROCYTE)基因同样决定进入大孢子发生的细胞数目,msp1突变体多个大孢子母细胞在胚珠中形成多个大孢子(Nonomura et al,2003)。拟南芥的类似基因是EXS/EMS,可能决定胞原细胞数目的因素对大孢子和小孢子发生是同一套基因,在高等植物中是保守的。
SPOROCYTELESS(SPL)/NOZZLE,是小孢子和大孢子发生必需的转录调控因子,在花药和胚珠中表达。纯合spl突变体胚珠完全缺乏胚囊,但所有母体细胞类型都存在(Yu et al,2005)。FOUR LIPS(FLP)以及MYB88是调节生殖组织进入配子发生的重要调节基因(Makkena et al.,2012)。
大孢子发生的过程是减数分裂形成单倍体大孢子的过程,许多影响减数分裂的基因影响大孢子发生,如拟南芥的CDC4类似基因(Stevens et al,2004)、AtATM(Garcia et al,2003)、细胞分裂素受体基因(Pischke et al.,2002)、Arabidopsis-mei2-Like(AML)基因(Kaur.et al.,2006)。
单倍体的大孢子形成后,再经过三次有丝分裂,形成八个单倍体细胞,并分化形成胚囊(表4.3)。此过程包括细胞核迁移、核融合、极性形成、细胞凋亡以及不对称有丝分裂等重要事件,均有重要基因参与调控(Guo and Zhang,2014)。例如,CYP85A1是拟南芥雌配子发生起始所必需(Perez-Espana et al.,2011),而GAMETOPHYTIC FACTOR1(GFA1)参与前体mRNA剪接,也是雌配子发生所必需(Moll et al.,2008;Liu et al.,2009)。助细胞是被子植物生殖所必需的,参与对花粉管吸引,使其能够正确找到珠孔的位置并释放精细胞。MYB98编码一个R2R3-MYB蛋白,作为转录因子在助细胞中表达,参与上述过程(Punwani et al.,2007)。中央细胞也参与了对花粉管的吸引和胚乳的发育。AGL61在中央细胞特异性表达,突变体中中央细胞的大小改变,且中央液泡消失(Steffen et al.,2008)。
表4.3 胚囊发育阶段(Ye et al.,2005ⓒASPB,addaped with permission)

具有7个细胞和8个核的胚囊是双受精所必需的,此后才能完成种子的形成与发育。胚囊周围孢子体组织的变异同样会影响胚囊的正常发育。例如,由于ant和bel1变异所导致的珠被发育异常,会导致雌配子不能发生。与胚珠发育相关基因的变异如sin1、stk、shp1和shp2均可以调节VERDANDI(VDD),一个猜测的转录因子,而vdd突变同样导致雌配子不能发生(Matias-Hernandez et al.,2010)。在茄科植物中,ScRALF3,在珠被和细胞核中表达,参与雌配子和周围孢子体信息交流(Chevalier et al.,2013)。
Yu等人(2005)对拟南芥发育早期和晚期的雌配子体(表4.4)进行了转录组水平的研究,同spl突变体相比,野生型早期阶段雌配子体上调表达(高于2倍、p<0.005、信号值>60)基因有97个,晚期有202个,两时期重叠的上调基因有73个,早期专一的上调基因有23个,晚期专一的上调基因有128个(图4.23)(Yu et al,2005)。晚期上调表达的基因数目远多于早期,反映了早期细胞形态建成和分化活性远不如晚期活跃,与形态变化一致。除了未知功能的蛋白以外,基础代谢的有关基因所占比例最大,为19.1%,其余的依次为去毒抗逆、组织结构、运输、蛋白质降解、信号传导、能量代谢、转录调控、次生代谢、器官发生、蛋白质合成/DNA降解(图4.23)(Yu et al,2005)。
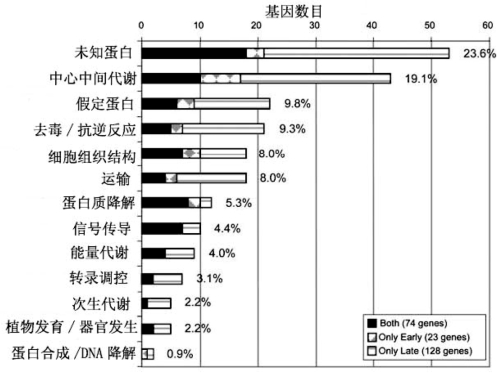
图4.23 胚囊发育过程中基因功能分类(Yu et al.,2005,ⓒASPB)
把其中6个基因的启动子与GUS相融合,进行早期和晚期雌配子体表达分布研究。这些基因的功能和在早期、晚期、幼苗中的表达分布如表4.4所示。
表4.4 六个基因启动子控制的表达分布(Yu et al.,2005,ⓒASPB,addaped with permission)

续表

这些结果说明SPL基因控制一批基因在雌配子体发育的特异时期和特定部位的表达,从而控制胚囊的发育过程。
3.胚珠发育过程中基因相互作用模式概述
以拟南芥中雌蕊的纵向轴为中心,心皮边缘融合形成的中间区域处一些蛋白形成大的调控复合体如ANT、LUG、SEU、STK-SEP-SHP、BEL1-AG-SEP,与其他中间区域表达的STM、CUC、SPT、WUS蛋白和两侧(远轴)心皮侧面表达的CRC、REV、PHB共同作用下,在这两区域之间即胎座上起始胚珠的发育。已经知道,CUC是STM的上游基因,STM反过来控制CUC2的空间分布(Aida et al.,1999)。STM与BELL类型的蛋白形成异源聚合体,这对STM的功能是必需的(Cole et al.,2006)。严海燕分析,由于STM的功能是促进分生组织形成,而AG-SEP促进花器官的分化,那么在BELL与AG-SEP和STM之间的聚合体是否竞争性的关系?这一问题有待实验证明。
Skinner等(2004)根据已有实验结果,对胚珠发育的分子机理进行了解释。在外被起始以前,在WUS、ANT、NZZ因子诱导下,远端边界表达形成外被,同时NZZ决定ANT在远端表达的程度和珠心的位置。INO仅在外被起始前,在将要形成外被的胚珠基部表达,并依赖ANT和BEL1的活性。内外珠被融合后,INO在外珠被的远轴细胞表达。INO在这些细胞表达的保持需要ANT和INO,INO支持ANT的表达。INO自调控环受到SUP负调控。该基因对限制INO在胚珠基部的表达是必需的。SIN2和TSO1促进珠被细胞的繁殖,而TSO1和DCL1调控珠被细胞扩张。LUG、SEU和TSL对内外珠被的协调生长是必需的,保证花药时期外珠被生长超过并封闭内珠被(图4.24)(Skinner et al,2004)。严海燕认为,由于WUS在茎顶端分生组织中与原分生组织的保持有关,在胚珠发育过程中只在珠心部位表达,而珠心是未来大孢子体发育的关键部位,可能在早期阶段也具有原分生组织的特性,因此WUS在这里作用的本质与茎顶端分生组织可能是一致的。
有关植物发育生物学的文章

胚珠中形成雌配子和雌配子体,受精后发育形成种子。珠心由大孢子母细胞形成并进行减数分裂形成单倍体的大孢子,即大孢子发生过程。大孢子四分体继续分化形成结构性的雌配子体,即雌配子体发生的过程。图4.13拟南芥胚珠和胚囊的结构雌蕊发育的两个关键过程是大孢子发生和雌配子体形成。大孢子发生和雌配子形成在不同的物种中发育类型不同。......
2023-11-20

位点印记指从DNA结构或染色体结构上对基因的控制表现为母方或父本的表型。它们的突变体表型相似,未受精突变体胚乳和果实发育,种子不育;受精突变体种子胚乳过量繁殖,细胞化延迟,胚发育终止,最后种子不育。反之,野生型母本与met1-3/+父本杂交,大小种子各占一半,说明雄配子中MET1功能的丧失使父本印记的生长抑制基因表达,引起胚乳和种子大小减小。......
2023-11-20

拟南芥和金鱼草花序有一个相似的基因决定无限的花序分生组织向有限条件转变。黑麦的LpTFL也与TFL1与金鱼草的CEN基因结构相似,突变体表型也相似,几种其他植物中TFL类似基因结构也与TFL相似,表明在植物花序分生组织的终端决定性具有相似的分子机理。TFL1在花序和茎顶端分生组织以及幼嫩腋芽内部表达,在早期的茎顶端分生组织TFL1表达范围靠近表皮,但随着成熟范围缩小到内部。......
2023-11-20

在胚发生阶段,根的原分生组织已经形成一定结构,萌发时分生组织开始分裂,胚根沿轴向伸展,分生组织的细胞数目增加、繁殖速度增加。到成熟根阶段,这部分组织发育成原分生组织。这些原分生细胞的衍生细胞发育形成中心区细胞和轴柱根冠细胞。植物的根系结构在不同的发育阶段和环境中形态结构不同。维管束又由中柱鞘、木质部、形成层和韧皮部组成,不同的植物在不同的发育阶段和环境中其根中各种组织的分布和结构有不同。......
2023-11-20

干细胞具有细胞分裂少、未分化的原始分生细胞特性,传统植物学中称为原分生组织。WUS在干细胞区直接与分化有关转录因子基因的启动子结合,抑制它们的转录。过量表达WUS,将在器官基数上过量。而限制WUS分布范围的CLV信号转导系统任一元素的失效都会导致WUS范围扩大,相应器官数目增多。由SUPER1编码的YUCCA5过量表达引起游离IAA和生长素反应增加,造成生长素过量的表型。......
2023-11-20

植物的花粉成熟后,被释放出来,不同的植物通过不同的传粉机制,将花粉传播到雌蕊上。营养核用于为花粉的萌发和花粉管的生长或两核花粉中生殖核的进一步分裂提供营养。风媒花粉与以动物为媒介的花粉和柱头在结构上大不相同。花粉到达柱头后,与柱头发生相互识别和相互作用后萌发,花粉管进入柱头,并深入花柱,在花柱内受到雌蕊中各种因素和信号的导引,向胚珠生长,最后通过珠孔,在胚囊内释放两个精子。......
2023-11-20

只有与静止中心接触的起始细胞受到影响,表明从静止中心短距离发射信号保持周围起始细胞的干细胞活性。生长素通过控制影响胚根发育的一系列关键基因起作用。突变体对生长素反应,但生长素反应元件DR5只在高浓度下反应,表明反应强度降低。与生长素运输有关的载体和蛋白对根的发育有影响。......
2023-11-20

花粉外壁的雕刻类型和萌发孔的位置在减数分裂后由细胞外壁前体决定。③花粉管伸出的入口。花粉内壁是由花粉细胞本身合成的纤维素,其结构适应于外壁的排列。能够加强和延长花粉管的极性。一些动物如甲虫、蝇、蜜蜂、鸟等根据花粉的大小和表面特点选择。同富含孢粉素的外壁相比,对花粉外被的研究更详细,鉴定存在各种链长的脂肪酸、蛋白、类胡萝卜素、类黄酮类物质。......
2023-11-20
相关推荐