缺乏花粉和绒毡层的雄性不育烟草花药正常开裂,说明开裂不需要花粉和绒毡层的信号。所有茉莉酸生物合成或信号传递途径突变体有相似的表型:花丝延长减少,花药开裂延迟,花粉活性降低,导致雄性不育。Ishigoro提出花丝中合成的茉莉酸调控雄蕊和花瓣的水分运输、引起相关的开花、花丝延长、花药开裂的模型。乙烯信号传递也在花药开裂中起重要作用,其机理可能与茉莉酸相似。......
2023-11-20
雄蕊由花药和花丝组成。花药的发育从功能结构上包括小孢子发生和配子体发生两个阶段。小孢子发生在花发育阶段1到7,包括花药发育、组织专一化、减数分裂;配子体发生在花发育阶段8~14,包括小孢子从四分体释放,成熟为花粉粒。绒毡层在这个阶段为小孢子提供营养和花粉外被的成分,花丝延长、花药增大、裂解、释放花粉(Alves-Ferreira et al.,2007)。雄蕊发生阶段和关键调控基因如图4.3所示。
ap3突变体表现为:没有花瓣和雄蕊,有额外的花萼和心皮。ap3突变体中下调表达的基因中,只有很少的基因专一性地在花瓣中表达,多数是雄蕊专一表达的。spl/nzz突变体表现为:珠心和花粉囊不能形成,是在雌雄蕊发育中都起作用的转录因子。ms1的表型是:花粉无活性,其余全正常,其编码控制绒毡层细胞程序化死亡的同源盒基因。ms1突变体中有73%的基因在小孢子和花粉中下调表达(Alves-Ferreira et al.,2007)。
在spl/nzz和ms1突变体中没有显示差异表达,但雄蕊专一表达的基因可能与雄蕊其他性状相关如连接组织、维管束、花丝等(Alves-Ferreira et al.,2007)。
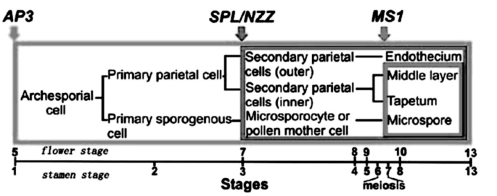
图4.3 雄蕊发生阶段和关键调控基因(Alves-Ferreira et al.,2007,ⓒASPB,)
不同发育阶段的雄蕊专一表达的基因重叠很少,说明各特定发育阶段表达特定群基因。例如受AG控制的At3g17010及编码B3类型转录因子的At5g09780在ap3突变体中表达,但在spl/nzz和ms1突变体中不表达,在绒毡层和阶段6花药的中层表达(图4.4B、C)。这两个基因可能是雄蕊发育中的关键基因,它们的功能可能重叠(图4.4,Alves-Ferreira et al,2007)。
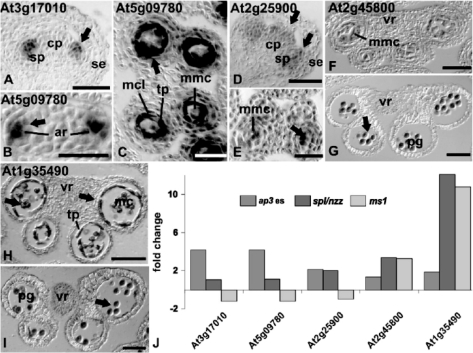
图4.4 雄蕊发育过程中几个基因的表达分布(Alves-Ferreira et al.,2007,ⓒASPB)
ar,Archesporial cell;cp,carpel primordium;mmc小孢子母细胞;mcl中细胞层;pg花粉粒;se花瓣;sp雄蕊原基;ta绒毡层;vr维管束
At2g25900基因编码锌指蛋白,在ap3和spl/nzz中表达,但ms1中不表达,野生型中只在幼小的雄蕊和心皮原基表达(图4.4D、E),花药阶段6以后没有表达。在花发育阶段9~11,NtLiM样蛋白基因At1g35490在绒毡层强表达(图4.4H),bZIP转录因子基因At2g45800在花粉粒表达(图4.4G),在花药发育早期它们表达量都很低(图4.4F、I)(Alves-Ferreira et al,2007)。
1.与雄蕊发育有关基因的鉴定和功能
雄蕊原基中B类、C类、SEP基因控制表达的基因有蛋白质、淀粉、蔗糖代谢、渗透压调节、细胞壁生物合成和扩展、糖的运输、脂类的转移、类黄酮合成、细胞骨架的结构等,直接参与了花丝花粉发育过程中生理生化反应和形态建成,与花丝和花粉的快速生长、水分运动、脱水、抗逆性、花粉开裂、贮藏物质的积累等密切相关。采用染色质免疫共沉淀、转录组学、转突变基因和差异杂交分析相结合的方法,可以研究B类和C类基因作用的目标基因。用这种方法找到了金鱼草中12个B类基因调控的差异表达的基因,如tap1,绒毡层表达预测的分泌蛋白基因、fil1,花丝和花瓣基部表达的细胞壁蛋白。对拟南芥野生型和C类基因突变体ag进行减法杂交研究,将得到的差异表达基因进一步用来对ap3突变体进行差异表达分析,发现了13个雄蕊中特异表达的基因。这些雄蕊中特异表达的基因包括编码水解酶、脂转移酶的基因。还发现了AP3/PI作用的基因中有一个在细胞分裂和细胞延展转换中起作用的基因(Scott et al.,2004)。
B类基因AP3和PI都属于MADS-box基因,它们的产物形成异源二聚体,在体外结合到CC(A/T)6GG的CArG box(Riechmann et al.,1996;Hill et al.,1998)。Wuest等(2012)通过比较全基因组范围内的基因表达情况,比较了ap3和pi双突变体中的基因表达情况,发现差异基因的数量随着花发育的进程逐渐增多,有超过2100个基因表达存在差异;这些基因涉及许多重要的功能,特别是与花瓣和雄蕊发育相关基因。通过染色质免疫共沉淀技术,AP3/PI在全基因组范围内有超过1500个结合位点;在2100个基因中有460个基因为其结合的目标基因。它们可以通过促进或者抑制表达,也就是说AP3和PI可以促进也可以抑制相关基因的表达。
拟南芥整个花粉发育过程约有14000个基因表达,成熟花粉有约7000个转录子,花粉中大量表达的占26%,花粉专一的占11%(Pina et al.,2005;Honys et al.,2004;Schmid et al.,2005;Verelst et al.,2007)。Suwabe等人用激光切割方法研究了140个已经证明是花药专一表达的发育中水稻花药各部分的转录组基因,进一步把这些基因的表达精确定位。其中雄配子体专一的基因有71个,占51%,绒毡层专一的基因有7个,占5%,雄配子体和绒毡层都表达的有62个,占44%。同时也确证了过去证明在绒毡层专一表达的11个基因的定位表达(Suwabe et al.,2008)。Tang等人(2010)用激光切割技术对水稻花粉母细胞PMC(Pollen mother cell)、Deveshwar等人(2011)对减数分裂前PMA(Pre-meiotic)、减数分裂MA(Meiotic)、单细胞花粉SCP(Single-celled pollen)、三核花粉TPA(Tri-nucleate pollen)时期的花药进行了基因表达组学的类型分析。从减数分裂前到三核花粉阶段共有22000个基因表达,其中减数分裂前PMA表达17497个,减数分裂MA表达18090个,单细胞花粉SCP表达17953个,三核花粉TPA表达15465(Deveshwar et al.,2011)。
多年来对突变体的研究揭示了大量孢子体雄性育性有关的基因,花粉发育也受配子体突变的影响,绒毡层线粒体基因组的突变由于使绒毡层退化而导致花粉不育。孢子体突变影响雄蕊发育的各个过程,如减数分裂中染色体配对、分离,绒毡层可育性、花粉壁形成、花丝延长、花药开裂等。
2.花药发育的控制机制
花药的发育过程同其他植物器官发育不同的特点是,小孢子囊(microsporangia)是由单个孢原细胞(archesporial cells)形成的。从形态发育阶段看,近轴远轴极性的建立、细胞类型的专一化和小孢子囊辐射对称的形成是花药发育过程的关键阶段(Scott et al.,2004)。
(1)近轴远轴极性的建立
在拟南芥花药原基小孢子囊的形成过程中,靠近花瓣的两个远轴的室(locules)比近轴的两个室大,表现出极性的分化,之间进一步由连接组织分离。研究表明,有许多基因可以在近、远轴中特异性表达。例如,Nakayama等人发现两个远轴表达的基因At2g01110和At5g57800,分别编码类囊体膜形成蛋白cpTatC和脂转移蛋白WAX2,后者主要在远轴表皮表达。而At3g09730和At3g60390在近轴表达,前者在花器官原基近轴和成熟花瓣的保卫细胞专一表达,后者在花器官起始后的前两个到四阶段的花原基近轴表达,编码含有PHD指的HD-ZIP蛋白HAT3(Nakayama et al.,2005)。
YABBY基因家族的FILAMENTOUS FLOWER(FIL)、YAB2、YAB3在拟南芥侧生器官的离轴表达,包括子叶、叶子、花瓣、雄蕊原基和心皮,决定器官的远轴特性的形成(Siegfried et al.,1999)。YABBY基因家族蛋白含有一个Cys锌指区,与其他蛋白相互作用,还有一个与HMG相似的DNA结合区,不同的YABBY蛋白中这两个区域结构不同(Meister et al.,2005)。
拟南芥侧生器官的非对称性是通过定位基因的相互作用决定近轴远轴特性而建立的,近轴特性基因抑制远轴特性基因。远轴特性的形成需要排除近轴特性基因的抑制,GARP样的转录调控因子KANADI和一组microRNAs可以介导对这种抑制的排除(miR165/6;Eshed et al.,2001,2004;McConnell et al.,2001;Emery et al.,2003;Juarez et al.,2004;Kidner and Martienssen,2004;Mallory et al.,2004;McHale and Koning,2004)。而生长素通过调控KANADI的活性,在这种极性建立的过程中起重要作用(Pekker.et al.,2005)。
花药中Fil1-yabby1和kanadi1(kan1)-kan2的双突变导致辐射对称花丝状结构的形成,同在叶中一样,FIL在花药的连接组织的远轴端表达,负调控近轴决定基因HD-ZIP转录因子基因PHB、PHAVOLUTA和REVOLUTA在远轴的表达,促进连接组织生长,PHB的表达则标志花药分裂面的形成(Scott et al.,2004:Dinneny et al.,2006)。
NUBBIN(NUB)和C2H2锌指蛋白转录因子JAGGED(JAG)也通过确定雄蕊的极性而决定其形状。其中NUB在雄蕊的近轴端表达,与JAG共同促进小孢子囊形成。它们极性建立的作用与YABBY/KANADI平行,作用于不同类型的组织(Dinneny et al.,2006)。
(2)细胞类型的专一化
同叶分生组织一样,拟南芥花分生组织也由三层组织发生层组成,表皮L1(epidermis)、亚表皮L2(subepidermis)、核心L3(core)。通常在L2层的细胞平周分裂起始雄蕊原基。由L2起始的细胞形成花药中大部分细胞类型,包括孢原细胞。L3层形成维管组织,有时也形成连接组织。L2层细胞经过一系列复杂的分裂活动,形成4个辐射对称的小孢子囊以及最终同花丝连接的输导组织。四个小孢子囊是由L2层的孢原细胞平周分裂形成与L1相邻的初生周壁细胞(Primary Parietal Cell,PPC)和靠内的初生孢子母细胞(Primary Sporogenous Cell,PSC)。孢原母细胞的特化在拟南芥是由NOZZLE/SPOROCYTELESS(NZZ/SPL)基因决定的,nzz/spl突变体不形成孢原细胞。花发育中的C类基因AG可以激活NZZ/SPL的表达,这也说明AG基因通过这种调控可以同时促进雌雄生殖器官的发育(Ito et al.,2004)。玉米中msca1(maize sterile converted anther1)可以形成孢原细胞,但不能分裂成为周壁细胞和孢子母细胞,不形成小孢子囊,却在表皮形成雄蕊结构(Scott et al,2004)。
决定花药中分化成孢原细胞的数目与茎顶端分生组织控制多极化细胞数目的机理相似。茎顶端分生组织的细胞数目由富含亮氨酸重复受体激酶CLV1(CLAVATA1)和信号合作基因CLV2以及配体决定。花药中,每个小孢子囊区域孢原细胞命运的细胞数目被EXS/EMS1限制为一个(图4.5),同时也决定绒毡层的发育。突变体每个小孢子囊有多个孢原细胞,没有绒毡层,后期小孢子由于没有绒毡层的营养供应而退化降解。EXS/EMS1为富含亮氨酸重复序列受体激酶(Zhao et al,2002;Scott et al,2004)。TPD1是一个分泌蛋白,它的突变型与exs/ems的表型相似,tpd1 ems1双突变表型也相同(图4.5G-J)(Yang et al.,2005;Jia et al.,2008)。EMS是与TPD1结合的受体,TPD1在植物活体和体外都与EMS直接结合,使其磷酸化,它们的表达范围都在小孢子囊(图4.5AB)。TPD1的分布范围确定了小孢子发生的范围。作为信号蛋白,TPD1与EMS受体是决定花药细胞命运的同一信号途径的组成成分(Yang et al,2003a,2005;Jia et al.,2008)。TPD1过量表达使绒毡层降解延迟,严重时造成雄性不育。tpd1突变小孢子母细胞过量形成。水稻中的MULTIPLE SPOROCYTE1(MSP1)是EXS/EMS1的类似物,相似的还有玉米multiple archesporial cell1(mac1)。msp1突变体雄蕊和雌蕊都发生突变(Scott et al.,2004)。水稻OsTDL1A与MSP1结合,决定孢子发生(Zhao et al,2008)。水稻花药中MSP1在花药减数分裂前PMA到减数分裂MA阶段专一表达(Deveshwar et al.,2011)。
(3)小孢子囊辐射对称的形成
孢原细胞的两个产物分别向两个方向分化。初生孢子母细胞PSC(primary sporogenous cell)经过几次分裂后形成性母细胞。初生周壁细胞PPC(primary parietal cell)经过平周分裂,形成了与L1相邻的药室内壁细胞和次生周壁细胞(SPC),次生周壁细胞再平周分裂,形成靠药室内壁的中层细胞和与小孢子母细胞相邻的绒毡层细胞(tapetal)。在exs/ems1突变体中绒毡层发育受影响,而且常缺乏中层细胞(Zhao et al.,2002;Scott et al.,2004;Jia et al.,2008)。
辐射对称的小孢子囊结构并不能完全由孢原细胞的平周分裂和垂周分裂形成。在连接组织接壤处孢子囊外层在某些物种起源不同。因此提出了由初生小孢子母细胞建立的辐射中心信号场的模型。PSC以及它的分裂产物可以诱导邻近细胞的分裂和分化。其过程如图4.6所示。
TPD1转录产物密布在孢子团中为发育中小孢子体为中心的辐射信号分布提供了证据(Scott et al,2004;Jia et al.,2008)。受AG控制的At3g17010及编码B3类型转录因子的At5g09780在绒毡层和阶段6花药的中层表达,可能是雄蕊发育中功能重叠的关键基因。At2g25900基因编码锌指蛋白,只在幼小的雄蕊和心皮原基表达,花药阶段6以后没有表达(Alves-Ferreira et al.,2007)。

图4.5 EMS1/TPD1对小孢子囊发生的影响(Yang et al.,2003a,2005ⓒASPB,I,J,Jia et al..,2008)
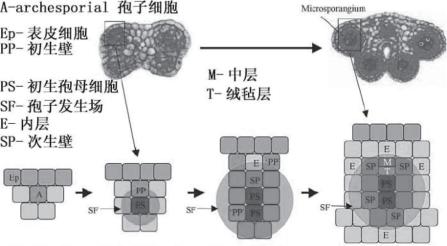
图4.6 孢子囊发生辐射场模型(Scott et al.,2004,ⓒASPB)
类似于CLV1的BAM1和2受体激酶在花药早期发育花粉母细胞命运决定中起重要作用,突变体花药形态异常(Hord et al,2006)。
3.小孢子囊的发育
小孢子和绒毡层的发育过程中,脂类合成基因主要在小孢子发生早期表达,介导脂类贮藏的油脂蛋白类基因在小孢子发生的中期和晚期表达。多数与脂类降解有关的基因在小孢子发生的晚期表达。一些与花粉外被形成有关的代谢类基因在绒毡层细胞高度活跃,另一些在花粉发育的晚期在花粉粒中活跃表达(Alves-Ferreira et al.,2007)。在雄蕊发育中期,早期花药发育中表达的MYB26/MALE STERILE35参与内层的形成(Yang et al.,2007a;Alves-Ferreira et al.,2007)。TAZ1(TAPETUM DEVELOPMENT ZINC FINGER PROTEIN1)在减数分裂前在除了绒毡层和配子体外的所有细胞表达,减数分裂后在绒毡层专一表达,决定绒毡层的发育,从而决定小孢子的育性(Kapoor et al.,2002)。
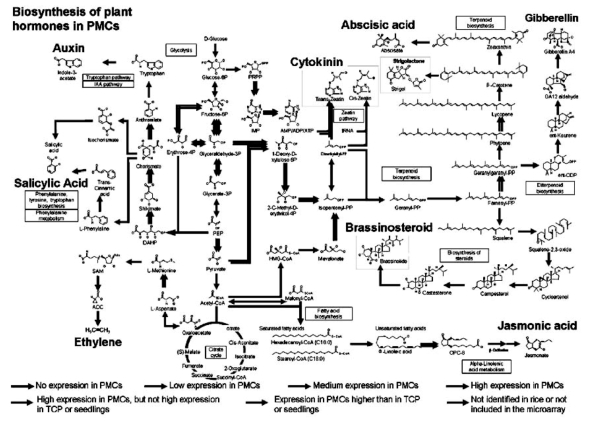
图4.7 水稻小孢子母细胞中与激素合成相关基因的表达(Tang et al,2010,ⓒASPB)
在小孢子囊发育过程中,中层细胞在小孢子母细胞和绒毡层的扩展下被挤破,小孢子母细胞和绒毡层之间的细胞质连接胞间连丝也因为小孢子母细胞胼胝质壁的迅速合成而破坏。小孢子母细胞和绒毡层最后都发育成为多核细胞。随后小孢子母细胞进入减数分裂,小孢子母细胞和绒毡层之间的胞间连丝扩展成直径为0.5微米的细胞质通道,进行细胞质的交流。人们相信细胞质通道与小孢子团的同步性有关。绒毡层发育后期,绒毡层原生质体之间的细胞壁溶解,胞间连丝增大成为不规则通道。减数分裂后的发育涉及孢子囊内多核体的细胞质交流,这种交流在减数分裂后是必需的。exs/ems突变体中缺乏可见的绒毡层,孢子囊发育停留在四分体阶段,推测是由于绒毡层中β-1,3glucanase(β-1,3葡聚糖酶)的缺乏,使小孢子不能从四分体胼胝质壁中释放出来(Scott et al.,2004)。
(1)小孢子母细胞中合成的激素与细胞分裂(www.chuimin.cn)
水稻小孢子母细胞中与各种激素合成相关基因的表达情况在图2.7中描绘出来。强表达的直接催化具有活性激素合成的基因有细胞分裂素反式玉米素合成基因,中强表达的催化具有活性激素合成的基因有细胞分裂素顺式玉米素合成基因以及脱落酸、赤霉素GA4合成基因。在激素合成产物前一步产物催化合成酶基因强表达的有生长素。前三步产物催化合成酶基因中强和强表达激素的有茉莉酸、乙烯,强表达的有油菜类甾醇。那些没有直接活性激素产物的激素可能在孢子发生的以后阶段发挥作用(Tang et al.,2010)。因此在孢原母细胞中细胞分裂素的合成可能直接与减数分裂有关,而赤霉素、脱落酸则分别与细胞壁物质的合成与分裂相关。
(2)小孢子母细胞的减数分裂
减数分裂是性母细胞特有的有丝分裂,其中DNA复制一次,但是细胞连续分裂两次,导致染色体数目减半。高等植物小孢子母细胞的减数分裂中染色体配对、交换、分离同其他物种减数分裂过程相似,但减数分裂产物小孢子发育成为花粉,独立地形成雄性配子体,在细胞壁形成等细节上不同于其他生命界的减数分裂。
植物小孢子体中,伴随着核活动还进行着细胞质的交流和重组,包括质体、线粒体的脱分化、分裂以及rRNA和mRNA的急剧减少。前期cDNA文库的研究表明核基因表达急剧减少,说明发生着从小孢子体细胞质中清除孢子体信息的活动,使减数分裂后的配子体发育摆脱有害RNA的作用(包括病毒和沉默RNA元件)。细胞器的脱分化和分裂可能也是源于核信息的减少。但小孢子发生对线粒体突变高度敏感,可能是因为绒毡层能量生产的高效性需求(Scott et al,2004;Alves-Ferreira et al,2007)。
减数分裂是高度特化和复杂的过程,任何与细胞周期、DNA双链断裂、染色质凝缩和染色体高级结构形成、联会复合体形成、纺锤丝形成等过程相关基因变异,均影响减数分裂的正常进程,导致花粉育性降低。例如,参与酵母DNA复制起始的CDC45拟南芥类似基因也影响拟南芥的减数分裂,是减数分裂必需的基因(Stevens et al,2004)。拟南芥DUET编码PHD指蛋白,参与染色质凝聚过程,在雄性母细胞专一表达,突变体从双线期开始异常一直延续到减数分裂(Reddy et al,2003)。拟南芥ATK1基因对小孢子母细胞减数分裂过程中纺锤体的形成是必需的(Chen et al,2002)。AtZYP、AtASY1、AtMND1则对减数分裂中同源染色体的配对是不可缺少的(Panoli et al,2006)。Arabidopsis Separase(AESP)是拟南芥中与染色体中两个姐妹染色单体分离有关的基因,在胚发生和减数分裂过程中影响相连接的姐妹染色单体的释放(Liu and Makaroff,2006)。
Tang等人(2010)对水稻花粉母细胞PMC基因转录组功能类型的分析也表明,在1158个的PMC偏好表达的基因中,有参与减数分裂重组和细胞周期控制的基因,如双链断裂有关基因OSPO1-1、PAIR1;末端加工有关的假定的OsRAD50、OsMRE11、OsNBS1;装载重组复合体的OsBRCA2、单链DNA结合蛋白、OsPHS1;与链侵入有关的OsDMC1、OsRAD51、OsPAIR2、OsRPA1a;与链交叉有关的ZEP1、MER3、MSH3、拟南芥PID、MUS81、SLX4、MSH1类似基因;还有染色体结构控制的基因RAD21-4、PAIR3;减数细胞周期控制的Os MEL1、OsSDS等(Tang et al,2010)。
在小孢子母细胞减数分裂过程中,新形成的子细胞质膜和最初的纤维素壁之间沉降β-1,3葡聚糖组成胼胝质细胞壁,减数分裂结束后,小孢子之间也沉降了胼胝质。多数单子叶植物第一次减数分裂后胼胝质壁就在子细胞之间形成,第二次减数分裂后同样在四分体之间形成胼胝质壁(连续型)。多数双子叶植物在四分体形成后才同时进行细胞分裂,胼胝质壁在小孢子之间扩展,直到小孢子完全分离(同时型)(Scott et al,2004)。
(3)小孢子母细胞减数分裂的细胞壁
孢子体有丝分裂和小孢子母细胞减数分裂的分裂面形成的控制不同。减数分裂未来细胞分离的位点不是前前期带的标志,在连续型的胞质分裂中,减数分裂第二次分裂后,胞质同时分裂,每个小孢子核被辐射状微管围绕,这些微管与周围的细胞质形成小孢子区域。在孢子区域界面,胞质分裂面由含有细胞壁和膜的组成成分的颗粒交接处确定,如这些颗粒结合,胞质分裂沿着这个平面进行。拟南芥tetraspore/stud(tes/std)突变体不能完成小孢子母细胞的胞质分裂。TES基因编码在减数分裂末期建立围绕小孢子核的微管辐射列所需要的激酶(Scott et al,2004)。TES在减数分裂前的花药各部位表达,表明雄性减数分裂的胞质分裂是由小孢子体控制(Scott et al,2004)。
小孢子间的胼胝质壁的形成和溶解是单个小孢子形成的重要因素。胼胝质壁在小孢子体发育中的功能可能有两个方面。一是分子筛或屏障的作用,将孢子发生细胞和其他孢子体的细胞分离,或将减数分裂产物分离,防止细胞粘着和融合。另一方面是作为成熟花粉粒外壁特殊结构形成的模板,以及与花粉粒的释放有关。
拟南芥位于质膜上的糖基转移酶UDP葡萄糖β-1,3葡聚糖合酶5(glucan synthase-like,AtGs15)与酵母β-1,3葡聚糖合酶同源,可能是小孢子体中负责胼胝质合成的酶(Scott et al,2004)。而拟南芥的A6基因和烟草的TAG1基因编码类似于β-1,3葡聚糖酶的多肽,与callase的活性和表达类型相关。A6专一地在绒毡层表达。减数分裂末期,由绒毡层分泌的、含有内源和外源葡聚糖酶和纤维素酶的Callase降解四分体小孢子间和外部的胼胝质壁,释放单个小孢子,参与对胼胝质壁的降解。另外,编码多聚半乳糖醛酸酶类似基因quartet 3的突变造成花粉母细胞壁降解需要的多聚半乳糖醛酸酶缺陷,使小孢子不能分离(Scott et al,2004;Rhee et al,2003)。β-1,3葡聚糖酶表达时间的变化或不能表达导致四分体细胞壁解聚酶的异常,是细胞质雄性不育的主要原因(Scott et al,2004)。
牵牛花和百合花药中,callase的分泌和表达受到发育的严格控制。β-1,3葡聚糖酶表达时间的变化或不能表达导致四分体细胞壁解聚酶的异常,是细胞质雄性不育的主要原因(Scott et al,2004)。然而天然没有胼胝质壁的Pandanus odoratissimus以及由于内源β-1,3葡聚糖合酶异常表达而不形成胼胝质壁的转基因烟草都能正常进行减数分裂而形成小孢子四分体。不形成胼胝质壁的转基因莴苣、油菜、番茄、玉米也都能正常进行减数分裂(Scott et al,2004)。一些天然形成永久性小孢子四分体的种如Juncaceae,Ericaceae,Oenotheraceae在四分体小孢子间相交的壁没有或几乎没有胼胝质的形成,正常形成胼胝质壁的番茄在没有胼胝质形成时也形成永久性的四分体。每个小孢子具有独立的孢外壁,但在孢子之间相交处融合防止它们分离(Scott et al,2004)。这说明,胼胝质壁的形成并不是小孢子活性形成所必需。
除了胼胝质,果胶也是影响孢子分离的重要因素。拟南芥四分体突变体形成永久性的四分体,其胼胝质壁形成正常,但围绕四分体的亲本小孢子体的果胶不能降解,编码拟南芥果胶甲酯酶的QUARTET(QRT)基因的突变体花粉粒以四分体形式释放,小孢子不能分离,表明果胶的降解对小孢子的分离也是必需的(Scott et al,2004;Francis et al,2006)。
(4)绒毡层的发育和花粉外被的形成
绒毡层在性母细胞发育过程中提供营养和花粉壁形成所需的物质,由于发育早期与性母细胞之间的细胞连接已经破坏,没有信号传递。但是绒毡层与小孢子体一样进行大量的蛋白质合成和DNA复制,矮牵牛中绒毡层核的DNA拷贝数可以达到8倍,成为绒毡层独特的代谢特点,伴随着蛋白质的大量合成,这种高水平的合成活性需要大量的能量供给(Scott et al,2004)。
绒毡层细胞在花粉壁形成中起中心作用。绒毡层细胞在不同种中表现不同,可以是分泌型或保留在小孢子囊外周或变形侵入药室及发育中小孢子之间。有些植物中,绒毡层在早期成为碎片,破碎的原生质成分移入药室。绒毡层为花粉外壁提供富含脂类的外壁。分泌型的百合(Lilium)绒毡层在孢粉外壁沉积混合的类胡萝卜素(carotenes)、黄烷醇类(flavonol)和脂类。Asteraceae侵入型的绒毡层渗透进入花粉壁复杂的内室。十字花科花粉外表面的复杂外被称为tryphines,是绒毡层碎片在花粉外壁形成的,含有花粉在柱头表面成功发育必需的多种脂类、糖脂、蛋白。拟南芥花粉外被成分缺陷的突变体授粉后不能水化,油菜小的富含半胱氨酸的花粉外被蛋白与柱头的相互作用有关,尤其是在自交不亲和系统的雌性决定中有重要作用。这些种中雄性不亲和性的决定因素属于花粉外被蛋白(Scott et al,2004)。在花粉内壁吸水膨胀后,花粉外壁还赋予花粉弹性,使之容易通过珠孔通道(Takaso and Owens,2008)。
DYSFUNCTIONAL TAPETUM1(DYT1)是拟南芥bHLH转录调控因子,在花药发育阶段5晚期到阶段6早期在绒毡层强表达,受spl/nzz和ems1/exs正调控。野生型与突变体的比较转录组分析表明,DYT1可能参与了脂代谢与转运、花粉外壁形成、细胞壁加工、木质素和类黄酮等的合成及转运等过程,是保证绒毡层正常功能和花粉育性形成的核心调控基因(Feng et al.,2012)。dyt1突变体中许多偏向在绒毡层表达的基因表达下调,说明DYT1在SPL/NZZ和EMS1/EXS下游作用,调控许多在绒毡层发育中起重要作用的基因(Zhang et al,2006)。但是DYT1不是决定绒毡层正常发育的充分条件,其他基因如AtMYB33、AtMYB65、SERK1/SERK2、TPD1也是决定绒毡层形成的重要基因。同EMS1/EXS一起,SERK1/SERK2、TPD1是在上游作用的基因,功能重叠的AtMYB33、AtMYB65可能与DYT1一样,也是在EMS1/EXS、SERK1/SERK2、TPD1下游作用的基因(Zhang et al,2006),它们受miRNA的调控,限制在幼小花药中表达(Miller and Gubler,2005)。
MALE STERILITY1(MS1)是PHD类的转录因子基因,负调控自身的表达,定位在绒毡层细胞核中,在四分体晚期到小孢子释放期表达,之后很可能通过依赖泛素的蛋白质降解系统降解。ms1突变幼芽有260个基因的表达改变,其中228个下调,32个上调表达。过量表达MS1导致营养生长过度分枝,部分可育花成熟花粉壁物质增加。说明MS1在绒毡层合成花粉壁物质和花粉外被物质的过程中起重要作用,从而影响花粉的可育性(Yang et al,2007b)。
TAZ1(TAPETUM DEVELOPMENT ZINC FINGER PROTEIN1)在减数分裂前在除了绒毡层和配子体外的所有细胞表达,在减数分裂后在绒毡层专一表达,决定绒毡层的发育,从而决定小孢子的育性。TAZ1沉默导致绒毡层发育异常和过早降解,小孢子营养不足而不育(Kapoor et al,2002)。
植物激素在绒毡层发育过程中也起重要作用。水稻绒毡层发育过程中细胞分裂素、赤霉素、乙烯、油菜类甾醇、水杨酸、脱落酸的一些信号传导相关基因在花药发育的减数分裂、四分体、单核花粉阶段中花药各部位都有表达。而生长素信号传导受体TIR1:3专一在四分体阶段表达,脱落酸信号传导相关基因PP2C1-9及该途径以后的相关基因除VP1、bZIP10、bZIP12以外的基因都偏好在四分体强表达,bZIP72在减数分裂和单核阶段的绒毡层也有较强表达(Hirano et al.,2008)。说明花药发育的四分体阶段,生长素诱导的生长发育旺盛(表4.2.)。
表4.2 绒毡层发育过程中激素相关基因的表达(Hirano et al.,2008)

注:黑体为强表达,其余为中强表达。
(5)花粉成熟过程基因表达的调控
AtmIKC亚家族的MADS-box基因家族AGL30、AGL65、AGL66、AGL94、AGL104基因在花粉成熟过程中大量表达,其他发育时期和部位少量表达。这五个基因产物相互作用,形成复合体,与DNA结合,作为转录因子,调控基因表达。它们调控的基因数目和变化如图4.8所示,有一大批基因受它们的调控,它们的功能是以聚合体的形式实现的(图4.8)。MIKC聚合体对花粉发育中基因表达的调控活性从单核花粉期开始,双核期增加,三核期达到高峰(图4.9)。调控的方式有抑制表达(WRKY43、SCL8、CCA1、MIKC自身),也有促进表达(MYB97、AGL18、AGL29)(Verelst et al,2007)。
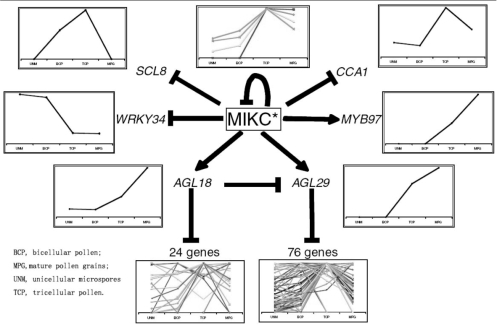
图4.8 AtMIKC基因调控的功能重叠性(Verelst et al.,2007)

图4.9 MIKC对花粉发育中基因表达的调控(Verelst et al.,2007)
4.花粉壁的结构、合成与类型
在雄性减数胞质分裂后,四分体中小孢子独立起始形成细胞壁。细胞壁有三层结构:内壁是果胶纤维素壁,其外面围绕着孢子花粉素为基质的外壁(exine),它又由外壁内层(nexine)和外层孢粉(sexine)组成。外层孢粉最为复杂,它的耳柱和顶盖是花粉壁种间专一性类型变异的基础(Scott et al.,2004,Jiang et al.,2012)。
胼胝质首先沉积在小孢子表面,接着是外层孢粉的前体primexine,然后是外层内壁nexine,最后是内壁。Primexine含有大量多糖,作为模板指导孢子花粉素的沉积。烟草小孢子形成的早期移去胼胝质壁使顶盖缺失,但耳柱定位不受影响,表明胼胝质为顶盖形成提供固体支持但不为壁元件的定位提供模板(图4.10)(Scott et al,2004)。胼胝质(Callose,β-1,3 glucan)决定花粉壁的类型。编码雄蕊专一的β-1,3葡聚糖合酶基因CALS5决定分离中短时期内小孢子胼胝质壁形成,这阶段的胼胝质沉积对花粉外壁和可育性十分关键(Nishikawa1 et al,2005)。

图4.10 花粉壁的结构(Scott et al.,2004,ⓒASPB)
小孢子释放之前,孢粉素是由小孢子合成和分泌的前体多聚化形成。小孢子释放后大量的孢粉素前体由绒毡层合成和分泌到壁里,孢粉素为外壁提供了不平行的物理强度和化学惰性以及生物抗逆性。孢粉素的成分主要包括长链脂肪酸、少量酚类化合物,酚类单体由多酚类特性(如木质素和软木脂)的酯键相连,因此孢粉素和角质、木质素和软木脂一样是生物多聚体(Scott et al,2004)。
编码质膜蛋白的拟南芥RUPTURED POLLEN GRAIN1(RPG1)基因影响减数分裂后小孢子间外层孢粉的前体primexine的沉积方式,突变体前孢粉素随机分布,造成花粉粒开裂,细胞质流出(Guan et al,2008)。另一个钙结合的膜蛋白DEX1的突变同样引起前孢粉素随机分布,不同的是,突变体的小孢子质膜不形成野生型具有的波纹,前孢粉素沉积延迟、变薄、构象改变,前孢粉素中的间隔不形成,导致前孢粉素随机分布,使孢粉素不能附着在小孢子上(Paxson-Sowders et al,2001)。
萌发孔和耳柱列在孢粉壁精确定位。在萌发孔处,只有内层而没有孢粉素前体的沉积。Heslop-Harrison(1963)提出在未来萌发孔位置,内质网的沟屏防止了孢粉素前体的沉积的假说,随后Dover、Sheldon、Dickinson指出减数分裂纺锤体在萌发孔处定位,可能把细胞质拉离质膜。虽然孢粉壁类型繁多,但基本结构相似,都由耳柱形成的网状排列和一系列相套的空隙组成(Scott et al,2004)。
决定种间专一的孢粉壁类型在减数分裂前小孢子体的二倍体核中表达,并且通过小孢子遗传。在百合发育中小孢子体的离心实验表明,蛋白质外被颗粒与减数分裂起始时primexine在细胞质出现的位置以及随着减数分裂插入到质膜的类型有关。这些颗粒通过蛋白或其他物质插入质膜,影响耳柱的定位。这种颗粒与质膜的融合的方式有两种假说。一种是油滴在水上的方式,另一种是土地干裂的方式。油滴在水上的模式中,颗粒以油滴的方式嵌入膜中,成为六角形片状分布,耳柱沿六角形边界沉积形成;土地干裂模型中,颗粒在质膜中成片分布然后收缩成六角形裂缝,耳柱同样沿六角形裂缝形成(Scott et al,2004)。
在拟南芥中ABORTED MICRSOSPORES(AMS)是一个主要调控因子,协调花粉壁的形成以及孢粉素的生物合成。全基因组共表达分析表明,花药中98个特异性表达的基因中有70个基因在ams突变体中表达量减少,在其中,23个基因受到AMS的直接调控,这些基因涉及胼胝质降解,脂肪酸链延长,苯环化合物合成,以及脂类转运;这些可能涉及孢粉素前体的合成;与此相对应,在突变体中,小孢子不能释放,孢粉素沉积缺陷、苯环类化合物显著下降,cutin单体等含量显著下降(Xu et al.,2014)。
有关植物发育生物学的文章

缺乏花粉和绒毡层的雄性不育烟草花药正常开裂,说明开裂不需要花粉和绒毡层的信号。所有茉莉酸生物合成或信号传递途径突变体有相似的表型:花丝延长减少,花药开裂延迟,花粉活性降低,导致雄性不育。Ishigoro提出花丝中合成的茉莉酸调控雄蕊和花瓣的水分运输、引起相关的开花、花丝延长、花药开裂的模型。乙烯信号传递也在花药开裂中起重要作用,其机理可能与茉莉酸相似。......
2023-11-20

花药和花粉培养所得单倍体植株不能开花结实,本身无利用价值。单倍体育种对F1或F2代花药进行培养,将所获得的单倍体植株进行加倍处理,获得稳定的纯合二倍体,下一代植株性状基本稳定,育种只需3~5年。这一技术加快了自交系培育,促进了异花授粉植物杂种优势的利用。远缘杂交的花药与花粉培养,可克服其不育性。此外,花药与花粉培养作为一种实验手段也被用于花粉发育及其控制、物种形成等理论研究。......
2023-11-20

排尿反射是在神经系统调控下进行的。排尿结束后,尿道外括约肌立即收缩,膀胱颈亦逐步关闭,逼尿肌松弛,膀胱压降至静息水平,于是又进入储尿期。这些现象提示脑桥有负责储尿、排尿的开关环路。这一脊髓排尿反射通路可能是脊髓横断后的重建,也可能是脊髓上中枢失去抑制作用的缘故。......
2023-12-04

11.6.3 压差阻力物体在流体中运动时因为物体前后压力差引起的阻力称为压差阻力,其形成原因与物体的形状有关,所以压差阻力又称为形状阻力,这里针对其形成原因、影响因素和改善措施描述如下。......
2023-06-29

花粉外壁的雕刻类型和萌发孔的位置在减数分裂后由细胞外壁前体决定。③花粉管伸出的入口。花粉内壁是由花粉细胞本身合成的纤维素,其结构适应于外壁的排列。能够加强和延长花粉管的极性。一些动物如甲虫、蝇、蜜蜂、鸟等根据花粉的大小和表面特点选择。同富含孢粉素的外壁相比,对花粉外被的研究更详细,鉴定存在各种链长的脂肪酸、蛋白、类胡萝卜素、类黄酮类物质。......
2023-11-20

FLC和CO对SOC1的调控是通过SOC1的启动子区域进行转录调控。FT也是传递开花信号的一个主要基因,受CO的正调控和FLC的负调控,促进开花关键基因AP1的表达。LFY同样也是长日和赤霉素信号的产物,这些信号也是通过LFY启动子区域进行转录水平的调控。AP1和LFY是最终决定花分生组织特性的关键基因,它们的表达,形成了花原基,称为花分生组织,决定了花结构形成的起始。Blazquez将已经获得的相关基因的关系绘制了一张网络图综合说明花发育的基因决定过程。......
2023-11-20

第一节新月体形成的机制新月体形成的机制很复杂,但主要有二个机制。新月体主要由两部分组成。早期新月体主要由增生的上皮细胞和单核细胞组成,称为细胞性新月体。最后新月体内的细胞和渗出物完全由纤维组织替代,成为纤维性新月体。......
2024-07-03

花粉营养细胞的主要活性是合成和组装花粉管细胞壁,花粉管中动态细胞骨架对花粉管的生长是必需的。肌动蛋白是传递尖部生长需要和延长所需的极性化微纤丝形成的组成成分,是花粉生长有关细胞骨架主要成分。肌动蛋白多聚化本身对花粉管生长起综合作用,抑制肌动蛋白多聚化的试剂抑制花粉管延长。由于每个相应的图像聚焦于花粉管皮层区域,只有朝尖端的运动被观察到。......
2023-11-20
相关推荐