矮牵牛的聚伞花序是顶端开花的有限花序,花序发育中,顶端分生组织形成两个分生组织区域,顶端的一个发育形成花分生组织,侧生的一个保持花序分生组织特性,以后重复这样的分化过程。Rebocho等人通过EVG、DOT、ALF、EXP、HER、TER等几个基因在矮牵牛花序形成中的相互作用的研究结果的分析,提出了矮牵牛的聚伞花序形成的分子决定模型:有一个未知的可动因子X在侧生花序分生组织合成,抑制DOT在IM和FM的表达。......
2025-09-30
根据新补充的花发育的ABC模型,雄蕊原基特性由B类基因AP3和PI(拟南芥)、DEF(deficiens)和GLO(globosa)(金鱼草)、C类基因AG以及E类基因SEP共同决定。这些花器官决定基因分别在其作用的区域被激活。
1.B类基因AP3/PI的启动
B类基因(PI、AP3)的激活是在AP1、LFY、UFO等基因的共同作用下完成的(图4.1)。LFY基因产物与AP3基因的启动子结合,正向调控AP3的合成。突变的lfy基因引起AP3基因表达的下调。然而LFY结合位点的突变并不改变LFY激活AP3的功能,因为LFY基因的作用是通过UFO(UNUSUAL FLORAL ORGANS)基因的共同作用实现的,ufo和lfy的双突变是致死突变(Jack,2004)。体内与体外实验均表明,LFY与UFO蛋白存在物理互作,UFO的结合加强了LFY行使转录调节的功能(Chae et al.,2008)。
UFO编码一个含有F-box的蛋白。在哺乳动物、酵母、植物中F-box类蛋白是SKP1-cullin-F-box(SCF)复合体的组成成分,该复合体选择泛素介导的蛋白质降解的底物。UFO功能的丧失使所有四轮花器官形成异常,影响最大的是B类基因所在的花瓣和雄蕊,那里AP3和PI的表达减少。在与LFY共表达的部位,无论是营养器官还是花器官,UFO的过量表达都能引起相应部位AP3和PI的异常表达。而异源启动子控制的AP3和PI的共表达也能部分缓解ufo突变造成的异常(Levin and Meyerowitz,1995;Lee et al,1997;Parcy et al,1998;Krizek and Meyerowitz,1996.)。
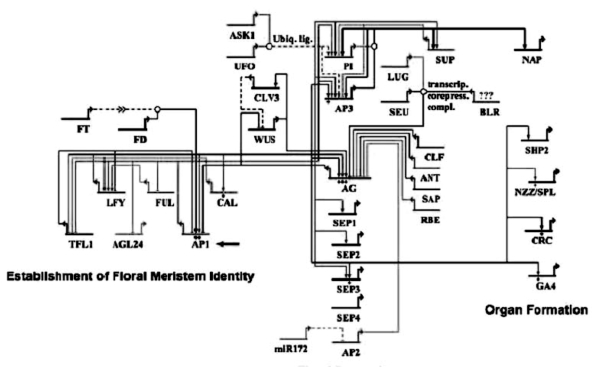
图4.1 花类型形成的基因调控网络(Wellmer et al.2006)
UFO RNA在各不同时期的瞬时表达具有特定的功能。在花发育的第一阶段,即刚由花序茎端分化的花原基中没有可探测的UFO RNA,其表达被抑制;阶段2表达限制中心区域,在轮3和轮4的前体细胞部位UFO RNA有少量表达,这时还没有任何花器官原基的分化;阶段3和4,花萼原基出现时,UFO RNA在轮2和轮3花瓣和雄蕊前体细胞中有表达,在心皮前体细胞中没有表达,即表达以冠状类型分布在花原基上;到了阶段5,表达限制在花瓣,这时期是轮2轮3器官起始的时期,AP3和PI的表达类型在阶段3已经建立,所以UFO的表达与AP3和PI表达类型的建立有关(Jack,2004;Durfee et al.,2003)。
ASK1(Arabidopsis Skp1-like)与UFO一起参与Skp1-CUL1-F-box protein(SCF)复合体的功能。Zhao等人证明ASK1、UFO与LFY共同作用调控B类基因表达(Zhao et a,.2001),他们推测ASK1、UFO与LFY的抑制因子结合,使其通过SCF复合体降解,释放对LFY的抑制,从而促进对AP3和PI表达的激活(Zhao et al.,2001)。
UFO的功能还与花瓣的形成有关。一个弱的ufo突变体ufo-11可以造成轮2花瓣不能形成,但是轮3雄蕊正常,说明UFO在轮2花瓣形成中的作用。ag和ufo-11的双突变体花瓣又成为正常,然而在ufo-11的突变体轮2没有探测到AG RNA,说明轮3和轮4表达的AG可能通过细胞信号传导影响轮2花瓣的分化(Jack,2004)。
AP1基因激活UFO和B类基因,通过UFO促进花瓣形成。UFO RNA在花瓣基部的积累需要AP1活性,ap1突变体中轮2花瓣基部探测不到UFO转录产物,花器官的发育也受到抑制。VP16是一个强的活化区域,AP1:VP16融合基因在ap1突变体中表达,使轮1成为花瓣样器官,而AP1:VP16:ufo的突变体却不能形成花瓣,说明AP1是通过UFO作用的(Jack,2004)。
花诱导还有许多问题没有解决,如AP3在ap1lfy双突变体中一小群细胞中的表达表明存在独立于AP1/LFY的激活途径。(https://www.chuimin.cn)
2.C类基因AG的起始活化
C类基因和B类基因共同作用影响雄蕊原基的形成。C类基因产物AG的结构从N端到C端分为N、M、I、K、C五个区域,N区域是抑制蛋白作用区域,MI两个区域是DNA结合和二聚体形成的区域。有N区域并有完整DNA结合和二聚体形成的区域的植株表现为ag突变体,有C区域、没有N区域并有完整DNA结合和二聚体形成的区域表现为ap2突变体表型(图4.2,Mizukami et al.,1996)。
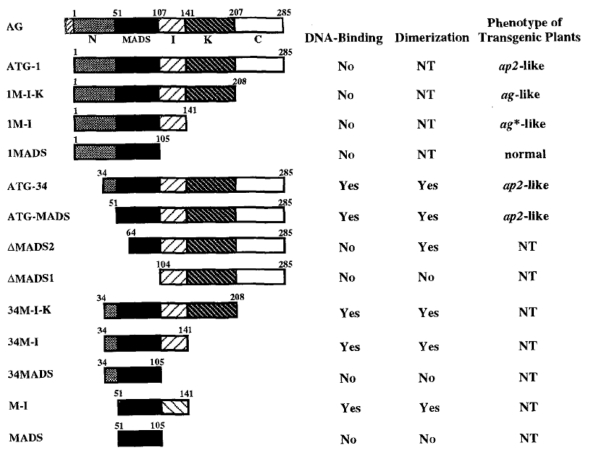
图4.2 AG蛋白功能区域示意图(Mizukami et al.,1996,ⓒASPB)
AG基因的3′增强子区域对于早期AG的激活和在心皮中的表达更为重要,而5′增强子区域在晚期雄蕊中的表达更为重要(Deyholos and Sieburth,2000)。3′增强子区域含有两对相邻的LFY和WUS结合位点(LBS和WBS),5′增强子区域含有一对假定的LBS和WBS位点,这些LBS和WBS位点对功能的实现都是必需的。在5′增强子区域还有第四个多变的LBS位点,与WBS不在一起,但其功能更重要(Busch et al.,1999;Lohmann et al,2001;Hong et al.,2003)。
C类基因AG的第二个内含子是LFY和WUS激活的作用位点,也是LUG和AP2抑制的作用位点(Deyholos and Sieburth,2000)。一个弱的ag突变体ag-4是无限花,具有花萼-花瓣-雄蕊重复分布类型。强的ag突变体ag-3是花萼-花瓣-花瓣重复类型。两个增强基因hua1和hua2的双突变可以导致ag-4的增强,产生类似于ag3的表型。HUA1编码具有6个CCCH锌指结构的核RNA结合蛋白,HUA2编码的蛋白与已知的RNA代谢酶类具有一定的相似性,参与了AG转录后的加工过程(Jack,2004)。在hua的突变体中,存在部分加工的AG mRNA,含有外显子1、外显子2、内含子2和紧随其后的多聚腺苷酸末端,但是缺乏内含子1和外显子3到7(Jack,2004)。
HEN1、HEN2和HEN4是hua1hua2的增强基因。HEN2编码DexH-box RNA解旋酶,HEN4编码含KH区域的蛋白,已经知道KH区域具有结合单链RNA的活性,HUA1、HUA2、HEN2和HEN4作用于AG mRNA的处理过程。HUA1和HEN4之间发生蛋白质之间的作用,它们以复合体的形式发挥功能。HEN4的核定位依赖于HUA1(Jack,2004)。
AP2基因是A类基因,可以抑制C类基因的表达。AP2事实上在四轮花器官中均有表达,但是在1、2和3轮的表达量要高于第4轮(Wollmann et al.,2010)。而AG主要在3轮和4轮花器官中表达,因此在第三轮花器官中,AG和AP2表达区域是重叠的。但是AP2在第三轮中并没有抑制AG的表达,这主要是因为存在miRNA172对AP2的调节作用。miRNA172表达模式正好与AP2相反,在第三和第四轮花器官中高表达,在第二轮花器官中少量表达,在第一轮花器官中表达更少。因此,在第三轮花器官中,AP2由于受到miRNA172调节,表达下降,不足以抑制AG的表达,表现出雄蕊特性。miRNA172对AP2的表达调控可以通过降解其mRNA,也可以阻止其翻译的进行(Jack,2004;Nathanael and Thomas,2014)。而HEN1基因通过作用于AP2的互补mi172RNA而调节AG的表达。
AG基因还受CURLY LEAF(CLF)、STERILE APETALA(SAP)、AINTEGUMENTA(ANT)的负调控,决定花瓣的特性(Krizek et al.,2000)。
相关文章

矮牵牛的聚伞花序是顶端开花的有限花序,花序发育中,顶端分生组织形成两个分生组织区域,顶端的一个发育形成花分生组织,侧生的一个保持花序分生组织特性,以后重复这样的分化过程。Rebocho等人通过EVG、DOT、ALF、EXP、HER、TER等几个基因在矮牵牛花序形成中的相互作用的研究结果的分析,提出了矮牵牛的聚伞花序形成的分子决定模型:有一个未知的可动因子X在侧生花序分生组织合成,抑制DOT在IM和FM的表达。......
2025-09-30

植物的花型除了上述基因控制外,还有其他一些基因在对称性和各花部的形状、大小等方面起作用。两侧花型是进化上较高级的花,背腹特性的形成也是由相应区域基因的特异表达所控制。②RAD基因抑制DIV基因在花分生组织背部的表达。相对于野生型,过量表达CYC基因的拟南芥花瓣细胞大小增加,花瓣大小增加。BOP基因的过量恒定表达在侧生器官边界区域上调LATERAL ORGAN BOUNDARIES和ASYMMETRIC LEAVES2的表达,而bop突变体中这些基因表达下调。......
2025-09-30

转录因子对基因表达的调控同样是十分重要的。这些转录因子之间发生复杂的相互作用。AG转录因子是在花分生组织中决定雄蕊和雌蕊特性的基因,从其表达开始到果实形成,一直表达,但其所受的调控和与其结合的因子在雄蕊和雌蕊是不同的,且随着果实形态的变化,表达的数量和位置发生变化,受到调控的因素及与其作用的各种因子在不同的时期和部位也发生变化,从而决定相应区域的分化结果。......
2025-09-30

拟南芥和金鱼草花序有一个相似的基因决定无限的花序分生组织向有限条件转变。黑麦的LpTFL也与TFL1与金鱼草的CEN基因结构相似,突变体表型也相似,几种其他植物中TFL类似基因结构也与TFL相似,表明在植物花序分生组织的终端决定性具有相似的分子机理。TFL1在花序和茎顶端分生组织以及幼嫩腋芽内部表达,在早期的茎顶端分生组织TFL1表达范围靠近表皮,但随着成熟范围缩小到内部。......
2025-09-30

干细胞具有细胞分裂少、未分化的原始分生细胞特性,传统植物学中称为原分生组织。WUS在干细胞区直接与分化有关转录因子基因的启动子结合,抑制它们的转录。过量表达WUS,将在器官基数上过量。而限制WUS分布范围的CLV信号转导系统任一元素的失效都会导致WUS范围扩大,相应器官数目增多。由SUPER1编码的YUCCA5过量表达引起游离IAA和生长素反应增加,造成生长素过量的表型。......
2025-09-30

造成细胞伸长的细胞学形态变化是细胞体积的增大和细胞膜及细胞壁的延展,其中也包括了细胞内容物的变化。细胞内水分的变化是细胞延长和增大的主要原因。延展蛋白有疏松细胞壁的功能,但不能改变细胞壁的塑性或弹性。......
2025-09-30

但是由于缺乏必要的遗传和分子层面的数据,有关单性植物中性染色体的确定,目前为止仍非常有限。在低等植物中,已经发现的性染色体均为异型,而被子植物中,51%的性染色体为同型,这也反映了二者在进化时间上的不同。Silence latifolia是单性异株植物,雌株和雄株中,在开始时分别以雌花两性和雄花两性发育,在成熟前两性花发育停止,形成功能性的单性异株。......
2025-09-30

使开花能够进行的途径指调节与激活开花途径的综合因子相拮抗的抑制因子的途径,其中包括增强和降低抑制因子的活性调节。图3.1植物生命周期中生殖发育的重设、抑制和促进使开花能够进行途径的概念源自对传统生理学影响开花的光周期、自控途径和赤霉素途径单、双、三突变体的综合分析。春化作用和自调控途径的一些基因通过不同的分子机制抑制和下调FLC的表达,释放它对FT和SOC1的抑制,进而使LFY和AP1可以表达,使开花能够进行。......
2025-09-30
相关推荐