光环境在整个植物生长阶段根据植物受光情况不同,有着不同的影响。植物种子的萌发和幼苗形成过程是植物的起始生长过程。植物感受到的光质和量不同,发生的反应也不同。因此植物通过感受和评定光环境,做出符合光环境的反应。其中PHYB和隐花素CRY占主导地位,子叶展开扩张,光合成系统分化。趋光素参与了植物胚轴的正向光性和负向光性弯曲。植物生长在由不同光质和光量混合光的环境中,同时激活几种光受体。......
2025-09-30
各种环境和内源信号通过激活开花途径中综合子促进开花,图3.4概括了光周期(Photoperiod or daylength)、光质(light quality)、温度对开花的影响(Boss,2004)。光周期指一天中光/暗循环照明的时间长度。伴随着对季节的适应,植物对光周期(或日长)变化的生物反应称为光周期反应(photoperiod responses)。由于植物对环境适应的不同,植物开花需要不同的光周期条件,如长日照植物(Long Day Plants,LDP)、短日照植物(Short Day Plants,SDP)、中性日照植物(Day Neutral Plants)。生物体内本身都存在类似24小时周期的生理活动,包括代谢、运动等多方面的活动,称为生理节奏(circadian rhythm)。植物中的生理节奏也同样调控生理生化、发育、运动等多方面的活动,包括对光周期的反应。

图3.4 几种促进开花时间途径的综合(CⓒASPB,Boss,2004)
1.光周期途径
光周期即日照长度和节律,植物通过其体内的光受体和生物钟感知光周期,从而引发体内的各种反应。光周期也是诱导开花决定的重要途径之一。
(1)生物钟的分子机理
生物钟或生物节律是生物体内部有节奏的昼夜变化的活动。植物的生物钟是光周期反应的内在基础。对开花时间突变体和有关基因的研究揭示了植物生理节律振荡器的分子基础。通过拟南芥中一些有关基因的相互作用和对开花时间作用的分析,人们提出了拟南芥生物节律振荡器的分子模式。生物节律振荡器由一些生物节律基因组成的互锁的反馈连锁环构成。图3.5展示了一些生物节律基因相互作用的概貌。
在这个生物钟连锁环中,CCA1(Circadian and clock associated1)、LHY(Late Elongated Hypocotyls)、TOC1(Time Of Cab Expression)组成了反馈循环的中心环。TOC1与ELF4(Early Flower 4)、LUX(LUX arrhythmo)、GI(Gigantean)、EF3(Early Flower 3)共同激活CCA1和LHY的表达,被CK2(Casin KinaseⅡ)磷酸化的CCA1和LHY抑制TOC1、GI、ELF3、ELF4、LUX的表达,从而完成了一个循环。白天表达的TOC1基因类似物prr5/7/9的表达受被CK2(Casin KinaseⅡ)磷酸化的CCA1和LHY的正调控,而这三个基因产物反过来抑制CCA1和LHY的表达,且三个基因需要共同作用(McClung,2006)。
生物钟的调控也发生在转录后水平。LHY经蛋白酶体降解调控,这与DET1有关。N-乙酰基葡萄糖氨基转移酶SPINDKY通过修饰GI影响生物节律。一个含有PAS/LOV区域、kelch重复序列和F-box的新的基因家族,包括Zeitlupe(ZTL)、Lov Kelch Protein2(LKP2)、Flavin Binding Kelch Repeat F-Box(FKF)在拟南芥生物钟途径的蛋白降解中起重要作用。LOV区域和趋光素(phototropin)相似,FKF的LOV区域受光激活,限制于光周期的调节。ZTL的表达在黄昏达到高峰而在黎明降到谷底,在白天发生蛋白酶介导的ZTL降解。Fbox通过与目标蛋白专一性结合,将目标蛋白泛素化而降解。ZTL是SCF的组成成分,结合TOC1进入蛋白降解途径,是TOC1降解的关键成分(McClung et al,2006;Yanovsky and Kay,2003)。FKF和LKP2也与ZTL共同作用,协调参与TOC1和PRR5的降解(Baudry et al,2010)。ZTL的LOV/PAS区域与生物钟和胚轴延长的红光反应有关,kelch区域影响蛋白质与ZTL在LOV/PAS和F-box区域的结合,是造成ZTL功能突变的区域(Kevei et al,2006)。而TOC1通过CCA1和LHY的抑制和经ZTL介导的蛋白质降解,是决定节律周期的关键成分(McClung et al,2006;Yanovsky and Kay,2003)(图3.5,McClung,2006)。
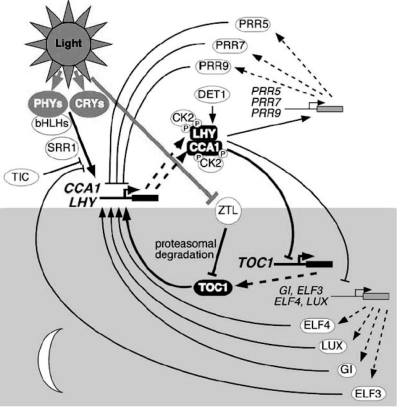
图3.5 生理钟结构与机制(ⓒASPB,McClung,2006)
(2)光质对生物钟的影响
生物钟的调控受光的调节,首先经过光受体蛋白光敏素(Phytochromes,吸收红光/红外光)、隐花素(Cryptochromes,对蓝光/紫外光反应)、趋光素(Phototropin)和ZTL/FKF1/LKP2输入光信号,光的质量也通过这些光受体发生作用。拟南芥EF3和TIC(Time For Coffee)对光的输入进行负调控。黎明和黄昏都是光调节的信号(图3.5,图3.6)。光信号输入被Sensitivity To Red Light Reduced1(SRR1)正向调控(Staiger et al,2003)。SRR1介导PHYB的信号传导(Staiger et al,2003)。另外一个bHLH(Basic Helix-Loop-Helix)转录因子光敏素相互作用因子3(Phytochrome-Interacting Factor3,PIF3)通过与CCA1和LHY的Gbox结合诱导它们的表达。在酵母中PIF3和TOC1相互作用,因此PIF3是联系光受体和生物钟关键基因表达调控的重要因子(McClung,2006)。
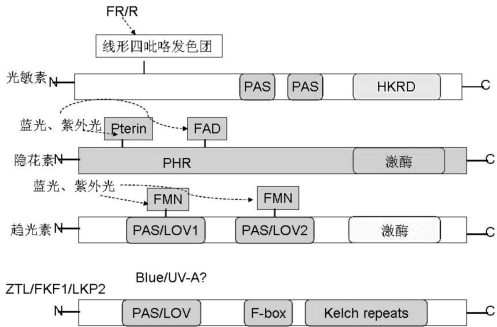
图3.6 植物的光受体结构(严海燕绘)
光敏素B(Phytochrome,PHYB)通过其C-端的PAS重复序列以活性形式与DNA结合的PIF3专一而可逆地结合,表明对光的感受直接调控生理钟的负调控分支。
隐花素通过其N端结合的蝶呤(pterin)和黄素发色团(Flavin Chromophore)接受蓝光/紫外光,光能使蛋白质构象改变,通过其C-端使COP1(Constitute Photomorphogenic 1)失活,COP1是一般光形态反应的抑制因子。趋光素的两个PAS/LOV区域结合黄素单核苷酸发色团(Flavin Mononucleotide,FMN Chromophore),蓝光的吸收触发FMN和PAS/LOV区域的半胱氨酸基团共价结合,诱导构象变化,激活C端Ser/thr激酶活性,启动信号传导系列反应(McClung,2006)。
Zeitlupe(ZTL)、Flavin-binding Kelch repeat F-box 1(FKF1)、LOV Kelch Protein 2(LKP2)具有共同的结构。其中的F-box收集要进行泛素化的蛋白,六个kelch重复序列介导蛋白和蛋白之间的相互作用,使蛋白质进行降解。光周期的光受体蛋白的作用和结构如图3.6所示。
植物的光敏素有五种形式:PHYA、PHYB、PHYC、PHYD、PHYE。PHYA在光下不稳定,是将远红光与黑暗区别的主要光受体。缺乏PHYA的拟南芥在短日条件下开花延迟。长日植物豌豆中PHYA也有相似的作用。PHYB、PHYD、PHYE在光下稳定,是短日植物水稻的主要光周期光受体。(https://www.chuimin.cn)
(3)生物钟与光周期
CO(Constants)基因在介导各种光周期信号包括光质、温度、生理钟到开花时间的调控中起重要作用。CO蛋白激活FT基因,从而促进开花。CO基因的转录和翻译受到生理钟的调控,而且不稳定。生物钟调控的FKF1控制周期性Dof转录因子(cycling Dof transcription factor 1,CDF1)的稳定性,而CDF1是CO转录的抑制因子。FKF1可能是蓝光激活,使CDF1降解,CO可以被转录。FKF1还直接与CO结合以稳定CO(Song et al.,2012)。所以在白天只有在较迟的时候才能积累到足够的转录产物进行翻译。CRY2和PHYA具有稳定CO的作用。在长日下,由于光照时间长,白天内既有转录产物也有翻译产物,而短日下,白天只有转录产物,翻译产物在黄昏后一旦形成就降解(图3.7,Hayama and Coupland,2004)。
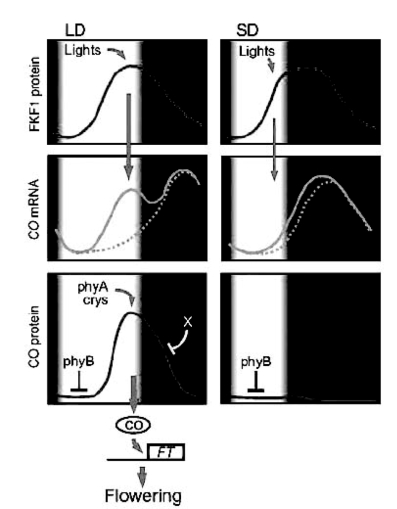
图3.7 拟南芥光测量模式(ⓒASPB,Hayama and Coupland,2004)
而在短日植物水稻中,CO类似基因HD1同时作为HD3A表达的激活和抑制因子。在光敏素激活下与光照同步表达,作为FT类似基因HD3A表达的抑制子起作用,从而抑制开花。短日下,HD1mRNA在夜晚降临时没有表达,不能够抑制HD3A的表达,但由于光敏素活性形式Pfr的存在,作为激活子的HD1形式在短日下也合成,激活子的HD1形式只有在短日长夜的转录后修饰下形成,保证长夜中激活HD3A的表达,以诱导开花(图3.8)(Yanovsky and Kay,2003;Imaizumiet al.,2005;Hayama and Coupl,2004;Hayama R.et al.,2007)。在同是短日植物的Pharbitis中,机理又有不同。PnFT无论是长日还是短日,都是在黄昏后确定时间合成,且其达到开花需要的含量需要夜长11小时以上。PnCO的合成不影响PnFT的表达,可能存在其他机理(Hayama et al,2007)。番茄中SFT同样具有促进开花的作用,但类似CO基因没有发现与开花相关(Ben-Naim et al.,2006;Lifschitz et al.,2006)。
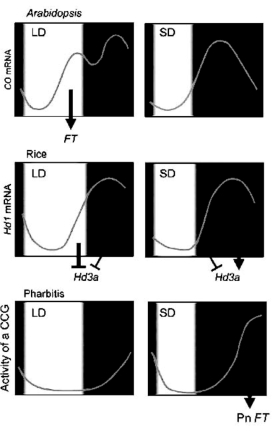
图3.8 拟南芥、水稻生理节奏模式比较(ⓒASPB,,Hayama et al.,2007)
CRY2在韧皮部促进FT合成,而韧皮部伴胞中结合在内质网的膜蛋白与FT结合(称为FT结合蛋白FTIP1)帮助FT从伴胞运输到筛管,然后运输到茎顶端分生组织(SAM)(Liu et al.,2012)。在水稻中SAM一个14-3-3蛋白作为细胞内FT类似蛋白HD3a受体,与HD3a、FD1形成复合体,诱导AP1类基因OsMADS15的表达(Taoka et al.,2011)。
(4)生物钟的温度补偿效应
环境周期性的变化中除了光/暗周期性、日照长短的变化外还有与之相应的昼夜温度和季节温度的变化,生理节奏并不因昼夜温差和季节温差的变化而有很大的改变,维持在一定的范围内,生物钟这种对温度变化有一定稳定性的反应称为温度补偿(Temperature compensation)。
最近的研究揭示了生物钟内的关键基因GI、CCA1、LHY的作用是温度补偿的分子基础(Eckardt,2006;Kevei et al.,2006;Gould.et al.,2006)。高温下TOC1和GI表达量升高、LHY表达量降低,CCA1的表达高温下对温度没有依赖性。TOC1、GI和LHY对高温的反向反应构成了高温下生理钟温度补偿效应。低温下TOC1表达量变化不大,但在gi突变体中节律周期缩短,成为12小时的周期,同时表达量降低。GI表达量低温下在节律的峰值以外升高,峰值降低,CCA1低温下野生型的表达同样变化不大,但在gi突变体中节律周期缩短,表达量下降。说明GI通过TOC1对LHY和CCA1进行温度依赖性的调控,这几个基因的共同作用在扩展保持生理节奏正常运行的温度范围中起重要作用(Eckardt,2006;Kevei et al.,2006;Gould et al.,2006)。
FLC同样是生物钟中温度补偿的重要元件,在高温下生物钟的温度补偿中起重要作用。高温下FLC引起周期的延长,由于LD和LFD基因抑制FLC的表达,突变型ld和fld同样在高温下延长周期,但与flc突变型的共突变就没有周期的变化,说明LD和LFD对周期的影响需要FLC的存在(Edwards et al.,2006)。
FLC作用的目标基因并没有上述提到的生物钟的关键基因。而其下游基因AGL20是一个重要基因。在基因组水平的研究中,132个受FLC调控的基因中,32个基因表达幅度最大,其中MYB类型的调控因子LUX(LUX ARRHYTHMO,又名PHYTOLOCK1)受FLC调控的变化有明显的周期性,并且与生物钟有关,可能在TOC1、LHY和CCA1生物钟循环中起着关闭循环的作用(McClung C.R,2006)。
2.光质对开花的直接作用
蓝光受体CRY2接受蓝光后被磷酸化,然后与CIB1结合,诱导CIB1直接与FT基因启动子E-box结合,触发FT mRNA的转录,从而直接促进开花。此外,CIB1还通过解除对CO的抑制,促进FT的转录(Liu et al.,2007)。
3.激素的作用
赤霉素是开花决定过程中的重要激素,促进短日条件下的开花,独立于春化作用,不同于光周期的作用。在一些植物中可以取代春化作用。在长日条件下对开花决定影响较小。GA信号传导途径中的一个成分Flowering promotive factor 1的过量表达和恒定激活GA信号的突变体都能使开花提前。GA合成步骤的第一步突变体,使拟南芥在短日下不开花。对GA不敏感的突变体gai在短日下开花延迟。GA处理的ga3突变体中,花器官特性基因AP3、PI、AG的表达迅速上调。RGA在幼花抑制这些基因的表达,而对LFY和AP1的表达影响不大(Yu et al,2004)。
开花关键基因LFY8bp的启动子区域是GA信号作用的一个目标,通过增加LFY基因表达促进开花。这种作用与光周期对开花的作用不同。开花途径中其他整合因子SOC1以及FT都受到GA信号途径的调控。
相关文章

光环境在整个植物生长阶段根据植物受光情况不同,有着不同的影响。植物种子的萌发和幼苗形成过程是植物的起始生长过程。植物感受到的光质和量不同,发生的反应也不同。因此植物通过感受和评定光环境,做出符合光环境的反应。其中PHYB和隐花素CRY占主导地位,子叶展开扩张,光合成系统分化。趋光素参与了植物胚轴的正向光性和负向光性弯曲。植物生长在由不同光质和光量混合光的环境中,同时激活几种光受体。......
2025-09-30

肺活量是身体发育是否健康的一个指标。探究活动活动一使用简易肺活量测量袋测量,你的肺活量有多少?活动二比较班内同学的肺活量,锻炼对肺活量有什么影响?中长跑运动员和游泳运动员的肺活量可达6000毫升。( )3.肺活量是指人体吸入最多空气后,呼出气体的量。......
2025-09-29

随着干旱胁迫程度的加深和胁迫时间的延长,4 种植物根、茎及叶片的N、P、K 元素含量分布及N ∶P 呈现出不同的变化趋势。随着干旱胁迫时间延长,甘草、牛枝子和短花针茅的P含量整体呈下降趋势。......
2025-09-30

然而多数母方印迹作用发生在胚乳的发育过程。这些不均匀分布的物质通过不对称分裂分布到子细胞的,决定未来胚发生的顶部基部极性。WOX9首次表达是在合子分裂的基部子细胞,两次横向分裂后限制在垂体细胞表达。突变体许多垂体细胞第一次分裂时期正常,细胞分裂面却异常,导致子细胞位置和形状异常。而子细胞透镜细胞和基部细胞的纵向分裂过早进行。在位置效应中,细胞之间的胞间连丝在组织和细胞之间信号传递中起重要作用。......
2025-09-30

电压过大地偏离额定值将对用户产生不良的影响。电压偏高时,照明设备的寿命将要缩短。电压偏移过大,除了影响用户的正常工作外,对电力系统本身也有不利影响。目前,我国规定的在正常运行情况下供电电压的允许偏移如下:35kV及以上供电电压正、负偏移的绝对值之和不超过额定电压的10%;10kV及以下三相供电电压允许偏移为额定电压的±7%;220V单相供电电压允许的偏移为额定电压的+7%和-10%。......
2025-09-29

应对干旱胁迫,植物生物量及其向不同器官分配比例发生的变化反映了其对生态环境的适应方式和能力。本研究中,重度干旱胁迫均会使4 种植物地上部的生物量和总生物量不同程度下降,根冠比明显提高。整体看来,在干旱胁迫后期4 种植物的地下生物量分配比例对水分变化的响应较为一致,即通过提高根冠比来适应干旱胁迫,而甘草表现的更为敏感。......
2025-09-30

沟通交流最常见、最主要的形式是语言和言语,因此本书主要根据中国大陆对沟通障碍的分类形式,分别介绍语言障碍和言语障碍的类型。构音障碍的常见类型有以下四种。常见的语流障碍包括口吃和速语症两种。速语症的主要特征为:①语速过快;②发音短促;③语音错误;④音节遗漏。存在重度语言障碍的儿童常常在沟通中出现问题,且存在口头语言障碍的儿童可能在阅读和书写上都存在困难。......
2025-09-29

科学技术是提高劳动生产力的最重要的途径,同时,科学技术又创造了越来越多、越来越神奇的“玩具”。可以说,人类科技史的每一项重大发明,都会对人类的娱乐生活产生重要影响,这些影响改善了人类的娱乐,并同时成为人类的崭新玩具:纸张与印刷品、广播、汽车、电视、电脑都是如此。......
2025-09-30
相关推荐