在新的植物体形成过程中,在母体中,父母双方提供的单倍体卵子和精子融合,形成二倍体的合子。造成组织位置效应的进行细胞间移动的物质有多肽、转录因子、小分子RNA。传统的植物学将成熟的植物组织根据其分化状态和功能,分类为分生组织、薄壁组织、保护组织、输导组织、机械组织、分泌组织。在现代植物发育过程中,分子、细胞和组织水平的研究发现植物各器官中组织分化具有相似的分子机制。......
2023-11-20
茎顶端分生组织(Shoot apical meristem,SAM)由中心的干细胞区域和周围分生组织组成。干细胞具有细胞分裂少、未分化的原始分生细胞特性,传统植物学中称为原分生组织。决定茎顶端分生组织干细胞特性的转录调控因子是WUS(Wuschel),只在分生组织干细胞中心表达。周围分生组织具有细胞分裂活性强的特点。在其周围分生组织细胞膜上分布的多种CLV(CLAVATA)类受体激酶复合物与CLV2形成复合体,并结合细胞外移动而来的小分子多肽CLV3,这类复合物激发细胞内信号转导,抑制WUS在其细胞内的表达,从而将WUS的表达范围限制在干细胞区域,继而控制干细胞区域的大小。组成这类复合物的位于质膜的结构包括膜内激酶、跨膜区域、膜外LRR受体的受体激酶CLV1、结构只有跨膜区域和膜外LRR受体的CLV2、结构只有膜内激酶和跨膜结构的CRN或SOL(CORYNE或SUPPRESSOR of LLP1-2)及CLV1类似的三种BAM(BARLEY ANY MERISTEM)受体激酶(DeYoung and Clark,2008;Zhu et al.,2010)。这些膜上受体之间形成不同组合的受体激酶复合物,其中CLV1和BAM1、BAM2协同作用,CLV2、CLV2、CRN形成复合物,CLV1、CRN形成复合物,与质膜外CLV3和CLE小分子多肽结合后通过系列磷酸化将信号转导到细胞内,控制WUS的表达(DeYoung and Clark,2008;Zhu et al.,2010)。在花药维管束形成中,BAM1、BAM2通过接收CLE信号,控制维管束范围(DeYoung and Clark,2008)。
WUS在干细胞区直接与分化有关转录因子基因的启动子结合,抑制它们的转录。这些转录因子基因有远轴及外侧特性因子KANADI1(KAN1)、KANADI2(KAN2)、YABBY3(YAB3)、ASYMMETRICLEAVES2(AS2),茎顶端分生组织中周围分生区域表达的BLH5(BELL1-LIKE-HOMEODOMAIN 5)、KNOX类的KNAT1,与叶子分化有关的保卫细胞特性基因BHLH093,维管束分化有关基因DOF2.4、AT4G24060、ANAC083/VNDINTERACTING2,皮层特性基因SCR、GRF6(Yadav et al.,2013)。WUS在茎顶端分生组织促进表达的基因有CUC1(Yadav et al.,2013),该基因可诱导茎顶端分生组织特性基因STM(Shoot meristemless)的表达(Aida et al.,1999)。STM表达后抑制自身所在CUC2的表达,因此CUC标定顶端分生组织与侧生分生组织的界限(Aida et al.,1999)。
在植物的各种生长中心,如茎顶端和花序顶端或花分生组织、侧生分生组织、根顶端的生长中心、维管束中的形成层都存在分生组织类型,都有干细胞和周围分生组织类型的细胞。而在植物中各类分生组织中都存在类似WUS的WOX家族基因,分布在不同的位置,发挥相似的作用(表1.1)(van der Graaff et al.,2009)。
表1.1 WOX家族蛋白在植物中的表达分布和功能(van der Graaff et al.,2009)
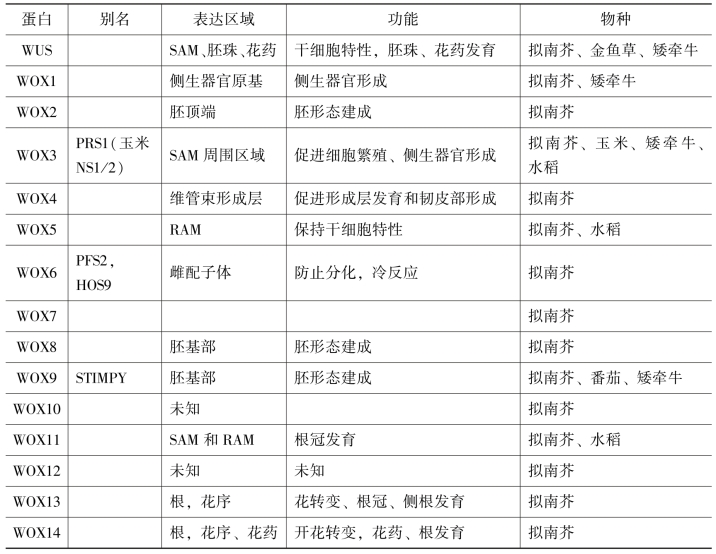
SAM-shoot apical meristem;RAM-root apical meristem
与CLV1、CLV2/CLV3相似的多肽信号转导机制CLAVATA3/ESR-RELATED(CLE)多肽、CLV系列同样也在其他部位控制相应WOX的表达范围(表1.2)(Jun et al.,2010)。如CLE8在胚和胚乳表达,抑制WOX8在其所在部位表达,使WOX8限制在胚根和胚柄表达(Fiume and Fletcher,2012)。
表1.2 pCLE:GUS在营养器官中的分布
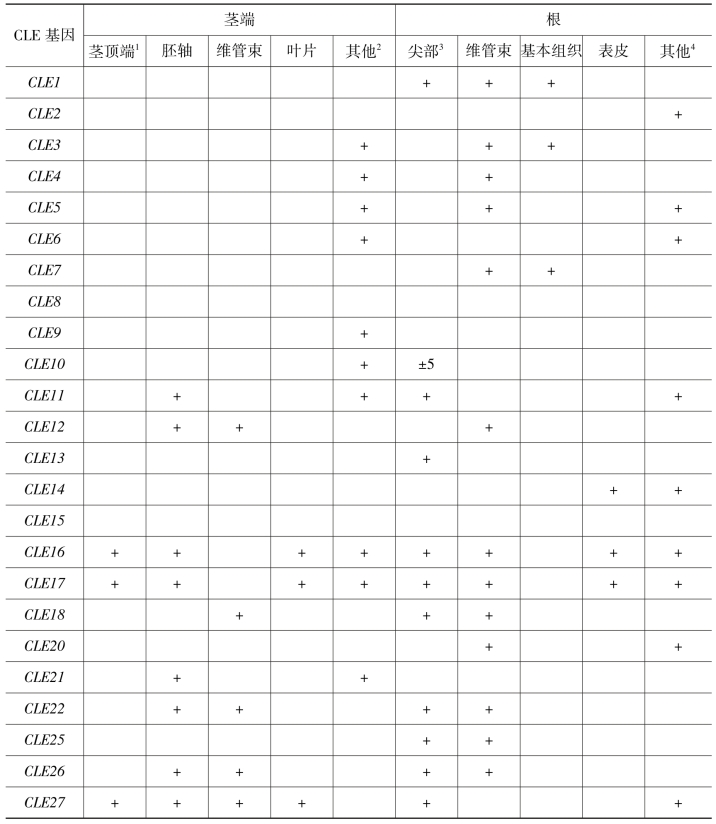
注:1.包括SAM和叶原基;2.包括髓、托叶、气孔、排水器、叶边缘、表皮毛、叶基部;3.包括根冠、分生区和细胞分裂区;4.包括根毛和侧根分支点;5.15个之中8个阳性;(Jun et al.,2010)
WUS和WOX的功能是保持干细胞特性,促进细胞繁殖。过量表达WUS,将在器官基数上过量。例如,决定雄蕊特性的AP3启动子和决定珠被特性的ANT启动子控制的WUS转基因植物分别表现出过量雄蕊数(Lohmann et al.,2001)和过量珠被(Gross-Hardt et al.,2002)的表型。而限制WUS分布范围的CLV信号转导系统任一元素的失效都会导致WUS范围扩大,相应器官数目增多。例如拟南芥果实心皮数目在clv1、clv2、clv3以及CLV类似的bam1、bam2突变体中都增多(DeYoung and Clark,2008)。(www.chuimin.cn)
ERECTA(ER)家族蛋白ER、ERL1、ERL2是具有亮氨酸重复序列的受体激酶,通过MAPK系列磷酸化进行信号转导,其下游途径激酶系列为YDA-MKK4/MKK5-MPK3/MPK6,这些激酶的突变都影响细胞的繁殖(Meng et al.,2012)。几个WRKY家族的转录因子是MAPK作用的目标。ER家族的信号途径不干涉CLV1信号途径(Shpak et al.,2003)。WUS的表达受到CK刺激而增加,CK对CLV3的表达和SAM形态影响不大,当ER突变后,CLV3的表达和SAM形态都受到很大影响,出现显著变化。因此推测以ER缓冲干细胞对细胞分裂素的反应,使其保持相对稳定(Uchida et al.,2013)。一个er-20突变体能增强jba-1D的效果,该突变体中MiR166g上调表达,引起几种HD ZIP III基因的下调,提高WUS的表达水平,从而增加SAM的范围,进一步证明ER对WUS范围的抑制(Mandel et al.,2014)。YUCCA家族是黄素单加氧酶,催化生长素的合成。由SUPER1编码的YUCCA5过量表达引起游离IAA和生长素反应增加,造成生长素过量的表型。SUPER1是部分丧失功能的突变体er-103的抑制基因,说明生长素与ER有联系(Woodward et al.,2005)。最近发现ER家族蛋白在叶原基起始中通过控制PIN1的表达,控制生长素由L1层向未来叶的中脉运输,从而影响叶的形成和发育(Chen et al.,2013)。
ER在拟南芥花茎表皮和皮层促进细胞繁殖,抑制未成熟细胞分化,保持细胞分化的同步性(Bundy et al.,2012)。三个ER(ER、ERL1、ERL2)重叠作用在拟南芥侧生器官大小、花发育(包括花瓣极性扩张、心皮延长、花药和胚珠分化)中,通过影响细胞繁殖影响器官生长和类型建立(Shpak et al.,2004)。
在干细胞周围决定细胞分生活性的是KNOTTED1 LIKE HOMEOBOX I(KNOX I)家族的转录因子,包括STM、BP/KNAT1、KNAT2、KNAT6。这类转录因子具有促进细胞分裂的活性。在茎顶端分生组织,决定分生组织特性的STM转录因子不仅通过促进细胞分裂素的合成促进细胞分裂,还促进KNAT1、KNAT2的表达。此外STM对干细胞特性基因WUS的表达是必需的,从而保持干细胞特性,保证顶端分生组织干细胞组织中心特性和顶端分生组织未分化特性(Scofield et al.,2014),从而保持顶端分生组织的结构,同时使分生组织具有自维持的特性。分生组织边缘基因CUC在染色质修饰的促进(Kwon et al.,2006)和MiR164a的抑制(Laufs et al.,2004)下将顶端分生组织和侧生器官分开,在叶中保持特定叶边缘结构(Nikovics et al.,2006)。
顶端分生组织中侧生器官的起始需要在起始原基处积累生长素和降低KNOXI的表达。拟南芥SAM和RAM中,侧生器官边界区域家族蛋白JAGGED LATERAL ORGANS(JLO)和AS2、AS1形成异源三聚体,下调KNOXI的表达,调控生长素运出载体基因PIN1表达和生长素运输(Rasta and Simona,2012)。在花分生组织,AS1、AS2、JAGGED(JAG)抑制边界特性基因CUC1、CUC2表达,促进花萼和花瓣的形成(Xu et al.,2008)。AP2类型的基因AINTEGUMENTA(ANT)在器官原基处表达,上调AP3表达,结合到YABBY类远轴特性基因YAB1/FIL启动子保守元件,与YAB1/FIL共同作用,控制侧生器官发生(Nole-Wilson and Krizek,2006)。YAB1/FIL在茎顶端分生组织周围区域器官原基起始处表达,离WUS、CLV3决定的中心区域有3到7个细胞的距离。在这两个区域之间和中心区域,表达有LATERAL SUPPRESSOR(LAS)的GRAS蛋白,部分抑制YAB1的表达。YAB1/FIL的突变引起侧生器官发生异常,说明它们通过LAS决定侧生器官的起始(Goldshmidt et al.,2008)。在侧生器官,YAB1/FIL也介导对KNOX类的STM、KNAT1、KNAT2的抑制(Kumaran et al.,2002)。
器官发育过程中,KNOX蛋白不仅通过极性基因被下调,而且通过KNOX与不同BLH的结合,以及不同BLH和不同KNOXI的空间分布和组合调控KNOX的活性,从而控制顶端分生区域和侧生器官以及叶片不同部位组织的发育,影响叶序和干细胞命运。BLH与KNOXI的结合对KNOX蛋白进入细胞核是不可缺的,拟南芥顶端分生组织中BLH RNA BEL1(ATH1)主要分布在STM分布的区域,BLH3分布在除了中心区域以外的杯形区域,包括ATH1所在区域。BLH9分布在SAM周围(Cole et al.,2006;Byrne et al.,2003),与KNAT6的分布一致(Belles-Boix et al.,2006)。KNAT6的活性依赖STM和边界蛋白CUC1和CUC2,并且与STM一起决定CUC3的表达,具有保持SAM特性和确定SAM边界的作用,而KNAT2无此功能(Belles-Boix et al.,2006)。在胚囊中,卵细胞命运由BLH1和KNAT3的组合决定(Pagnussat et al.,2007)。在花序中,ATH1和KNAT2为主,决定花序结构。KNAT2与KNAT6作用相重叠,它们受KNAT1的抑制,ATH1和KNAT1限制KNAT2和KNAT6的分布,使花序具有正确形态(Li et al.,2012;Ragni et al.,2008)。在拟南芥叶中,BLH2(SAW1)、BLH4(SAW2)通过影响KNOX的表达控制叶边缘的发育,而实验证明BLH2与KNAT1、KNAT2、KNAT5、STM可以相互作用(Kumar et al.,2007)。
分生组织特性基因KNOXI类的STM、KNAT1、KNAT2、边缘基因CUC、细胞分裂有关的周期蛋白基因CYCA1;1、CYCA2;3的表达都受到TCP类(TEOSINTE BRANCHED1-CYCLOIDEA-PROLIFERATING CELL FACTOR1)转录因子的负调控。TCP类转录因子含有60个氨基酸的TCP区域,该区域与DNA结合并形成蛋白二聚体,其碱性的N端识别DNA,接着是BHLH螺旋环区,特异识别的核心DNA序列为GGnCC。拟南芥基因组含有24个TCP基因,编码PCF(class I,PCF or TCP-P)和CYC/TB(classⅡor TCP-C)两个亚家族的TCP。TCP之间具有功能重叠性,具有剂量叠加效应。I类TCP有13个,Ⅱ类有11个。Ⅱ类TCP中,AtTCP2、AtTCP3、AtTCP4、AtTCP10、AtTCP24受JAW位点的MiR319a抑制。TCP3抑制重叠基因CUC2、CUC3的表达,与AS2相互作用,调控KNAT1和KNAT2的表达。TCP3还激活AS1、MiR164、IAA3/SHY2、SAUR的表达,间接抑制CUC和STM的表达,从而抑制细胞分裂和边缘形态。AtTCP1调控参与合成油菜类甾醇的DWARF4基因,AtTCP4调控茉莉酸生物合成基因LIPOXYGENASE2表达。I类TCP中AtTCP21/CHE(CCA1 HIKING EXPEDITION)参与生物钟活性调控,AtTCP15和AtTCP11与生物钟核心元件相互作用,同时AtTCP15还通过对细胞周期关键基因的控制调控内复制。AtTCP16参与花粉发育。AtTCP8与PNM1(PPR protein to the nucleus and mitochondria 1)相互作用,可能是线粒体和核基因组表达调控的共调控因子。AtTCP11和AtTCP20是抑制因子,对多种发育过程起作用。AtTCP14、AtTCP15在节间长度和叶型决定上发挥作用,AtTCP14在胚发生中的生长势调控中发挥作用。Ⅱ类的AtTCP3和I类的AtTCP15都与MiR164、IAA3/SHY2、SAUR启动子结合,激活它们的表达,间接调控CUC的表达,影响叶边缘特性。在I类attcp8 attcp15 attcp22 attcp21 attcp23五突变体中,STM、KNAT1、KNAT2、CYCA1;1、CYCA2;3、AS1上调表达。AtTCP7、AtTCP7-AtTCP22、AtTCP7-AtTCP23、AtTCP22-AtTCP23在体外可以直接与STM启动子中K-box结合。在AS1-AS2、KNOXI、TCP、细胞分裂关键因子的相互作用关系中可以看到,AS1-AS2复合物结合在KNAT1和KNAT2启动子中,Ⅱ类TCP与AS2结合,并且也结合在KNAT1和KNAT2启动子上。I类TCP结合在STM启动子上,抑制STM、KNAT1、KNAT 2、CYCA1;1、CYCA2;3、AS1表达,影响叶子的起始。AS1影响叶子的起始速率,叶子起始速率主要受细胞分裂影响,而TCP影响细胞分裂。因此TCP在分生组织范围和特性上是负调控因子(Aguilar-Martínez and Sinha,2013)。
植物各组织器官都有三个轴向:近轴-远轴、顶部-基部、最接近-末梢。决定近轴远轴特性的基因在植物各部位都有相似性。
近轴特性基因有AS1、2和HD ZIPⅢ类基因,远轴特性基因有YABBY类和KANADI(KAN)类型的基因。近轴特性因子和远轴特性因子在各自负责的位置抑制对方的作用。在侧生器官叶发育中,AS1、AS2与ERECTA(ER)在同一途径中决定近轴特性(Xu et al.,2003)。AS2抑制KNOX活性,同时也抑制远轴特性基因KANADI和YABBY类,以及ARF3/ETT的表达,其对近轴基因HD ZIPⅢ中的PHB略有促进(Lin et al.,2003;Takahashi et al.,2013)。而KAN1、KAN2则直接作用在AS2启动子上,与ARF3/ETT协同作用,抑制AS2的表达,决定所在位置的远轴特性(Wu et al.,2008)。在近轴远轴界限决定中,抑制近轴基因HDZIPⅢ的小分子RNA MIR165/166与FIL在叶原基中的动态分布中起重要作用。近轴处MIR165/166活跃,远轴区没有MIR165/166表达。而负责叶绿体-细胞核通讯的GENOMES UNCOUPLED1(GUN1)基因通过信号转导控制叶原基中FIL表达分布和无MIR165/166表达的状态,从而控制近轴远轴的分界(Tameshige et al.,2013)。
顶部基部极性由生长素的极性分布决定,影响生长素合成、代谢、运输、相关信号转导的因素都会影响顶部基部极性,从而影响器官形态发生。
从外向内决定花器官各部位的分布的ABC类MADS基因在其他器官发生中也有相似功能。如A类AP2类型的ANT基因在胚珠决定外侧的珠被发生以及侧生器官原基细胞表达。
有关植物发育生物学的文章

在新的植物体形成过程中,在母体中,父母双方提供的单倍体卵子和精子融合,形成二倍体的合子。造成组织位置效应的进行细胞间移动的物质有多肽、转录因子、小分子RNA。传统的植物学将成熟的植物组织根据其分化状态和功能,分类为分生组织、薄壁组织、保护组织、输导组织、机械组织、分泌组织。在现代植物发育过程中,分子、细胞和组织水平的研究发现植物各器官中组织分化具有相似的分子机制。......
2023-11-20

位点印记指从DNA结构或染色体结构上对基因的控制表现为母方或父本的表型。它们的突变体表型相似,未受精突变体胚乳和果实发育,种子不育;受精突变体种子胚乳过量繁殖,细胞化延迟,胚发育终止,最后种子不育。反之,野生型母本与met1-3/+父本杂交,大小种子各占一半,说明雄配子中MET1功能的丧失使父本印记的生长抑制基因表达,引起胚乳和种子大小减小。......
2023-11-20

纵向分裂主要发生在根毛细胞发生的位置,由表皮中控制细胞专一性的基因控制。ttg突变体在每一个表皮细胞都形成根毛,同时在根毛和非根毛部位都进行纵向分裂,表明TTG抑制非根毛部位的纵向分裂和根毛形成。图8.8决定根表皮细胞分化的网络调控在非生毛细胞N中,GL2抑制细胞向生毛细胞方向分化。由于WER在N细胞专一表达,由其控制的一些基因也是N细胞专一表达的。......
2023-11-20

当子叶分开,茎顶端分生组织形成时,只有WUS分布在表皮下分生组织中心区域。WUS与CLV系统的反馈调控环是控制茎尖分生组织正常功能的重要调控手段。STM在茎顶端分生组织中心区域和周围区域表达,不同部位表达量受到相应区域各种不同因子的控制。......
2023-11-20

造成细胞伸长的细胞学形态变化是细胞体积的增大和细胞膜及细胞壁的延展,其中也包括了细胞内容物的变化。细胞内水分的变化是细胞延长和增大的主要原因。延展蛋白有疏松细胞壁的功能,但不能改变细胞壁的塑性或弹性。......
2023-11-20

然而多数母方印迹作用发生在胚乳的发育过程。这些不均匀分布的物质通过不对称分裂分布到子细胞的,决定未来胚发生的顶部基部极性。WOX9首次表达是在合子分裂的基部子细胞,两次横向分裂后限制在垂体细胞表达。突变体许多垂体细胞第一次分裂时期正常,细胞分裂面却异常,导致子细胞位置和形状异常。而子细胞透镜细胞和基部细胞的纵向分裂过早进行。在位置效应中,细胞之间的胞间连丝在组织和细胞之间信号传递中起重要作用。......
2023-11-20

成熟雌蕊有两种心皮融合形式,其小室由中心隔膜分离。雌蕊的中间区域保持相对的未分化状态,两侧发育成包括胎座分生活性在内的组织。BEL1和其他因子对珠被形态特性有正的决定作用,缺乏可导致AG占支配地位,导致心皮样结构的出现。包括胎座、胚珠和隔膜的中间区域缺失。......
2023-11-20

果实中有三个轴的极性:中间-侧面、顶部-基部、近轴-远轴。GYM促进未分化特性基因的抑制。果荚中其他基因可能影响crc gym的性状,与CRC的功能重叠,如FIL、YAB2、YAB3表达在离轴区但不在中间区。生长素极性运输对植物的发育很关键。pin1突变干扰生长素极性运输和雌蕊的顶端基部形成,导致生长素极性运输降到15%。PID控制PIN在细胞中的极性分布,调节生长素的极性运输。......
2023-11-20
相关推荐