花卉组培程序与其他植物一样,包括以下程序。生长素和细胞分裂素的种类和浓度因花卉种类、品种以及诱导、增殖、生根等不同阶段而有所不同,经过愈伤组织和不定芽的诱导、分化及丛芽增殖培养,形成许多芽丛,最后将达到生根质量标准的小苗进行生根培养,形成具有根、茎、叶的完整小植株。......
2023-11-20
目前,仙客来多用种子进行繁殖,且种子多为杂交种,不利于优良性状的保持。组织培养能够保持植物的优良性状并且有很高的繁殖率。利用组织培养的方法建立优系仙客来的无性繁殖体系,进行种苗的工厂化育苗生产,具有恢复和保持种性、快速大量繁殖优系品种的优势,可以从根本上解决仙客来生产上的种苗质量问题。
本试验通过不同消毒时间处理仙客来叶片,确定最佳的消毒时间;通过加入不同的激素处理,筛选适宜的诱导培养基;比较活性炭和抗坏血酸两种方法,确定哪种方法可以更好地防止仙客来褐化。
(一)外植体培养
1.试验材料
采用种子无菌播种,获得无菌小苗后,取叶及小块茎作为接种材料,这样外植体污染少,易于成功。采用大植株的叶及块茎作为外植体,同样可以。现采用仙客来的幼嫩叶片为外植体。
2.试验方法
(1)外植体不同消毒时间的处理。配制MS培养基加蔗糖25 g/L、琼脂6.5 g/L,调节pH值至5.6~6.0,并将其分装、封口,和接种用的实验器具一起进行高压灭菌后接种。
本试验采用酒精表面灭菌和升汞灭菌进行接种前的消毒处理。
将升汞消毒时间设置为4个梯度:4、6、8、10 min,将叶片分组后分别进行不同时间的消毒处理。
将处理后的叶片切成1 cm×1 cm的小块接种到培养基上。1个月后统计外植体不同消毒时间后的褐化率、污染率、成活率,比较得出最佳消毒时间。
重复3次,取平均值。
表10-7-1 外植体不同消毒时间的处理(0.1%升汞)
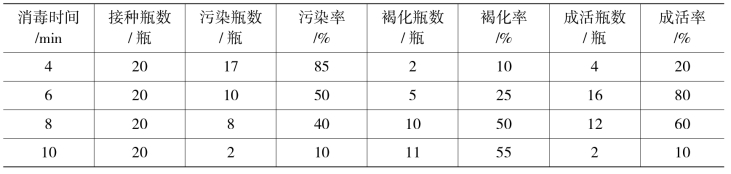
从表10-7-1可以看出,升汞的消毒时间对外植体消毒效果有明显的影响,随着消毒时间的延长,污染率降低。叶片用升汞消毒4、6、8、10 min,污染率分别为85%、50%、40%和10%。从表10-7-1还可以看出,外植体的褐化与升汞的消毒时间密切相关,升汞处理时间为4、6、8、10 min,褐化率分别为10%、25%、50%、55%,可见,随着消毒时间的延长,污染率下降,但褐化率升高。通过比较,可得出仙客来叶片外植体的最佳消毒时间为6 min。
(2)适宜外植体培养基的筛选。
①NAA的筛选:配制MS培养基加蔗糖25 g/L、琼脂6.5 g/L,以1.5 mg/L BA为基数,设置不同浓度梯度的NAA:0.5、1.0、1.5、2.0、2.5 mg/L,调节pH值至5.6~6.0,并将其分装、封口,和接种用的实验器具一起进行高压灭菌后接种。
利用试验中得出的最佳消毒时间6 min进行接种前的灭菌处理。将处理后的叶片切成1 cm×1 cm的小块接种到培养基上。1个月后统计愈伤组织诱导率,根据外植体的生长情况确定最佳的NAA浓度。
重复3次,取平均值。
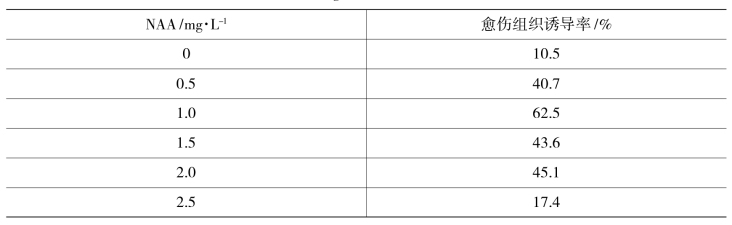
表10-7-2 以1.5 mg/L BA为基数愈伤组织诱导率
 (www.chuimin.cn)
(www.chuimin.cn)
由于BA是植物形成愈伤组织的必需激素,所以在固定了BA浓度时,由表10-7-2可以看出,当NAA浓度为0时,愈伤组织也是生长的,不过诱导率只有10.5%。在NAA浓度为1.0 mg/L时,愈伤组织诱导率达到最大值72.5%,效果也最明显。
②BA的筛选:在筛选出的最佳NAA浓度1.0 mg/L的培养基中添加不同浓度梯度的BA(0.5、1.0、1.5、2.0、2.5 mg/L),调节pH值至5.6~6.0,并将其分装、封口,和接种用的实验器具一起进行高压灭菌后接种。
将处理后的叶片切成1 cm×1 cm的小块接种到培养基上。1个月后统计愈伤组织诱导率,根据外植体的生长情况确定最佳的BA浓度。
重复3次,取平均值,并比较3种培养基中愈伤组织的增殖情况。
表10-7-3 愈伤组织诱导率
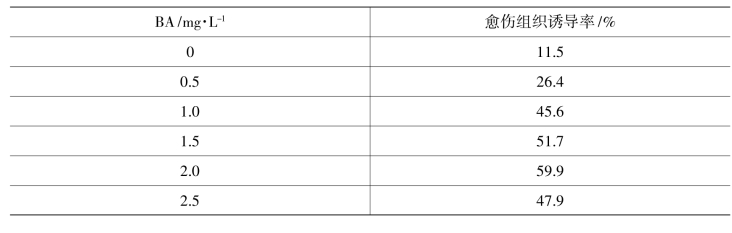
由表10-7-3可以看出,在固定NAA浓度为1.0时,当BA浓度为0时,愈伤组织也是生长的,不过成功率非常小,只有11.5%。在BA浓度为2.0 mg/L时,愈伤组织诱导率达到最大值59.9%,效果也最明显。
由上述结论可以看出,当NAA浓度为1.0、BA浓度为2.0时,愈伤组织诱导率最大,为仙客来外植体诱导愈伤组织培养基的最佳配方。
(二)增殖培养
仍以MS为基本培养基,添加3种组合的激素,即NAA 1 mg/L、BA 2 mg/L,NAA 1 mg/L、BA 4 mg/L和NAA 1 mg/L、BA 8 mg/L,将诱导出的愈伤组织分切成大小一致的小块接入培养基。增殖效果见表10-7-4。
表10-7-4 愈伤组织增殖效果

实验结果表明,随着BA浓度的增大,愈伤组织的增殖率也增大,达到最大值70.9%;随着BA浓度的增大,褐化率也不断增大,由最初的25.3%上升到53.4%。所以,最佳BA浓度以4 mg/L为最好。
(三)分化培养
诱导、增殖培养后,产生大量的愈伤组织,将上述愈伤组织转入分化培养基上,分化培养基中不加入NAA,培养20 d后,叶片愈伤组织上分化出丛生苗。块茎愈伤组织的瘤状体可以自行分离而成单独球体,其上可分化出小苗。
(四)生根培养
切开丛生苗,将单独的球体选出,接种到MS+IBA 0.5 mg/L的生根培养基上,20 d后可在苗的基部形成幼根,30 d后根长2~6 mm,有1~10条。球茎愈伤组织生长缓慢,不易生根。
(五)驯化移栽
将已生根的组培苗进行1周驯化后,在温室中进行移栽,移栽时,从试管中取出生根的小苗,用0.2%多菌灵轻轻洗掉根部粘着的培养基,要清洗干净,以防残留培养基滋生杂菌,同时避免伤根。移植时用一根筷子粗的竹签在基质中插一小孔,然后将小苗插入,注意幼苗较嫩,防止弄伤,栽后把苗周围基质压实,栽前基质要浇透水,栽后轻浇薄水。再将苗移入高湿度的环境中,保证空气湿度达90%以上,后逐渐过渡到温室自然环境,移栽成活率在80%以上。
有关植物组织培养快繁技术的文章

花卉组培程序与其他植物一样,包括以下程序。生长素和细胞分裂素的种类和浓度因花卉种类、品种以及诱导、增殖、生根等不同阶段而有所不同,经过愈伤组织和不定芽的诱导、分化及丛芽增殖培养,形成许多芽丛,最后将达到生根质量标准的小苗进行生根培养,形成具有根、茎、叶的完整小植株。......
2023-11-20

植物组培快繁的关键是植物在组织培养中再分化器官发生类型,也是组织培养中间繁殖体增殖的类型。植物组织培养中间繁殖体的类型是多种多样的,再生方式也不统一,其类型关系到繁殖速度和繁殖数量。美国红栌、叶子花、樱桃砧木等木本植物通过这种器官发生类型进行组培快繁,速度快。杨树、半夏、海棠、菊花等植物的快繁都可以通过这种器官发生类型增殖。图5-2-4原球茎发生型图5-2-5植物组织培养再分化植株的类型与繁殖途径......
2023-11-20

目前,植物组织培养已成为生物工程的一项重要技术,在基础理论研究和生产实践中发挥的作用与日俱增,可望为造福人类做出更大贡献。目前,这项技术已相当成熟,国内外科学家应用植物胚胎培养技术获得了多种远缘杂交的重组体、栽培种和杂交品种。......
2023-11-20

从此植物组织培养进入快速发展时期。椰乳成分复杂,含有多种不同的有机物,后来的研究发现,在组织培养中起主要作用的是腺嘌呤类激素或类似物。研究发现,生长素和细胞分裂素相互配合能调节细胞的分裂与分化、控制器官的分化,植物组织培养工作迅速取得突破。从此之后,一批又一批植物的组织或器官通过培养的方法获得了再生植株。......
2023-11-20

植物组培快繁过程一般可分为四个阶段,即初代培养、继代培养、生根培养和组培苗的驯化移栽。一般木本植物、较大的草本植物以茎段比较适宜,因为茎段取材容易,可在一定的培养基上通过萌发出侧芽或产生不定芽成为进一步繁殖的材料。接种后培养基上如出现微生物污染会导致培养失败。将由外植体或愈伤组织产生的胚状体进一步切割,转接于增殖培养基中,扩大胚状体数量,常用液体振荡培养方式。......
2023-11-20

指示植物法是利用病毒在一些植物上产生的枯斑作为鉴别病毒种类的方法。这些对病毒反应敏感、症状特征显著的植物称为指示植物,又称鉴别寄主。图6-3-1植物汁液涂抹法病毒鉴定示意图指示植物法最早是美国病毒学家Holmes于1929年发现的。病毒的寄主范围不同,所以应根据不同的病毒选择适合的指示植物。此外,所选指示植物应一年四季都易栽培,且在较长的时期内保持对病毒的敏感性,容易接种,并在较广的范围内具有同样的反应。......
2023-11-20

(一)胚珠培养胚珠培养是将授粉的子房在无菌的条件下解剖后,取出胚珠置于培养基上培养形成幼苗的技术。根据胚珠培养的不同目的,可将胚珠培养分为受精胚珠培养和未受精胚珠培养两种形式。因此,在进行单个胚珠培养不能成功时,常可考虑用带有胎座或子房的胚珠进行培养。如诱导未受精子房胚囊核单倍体组织发生,就需要在培养基中加入一定量的外源激素。......
2023-11-20
相关推荐