她的行为感动了天神宙斯,为了表彰她的信誉,宙斯将她的长发永久地装饰在万里星空之中。华人世界船王包玉刚对此深信不疑。良好的经营信誉,奠定了他事业上成功的基础。他把一条货船租给一个港商,期限6个月,未和他签订长期合同。包玉刚立即把船租给另一家信誉较好的航运公司,仍旧执行他的低租金长合同方针,不贪图眼前的短合同高租金。......
2023-12-01
百合为百合科百合属球根花卉,是世界著名的切花和盆花,在国内外花卉市场越来越走俏,有些百合鳞片还是我国特产的优质保健品。百合的花色、花形各异,常被人们视为纯洁、光明、自由和幸福的象征。我国虽是百合的主要分布区,但百合的生产规模并不大,主要是种球繁殖的问题。
生产中百合主要采用分球、分株芽的繁殖方法。其繁殖系数低、繁殖周期长,而且经过多代分植以后,种性退化,难以满足百合切花和盆花的生产需要。利用植物组织培养技术,快速繁殖优质、无病毒的百合种苗,将极大地促进百合花的规模化、商品化生产。

图10-4-1 百合试管苗
1.材料的选取及消毒
选择健壮、无病斑、色泽光亮的香水百合鳞片,先在浓洗衣粉水中浸泡30 min,用软毛刷轻轻刷洗干净,后用清水冲洗;在超净工作台上,放入75%酒精5~30 s,无菌水冲洗4~5次;再转入0.1%升汞溶液表面灭菌5~15 min,无菌水冲洗4~6次,接种于启动培养基上。
2.初代培养
培养基以MS为基本培养基,附加不同浓度的6-BA、NAA,设置NAA 0.5、1.0、2.0 mg/L 3个浓度梯度,6-BA 0.1、0.2、0.5 mg/L 3个浓度梯度,自由组合,共有9种配方。各配方的效果见表10-4-1。
表10-4-1 不同培养基对小鳞茎诱导的影响
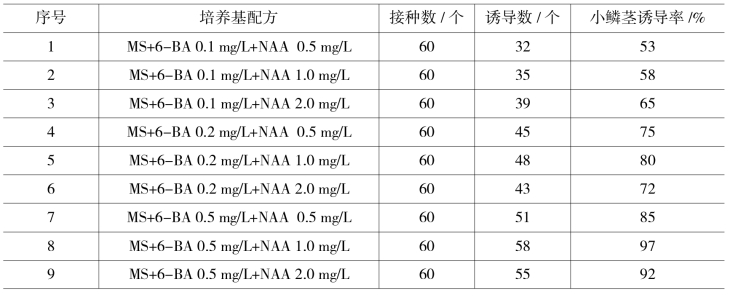
接种15 d后,外植体表面开始凸起,25 d后产生小鳞茎,每块外植体可产生5~8个小鳞茎。经过筛选,基本培养基以MS为最适培养基,秋、冬季的鳞片最易分化出小鳞茎,鳞片外植体的最适分化培养基为MS+6-BA 0.5 mg/L+NAA 1.0 mg/L。在此培养基上,鳞片产生小鳞茎的诱导率最高且苗生长良好。
3.继代培养
将初代培养产生的小鳞茎切割后分别接种于不同的培养基上。培养基中6-BA 0.5 mg/L,NAA设置5个浓度梯度:0.1、0.5、1.0、2.0、3.0 mg/L,即配方5个。接种后半个月鳞茎开始增殖,1个月后可产生大量小鳞茎,通过筛选,以MS+6-BA 0.5 mg/L+NAA 2.0 mg/L效果较好,增殖快,小鳞茎生长健壮。效果见表10-4-2。
表10-4-2 不同培养基对小鳞茎增殖的影响(www.chuimin.cn)

4.生根培养
将3~5 cm的小苗从基部切下,接种在生根培养基上,生根培养基设置6种配方,基本培养基选用1/2 MS培养基。配方及生根情况见表10-4-3。
表10-4-3 不同培养基对小鳞茎生根的影响

结果表明,IBA、NAA对百合生根均有良好的效果。
5.移栽
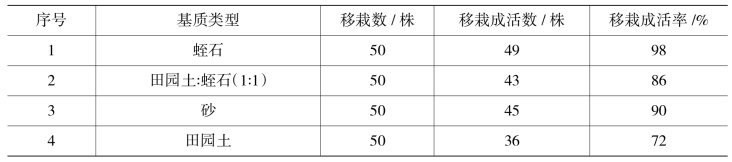
对于苗高3~4 cm的已生根且带有鳞茎的小苗,可打开瓶口炼苗3~5d,然后栽入基质中,基质设置4种配方,各配方移栽成活率见表10-4-4。保持温度15℃~25℃、湿度70%以上、50%自然光照,可得到较高成活率。所用基质首先要灭菌。如果用未灭菌的基质,小苗茎部容易受细菌和霉菌的侵染而腐烂,影响成活率;用高温灭菌的基质,小苗不容易得病,长势健壮,成活率较高。
表10-4-4 试管苗移栽成活率
6.结果与讨论
综合以上试验结果得出:6-BA主要有提高增殖系数的作用,但减小鳞茎直径,苗纤细,同时抑制植株长高和生根。NAA有促进成苗、植株长高和生根的作用,但NAA过多会使气生根增多,不利于小苗生长。所以适当地调整6-BA和NAA的浓度比,才能得到理想的结果。本试验对影响百合成苗和增殖的2种激素进行了初步研究,从中选出了利于成苗和增殖的最优组合。在培养过程中糖的浓度对试管苗结鳞茎也有影响,关于糖浓度及其调控和增加其他一些激素使百合在试管内快速结鳞茎和增大鳞茎等技术,有待于进一步研究。
有关植物组织培养快繁技术的文章

她的行为感动了天神宙斯,为了表彰她的信誉,宙斯将她的长发永久地装饰在万里星空之中。华人世界船王包玉刚对此深信不疑。良好的经营信誉,奠定了他事业上成功的基础。他把一条货船租给一个港商,期限6个月,未和他签订长期合同。包玉刚立即把船租给另一家信誉较好的航运公司,仍旧执行他的低租金长合同方针,不贪图眼前的短合同高租金。......
2023-12-01

高中生总要经历各种数不胜数、大大小小的考试,很多家长怕孩子过于紧张发挥失常,总会要求孩子放松放松再放松,殊不知一定的紧张情绪可以使学生在考试过程中做出更敏捷准确的反应。稳定好情绪,避免恶性刺激。考前当夜睡眠充足是十分重要的。每场考试,会有少数考生提前交卷,无形中给尚在考试的考生造成一种心理压力,使他们感到紧张、忙乱,因而容易出错。......
2023-08-08

公司已经走上正轨,家中父母身体健康,和李琳恩爱有加,儿子聪明伶俐。张凯看中了一个叫张阳的人,和董事会其他成员商量之后,对其进行了聘用。其次,张凯开始放权,将自己董事长的权力下放到经理和副董事长手里,公司日常的经营活动由总经理负责,涉及公司重大事项的由副董事长负责,但是要及时向张凯汇报。张凯发现,自己不在的这大半年,公司股价上涨了0.5元,而且很稳定,几乎没有波动。......
2024-01-25

1994年,李彦宏进入工业界,在道?他们跟李彦宏做了比较深入的交流,更让李彦宏坚定了走搜索之路的决心。1999年,国家邀请了一批海外留学生回国参加国庆典礼,李彦宏也在受邀之列。回国后,李彦宏发现国内的互联网已经形成了一定的规模,憋在心里长久的信念一触即发,李彦宏决定了回国创业。1999年底,李彦宏和好友徐勇一起找VC风险投资商。李彦宏毅然放弃了在Infoseek 50多万美元的股权,回国成立了百度公司。......
2024-09-24

四关卡成就百度上市此次上市,百度股分AB两类,共发售404万股美国存托凭证,占已发行总股本的12.5%。其中,百度公司发售321万股,献售股东出售83万股。重重设卡持有百度2.6%股权的Google同样没有套现。据了解,Google在百度上市时已经同意,持有的百度股份锁定期为两年。百度是首家采取这种股权配置赴美上市的公司。不过,以2004年每股收益0.05美元计,百度上市首日收盘价的市盈率2450倍,而Google虽接近300美元高位,市盈率也仅75倍。......
2024-09-24

小学三年级时,因为大哥参加青年积极分子代表大会,带回两块山东快书的板,于是我就学了山东快书。1960年的五一节在新中央剧场演出,我的表演非常受欢迎,几次谢幕才下场。这也是我表演山东快书的出发点。尤其是在内蒙古呼和浩特,那天内蒙古的领导也出席了。多年来我在自己的表演实践中,对山东快书的传说与定名及山东快书的表演艺术做了深入细致的研究与探讨。......
2023-09-01

王有龄去世,胡雪岩就等于暂时失去了一个靠山。胡雪岩对左宗棠进行了一番了解,清楚了他的为人,然后决定下一个靠山的人选就是左宗棠。胡雪岩决定,把自己购买来的一万石大米捐献给杭州城的士兵和百姓。所以,在王有龄身亡以后,胡雪岩选定了新靠山——左宗棠。所以,在选择关键人物做靠山的时候,胡雪岩的眼光可以说是精准的。......
2023-12-02

一直担任百度公司董事的符绩勋表示。百度董事会最终同意公司转型。2001年10月,百度正式推出搜索竞价排名服务。2002年12月,“闪电计划”大功告成,百度不仅在技术上全面与Google抗衡,部分指标还领先于Google。2004年初,百度董事会正式将李彦宏的职务由总裁升到了首席执行官。到2003年底,百度已经确立了自己在中国搜索引擎市场的绝对领导地位。......
2024-09-24
相关推荐