(二)真菌污染的症状及引起的原因培养基和培养物上长霉,即真菌污染现象。已污染的组织培养瓶要经高压灭菌后再清洗,防止污染源扩散。......
2023-11-20
康乃馨是石竹科石竹属多年生植物,花色艳丽,气味芳香,开花时间长,装饰效果好,是世界上最畅销的切花之一,具有较高的经济价值。由于受病毒病侵害,植株矮化,花朵变小,产生斑点,退色甚至不开花,影响切花产量和质量。通过茎尖分生组织培养,能够获得无病毒苗,以保持优质康乃馨种苗性状的稳定性。

图10-2-1 康乃馨组培苗
1.茎尖脱毒
(1)材料的选取、表面灭菌:选择品种优良、花色纯正、花形好的健壮植株做外植体。选取顶芽及时处理,逐层剥去叶,留顶部未展开的2~3对叶,在浓洗衣粉液中清洗,然后用自来水反复冲洗后,在超净工作台上切割2 cm带顶茎段,用0.1%升汞溶液灭菌8~10 min,无菌水冲洗4~5次。
(2)茎尖剥离:在超净工作台上无菌条件下用镊子及解剖刀剥去幼叶,露出顶端生长锥,移入50倍解剖镜下,用解剖刀切下0.2~0.5 mm的茎尖并带上1~2个叶原基,迅速(1~2 s)接入已准备好的培养基上。选用MS做基本培养基,附加2种激素6-BA、NAA,设置6-BA 0.05、0.1、0.5、1.0、1.5 mg/L 5个浓度梯度,NAA 0.01、0.05、0.1、0.5、1.0 mg/L 5个浓度梯度,组合成配方。康乃馨茎尖生长状况见表10-2-1。
表10-2-1 不同培养基对康乃馨茎尖生长分化的影响
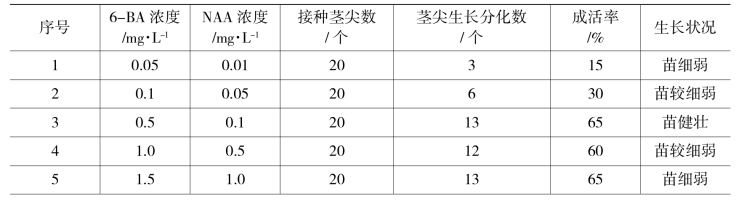
结果表明:康乃馨茎尖分化培养基以MS+6-BA 0.5 mg/L+NAA 0.1 mg/L较好。
(3)培养:接好的茎尖放到培养室中培养。康乃馨性喜光,好温凉。培养过程中控制培养室的温度在20℃~25℃,光照强度在800~2000 lx,光照时间以每天12~16 h为宜。5 d左右芽点开始转绿,1周后体积膨大,1个月左右开始展叶。再转接到相同的培养基上,50 d左右长成2~3 cm的小苗丛。当达到一定数量后,取出部分进行严格的病毒检测,经鉴定脱毒的试管苗可以进一步继代增殖。
2.快速繁殖
(1)继代增殖:试验过程中采用了两种培养基。
①固体培养基:传统的固体培养基,在培养基中加入琼脂起固定作用。康乃馨继代增殖以茎段伸长和产生芽丛比较好,繁殖速度快,变异性小,增殖率高。20~30 d可继代一次,增殖率为3~5倍。增殖固体培养基设置5种配方,各配方下生长状况见表10-2-2。
表10-2-2 不同浓度6-BA、NAA对康乃馨芽丛分化的影响(www.chuimin.cn)
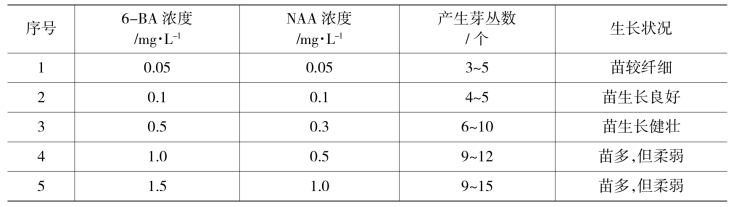
结果表明:康乃馨继代增殖配方以MS+BA 0.5 mg/L+NAA 0.3 mg/L较好,苗分化速度快而且生长健壮。
②固—液两相培养基继代培养:在固体培养的基础上,改进培养基状态——培养基中用粗粒状珍珠岩代替琼脂起固定作用,然后直接加入适宜的培养液,经过消毒灭菌后接种康乃馨试管苗。观察结果表明,在此培养基上试管苗生长速度快,苗健壮,增殖倍率高。
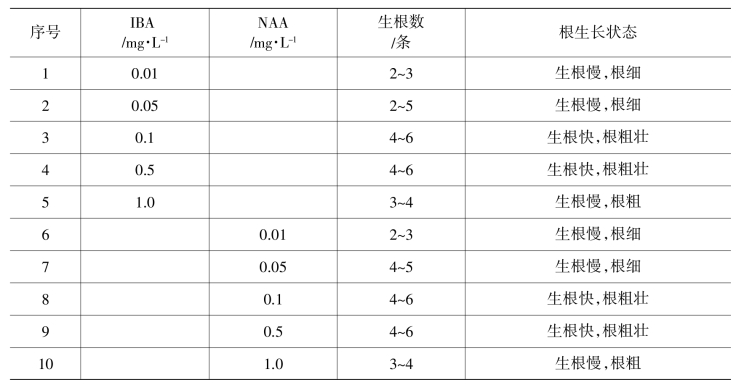
(2)生根培养:切去3 cm左右的无根嫩茎,接种到壮苗生根培养基上。1周左右生根,10 d左右生根率达90%~100%。生根培养基配方及效果见表10-2-3,以1/2 MS+NAA 0.1~0.5 mg/L或1/2 MS+IBA 0.1~0.5 mg/L效果最好。也可采用固—液两相培养基进行生根培养,试管苗吸收营养快,生根快。移栽过程洗根容易,大大提高了移栽速度和移栽成活率。
表10-2-3 不同浓度IBA、NAA对康乃馨生根的影响
(3)炼苗与移栽:试管苗生根后,连同瓶苗一起移到炼苗室,适当控制光照、温度、湿度,并逐渐打开瓶盖注入自来水进行炼苗。1周后,开始移栽。移栽时,取出的试管苗首先用0.1%多菌灵溶液清洗根部,然后栽入经过消毒灭菌的基质中。选用移栽基质时,在穴盘底部装营养基质(田园土:粗沙=1:1),上部2~3 cm装珍珠岩。
移栽后最初几天要求保持高湿(相对湿度90%~100%),可以在大棚内搭设小拱棚,每天喷雾3~4次,而且注意通风和防治病菌,可用0.1%多菌灵溶液定期(每周1~2次)喷洒。逐渐降低空气湿度,最终过渡到可在正常的温室或自然条件下生长。
移栽过程中以较高强度的散射光为好,逐渐增加光照强度。温室温度控制在18℃~20℃为宜。1个月后,进行第二次移栽,实行正常管理。移栽成活率可达95%以上。
3.试验结果分析
(1)康乃馨茎尖大小与接种成活率成正比,与脱毒效果成反比。茎尖越大越容易剥离,成活率越高,但脱毒率越低。一般用0.3~0.5 mm茎尖接种,成活率达80%左右,脱毒率达50%左右。
(2)康乃馨试管苗在培养过程中,如果条件不适宜,如温度高、光照弱、光照时数少,会产生玻璃化现象。所以加强光照、延长光照时数、降低培养室温度,可以克服玻璃化现象。在培养基中加入20万单位青霉素可减轻玻璃化现象。
(3)在1/2 MS+NAA 0.1~0.5 mg/L或1/2 MS+IBA 0.1~0.5 mg/L培养基上诱导生根时间短,根条数适中,生根率为95%~100%。
有关植物组织培养快繁技术的文章

目前,仙客来多用种子进行繁殖,且种子多为杂交种,不利于优良性状的保持。本试验通过不同消毒时间处理仙客来叶片,确定最佳的消毒时间;通过加入不同的激素处理,筛选适宜的诱导培养基;比较活性炭和抗坏血酸两种方法,确定哪种方法可以更好地防止仙客来褐化。现采用仙客来的幼嫩叶片为外植体。由上述结论可以看出,当NAA浓度为1.0、BA浓度为2.0时,愈伤组织诱导率最大,为仙客来外植体诱导愈伤组织培养基的最佳配方。......
2023-11-20

多次继代的愈伤组织中病毒的浓度下降,甚至检测不到病毒。对病毒侵袭具有抗性的细胞可能与敏感的细胞共同存在于母体组织之中。因为珠心细胞与维管束系统无联系,由其产生的植株均为脱毒植株。这一技术可以脱去柑橘的主要病毒与类病毒,包括热处理不能去除的病毒。......
2023-11-20

图10-3-1球根秋海棠试管苗图10-3-2移栽成活的球根秋海棠组培苗5.碳源种类和浓度另外,试验表明,培养基中添加3%白砂糖效果好,能有效降低生产成本。有机物质添加试验表明,添加甘氨酸3 mg/L、维生素B1 0.8 mg/L、维生素B6 0.75 mg/L、肌醇150 mg/L、烟酸0.25 mg/L等可以提高球根秋海棠试管苗繁殖系数。......
2023-11-20

植物组培快繁的关键是植物在组织培养中再分化器官发生类型,也是组织培养中间繁殖体增殖的类型。植物组织培养中间繁殖体的类型是多种多样的,再生方式也不统一,其类型关系到繁殖速度和繁殖数量。美国红栌、叶子花、樱桃砧木等木本植物通过这种器官发生类型进行组培快繁,速度快。杨树、半夏、海棠、菊花等植物的快繁都可以通过这种器官发生类型增殖。图5-2-4原球茎发生型图5-2-5植物组织培养再分化植株的类型与繁殖途径......
2023-11-20

目前,植物组织培养已成为生物工程的一项重要技术,在基础理论研究和生产实践中发挥的作用与日俱增,可望为造福人类做出更大贡献。目前,这项技术已相当成熟,国内外科学家应用植物胚胎培养技术获得了多种远缘杂交的重组体、栽培种和杂交品种。......
2023-11-20

外植体是指植物组织培养中第一次接种用的各种材料,包括植物体的各种器官、组织、细胞和原生质体等。为保证植物组织培养获得成功,选择合适的外植体是非常重要的。北海道黄杨是优良绿化树种,特别适合在北方冬季寒冷、干旱的地区栽植,因此,建立北海道黄杨的组织培养快繁技术体系,对该树种在本地区的推广具有重要作用。北海道黄杨选择健壮的植株,经室内盆栽培养一段时间后,形成当年生嫩茎,此时进行组织培养最适宜。......
2023-11-20

图3-1-1培养基成分(一)水分水分是离体植物生长所必需的成分。在培养基制备过程中所用的水必须是蒸馏水或纯水,以免水中杂质以及所含矿质元素离子对培养结果产生影响。在培养基中加入抗氧化剂可减轻褐变现象。琼脂本身不提供任何营养成分,具有无毒、可塑、遇热溶化、冷却后固形化、可使各种可溶性物质均匀分布等特性,因此是目前固体培养基中最好最常用的凝固剂。......
2023-11-20
相关推荐