实验二十四动物细胞培养用液的配制1.实验目的熟练掌握培养基、Hanks、D-Hanks液等平衡盐溶液及消化液(胰酶液)的配制方法。BSS与细胞生长状态下的pH值、渗透压及无菌状态一致,是组织培养基本用液,常用于配制培养基及其他用液,或者用来洗细胞等,细胞在BSS中可生存几个小时。用于原代细胞培养消化组织块则为0.1%或0.125%。......
2023-12-07
(一)动物细胞大规模培养的操作模式
动物细胞大规模培养方式很多,但概括起来包括悬浮培养和固定化培养、贴壁培养三大类。
1.细胞悬浮培养法
悬浮培养是细胞在培养液中呈悬浮状态生长繁殖的培养方法。其培养方式又有批量法、半连续法及连续法等。适用于培养确立细胞株、杂交瘤细胞、肿瘤细胞、血液细胞及淋巴组织细胞,用于大量生产疫苗、α-干扰素、白介素及McAb等药品。其优点在于可连续收集部分细胞进行移植继代培养,传代时无须消化分散,免遭酶类、EDTA及机械损害。细胞收率高,并可连续测定细胞浓度,还有可能实现大规模直接克隆培养。但此法不适于包括二倍体细胞在内的正常组织细胞的培养。
培养过程中,为确保细胞呈单颗粒均匀悬浮状态,需采用搅拌或气升式反应器,以较低搅拌速度及一定速度通入含5%CO2的无菌空气,保持细胞悬浮态并维持培养液溶解氧。此外不同细胞悬浮条件亦异,为使细胞不致凝集、成团或沉淀,在配制培养基的基础盐溶液中不加钙和镁离子。间歇或连续更换部分培养液,可维持pH,若使用HEPES缓冲盐溶液时可不必连续通入含5%CO2空气。
动物组织中细胞密度约为109个/mL,为自然界细胞所处最高密度状态。而体外悬浮培养细胞密度一般在5×106个/mL以下,要提高细胞产量需扩大培养规模,规模越大则控制越困难。现采用灌注培养法是较为有前途的技术,其流程包括新鲜培养基供给系统、培养罐、细胞及培养液分离系统、培养液连续收集装置等,细胞浓度可达108个/mL。
近年来,无血清培养技术因其具有安全性好、过程便于监测、技术稳定可靠、工艺放大容易等众多优点,最大规模可达到25000L,为众多生物制药同行所青睐,已成为动物细胞悬浮培养研究的热点问题。无血清培养技术的核心技术主要包括3个方面:细胞生物反应器技术、无血清培养基研制技术和工程细胞株的构建与驯化技术。
2.固定化培养法
将细胞限制或定位于特定空间位置的培养技术谓之细胞固定化培养法。动物细胞几乎皆可采用固定化方法培养。固定化方法有吸附法和包埋法。吸附法所用载体有陶瓷颗粒、玻璃珠及硅胶颗粒表面,或附着于中空纤维膜及培养容器表面;包埋法系将细胞包埋于琼脂、琼脂糖、胶原及血纤维等海绵状基质中的培养方法。固定化培养优点在于:①细胞可维持在较小体积培养液中生长;②细胞损伤程度低;③易于更换培养液;④细胞和培养液易于分离;⑤培养液中产物浓度高,简化了产品分离纯化操作。目前已开发的培养装置有多层平板装置、螺旋卷膜培养器、多层托盘式培养器、卷带式培养器、中空纤维及流化床式培养器等。除后两者外,其他装置用于细胞培养时均需多套设备,且为手工操作,缺乏工程化配套设备。
3.贴壁培养方法
大部分细胞需附着在固体或半固体表面才能生长,细胞在载体表面上生长并扩展成一单层,所以贴壁培养又称单层培养。
传统的动物细胞贴壁培养采用滚瓶培养,但滚瓶比表面积小而不利于大规模培养。如果将细胞吸附于微载体表面,在培养液中进行悬浮培养,使细胞在微载体表面长成单层的贴壁培养,这种方法称为微载体培养法或微珠培养法。这种方法由于微载体的比表面积大而特别适合于大规模培养动物细胞。
用于制备微载体的材料必需对细胞无毒而又易于贴附细胞,其密度大于1,目前已被选用的材料有DEAE-SepHadexA50及A25、QAE-SepHadex、经处理的塑料、尼龙、二甲基氨基丙基聚丙烯酰胺及聚苯乙烯等。制成的微粒直径应为100~200μm,可容纳几百个细胞。目前已有DEAE-联葡聚糖(如Cytodex 1,Superbeads)、二甲氨丙基聚丙烯酰胺(Biocarrier)及聚苯乙烯(Biosilon)等商品微粒市售。如Cytodex 1干颗粒直径为60~87μm,在培养液中可膨胀成160~230μm,每克微粒表面积约为0.6m2,相当于7个标准转瓶(Φ285mm×110mm)。
微载体培养优点在于兼有固定化培养与悬浮培养双重特点,培养过程细胞产物量与常规单层培养相同,通过增加培养罐体积即可达到扩大培养规模的目的,减少厂房及设备投资,节约动力消耗及人力,又便于对反应系统进行检测与控制。
动物细胞的体外培养有两种类型。一类是贴壁依赖性细胞,大多数动物细胞,包括非淋巴组织的细胞和许多异倍体体系的细胞都属于这一类型。这一类需采用贴壁培养。另一类是非贴壁依赖性细胞,来源于血液、淋巴组织的细胞,许多肿瘤细胞(包括杂交瘤细胞)和某些转化细胞属于这一类型。这一类可采用类似微生物培养的方法进行悬浮培养。
所谓的贴壁培养是指大多数动物细胞在离体培养条件下都需要附着在带有适量正电荷的固体或半固体的表面上才能正常生长,并最终在附着表面扩展成单层。其基本操作过程是:先将采集到的活体动物组织在无菌条件下采用物理(机械分散法)或化学(酶消化法)的方法分散成细胞悬液,经过滤、离心、纯化、漂洗后接种到加有适宜培养液的培养皿(瓶、板)中,再放入二氧化碳培养箱进行培养。用此法培养的细胞生长良好且易于观察,适于实验室研究。但贴壁生长的细胞有接触抑制的特性,一旦细胞形成单层,生长就会受到抑制,细胞产量有限。如要继续培养,还需将已形成单层的细胞再分散,稀释后重新接种,然后进行传代培养。而悬浮培养是指少数悬浮生长型动物细胞在离体培养时不需要附着物,悬浮于培养液中即可良好生长。悬浮生长的细胞培养和传代都十分简便。培养时只需将采集到的活体动物组织经分散、过滤、纯化、漂洗后,按一定密度接种于适宜培养液中,置于特定的培养条件下即可良好生长。传代时不需要再分散,只需按比例稀释后即可继续培养。此法细胞增殖快,产量高,培养过程简单,是大规模培养动物细胞的理想模式。但在动物体中只有少数种类的细胞适于悬浮培养。
从培养方式来看,动物细胞大规模培养的操作模式,大体可分用分批式操作、流加式操作、半连续式操作、连续式操作、灌流式操作等多种培养模式。这几种培养模式的优缺点见表3-5。从培养系统来看,主要采用中空纤维培养系统和微载体系统,且以灌注式连续培养方式为佳。
表3-5 常见几种动物细胞大规模培养操作模式的特点
续表
(1)分批式培养(Batch culture)作为动物细胞培养过程中较早采用的方式,分批式操作也是其他操作方式的基础。该方式采用机械搅拌式生物反应器,将细胞扩大培养后,一次性转入生物反应器内进行培养,在培养过程中其体积不变,不添加其他成分,待细胞增长和产物形成积累到适当的时间,一次性收获细胞、产物、培养基。在细胞分批培养过程中,不用向培养系统补加营养物质,而只需向培养基中通入氧,能够控制的参数只有pH、温度和通气量。因此细胞所处的生长环境随着营养物质的消耗和产物、副产物的积累时刻都在发生变化,不能使细胞自始至终处于最优的条件下,因而分批培养并不是一种理想的培养方式。在分批培养中,培养细胞按照延迟期、对数期、减速期、稳定期和衰退期5个时期生长。分批培养的周期时间多在3~5d,细胞生长动力学表现为细胞先经历对数生长期(48~72h)细胞密度达到最高值后,由于营养物质耗竭或代谢毒副产物的累积细胞生长进入衰退期进而死亡,或由于细胞内某些酶的作用而使细胞发生自溶现象。表现出典型的生长周期。收获产物通常是在细胞快要死亡前或已经死亡后进行。分批培养过程特征见图3-5。
图3-5 动物细胞分批式培养过程的特征
分批培养过程中的延滞期是指细胞接种后到细胞分裂繁殖所需的时间,延滞期的长短根据环境条件的不同而不同,并受原代细胞本身的条件影响。一般认为,细胞延滞期是细胞分裂繁殖前的准备时期,一方面,在此时期内细胞不断适应新的环境条件,另一方面又不断积累细胞分裂繁殖所必需的一些活性物质,并使之达到一定的浓度。因此,一般选用生长比较旺盛的处于对数生长期的细胞作为种子细胞,以缩短延滞期。
细胞经过延滞期后便开始迅速繁殖,进入对数生长期,在此时期细胞随时间呈指数函数形式增长,细胞的比生长速率为一定值,根据定义
式中:t为培养时间(h);X0为细胞的初始浓度;X为t时刻的细胞浓度;μ为细胞的比生长速率。
细胞通过对数生长期迅速生长繁殖后,由于营养物质的不断消耗、抑制物等的积累、细胞生长空间的减少等原因导致生长环境条件不断变化,细胞经过减速期后逐渐进入平稳期,此时,细胞的生长、代谢速度减慢,细胞数量基本维持不变。在经过平稳期之后,由于生长环境的恶化,有时也有可能由于细胞遗传特性的改变,细胞逐渐进入衰退期而不断死亡,或由于细胞内某些酶的作用而使细胞发生自溶现象。
典型的分批培养随时间变化的过程曲线见图3-6。
图3-6 典型的分批培养随时间的变化曲线
在分批培养过程中,与细胞的生长、代谢相关的主要参数有限制性营养物质浓度及其比消耗速率、细胞密度及其比生长速率、产物浓度及其生成速率、抑制物的浓度等。根据比速率的定义,分批式培养过程有下述方程:
式中:μ为细胞的比生长速率:S为底物浓度;QS为基质比消耗速率;P为产物浓度;QP为产物比生产速率。
由于分批式培养过程的环境随时间变化很大,而且在培养的后期往往会出现营养成分缺乏或抑制性代谢物的积累使细胞难以生存,不能使细胞自始至终处于最优的条件下生长、代谢,因此在动物细胞培养过程中采用此法的效果不佳。
(2)流加式培养(Fed-batch culture)分批补料式培养是指先将一定量的培养液装入反应器,在适宜的条件下接种细胞,进行培养,使细胞不断生长,产物不断形成,而在此过程中随着营养物质的不断消耗,不断地向系统中补充新的营养成分,使细胞进一步生长代谢,直到整个培养结束后取出产物。分批补料式培养只是向培养系统补加必要的营养成分,以维持营养物质的浓度不变。由于分批补料式培养能控制更多的环境参数,使得细胞生长和产物生成容易维持在优化状态。
分批补料式培养过程的特征见图3-7。分批补料式培养的特点就是能够调节培养环境中营养物质的浓度:一方面,它可以避免在某种营养成分的初始浓度过高时影响细胞的生长代谢以及产物的形成;另一方面,还能防止某些限制性营养成分在培养过程中被耗尽而影响细胞的生长和产物的形成。同时在分批补料式培养过程中,由于新鲜培养液的加入,整个过程的反应体积是变化的。
图3-7 流加式培养过程的特征
根据分批补料控制方式不同,有两种分批补料式培养方式:无反馈控制流加和有反馈控制流加。无反馈控制流加包括定流量流加和间断流加等;有反馈控制流加一般是连续或间断地测定系统中限制性营养物质的浓度,并以此为控制指标来调节流加速率或流加液中营养物质的浓度等。由于分批补料式培养的反应体积不断变化,培养过程中的各参数变化可写为:
d(VX)/dt=uVX
式中:V为培养液的体积;X为t时间时的细胞密度;u为细胞的比生长速率。(www.chuimin.cn)
(3)半连续式培养(Semi-continuous culture)又称为重复分批式培养或换液培养。指在分批式培养的基础上,将分批培养的培养液部分取出,并补充加入等量的新鲜培养基,使反应器内培养液的总体积保持不变。采用机械搅拌式生物反应器系统,悬浮培养形式。在细胞增长和产物形成过程中,每间隔一段时间,从中取出部分培养物,再用新的培养液补足到原有体积,使反应器内的总体积不变。这种类型的操作是将细胞接种一定体积的培养基,让其生长至一定的密度,在细胞生长至最大密度之前,用新鲜的培养基稀释培养物,每次稀释反应器培养体积的1/2~3/4,以维持细胞的指数生长状态,随着稀释率的增加培养体积逐步增加。或者在细胞增长和产物形成过程中,每隔一定时间,定期取出部分培养物,或是条件培养基,或是连同细胞、载体一起取出,然后补加细胞或载体,或是新鲜的培养基继续进行培养的一种操作模式。剩余的培养物可作为种子,继续培养,从而可维持反复培养,而无须反应器的清洗、消毒等。在半连续式操作中由于细胞适应了生物反应器的培养环境和相当高的接种量,经过几次的稀释、换液培养过程,细胞密度常常会提高。在半连续式培养过程,如反应器内的培养液体积为V,换液量为V',替换率D'=V'/V。对于悬浮培养,D'与比生长速率μ'有如下的关系:
(4)连续式培养(Continuous culture)是一种常见的悬浮培养模式,采用机械搅拌式生物反应器系统。该模式是将细胞接种于一定体积的培养基后,为了防止衰退期的出现,在细胞达最大密度之前,以一定速度向生物反应器连续添加新鲜培养基。与此同时,含有细胞的培养物以相同的速度连续从反应器流出,以保持培养体积的恒定。理论上讲,该过程可无限延续下去。连续培养的最大优点是反应器的培养状态可以达到恒定,细胞在稳定状态下生长。稳定状态可有效的延长分批培养中的对数生长期。在稳定状态下细胞所处的环境条件如营养物质浓度、产物浓度、pH可保持恒定,细胞浓度以及细胞比生长速率可维持不变。细胞很少受到培养环境变化带来的生理影响,特别是生物反应器的主要营养物质葡萄糖和谷氨酰胺,维持在一个较低的水平,从而使其利用效率提高,有害产物积累有所减少。然而在高的稀释率下,虽然死细胞和细胞碎片及时清除,细胞活性高,最终细胞密度得到提高,可是产物却不断在稀释,因而产物浓度并未提高。尤其是细胞和产物不断稀释,营养物质利用率、细胞增长速率和产物生产速率低下。连续式培养是指将细胞种子和培养液一起加入反应器内进行培养,一方面新鲜培养液不断加入反应器内,另一方面又将反应液连续不断地取出,使反应条件处于一种恒定状态。与分批式培养不同,连续式培养可以保持细胞所处环境条件长时间地稳定,可以使细胞维持在优化的状态下,促进细胞的生长和产物的形成。由于连续式培养过程可以连续不断地收获产物,并能提高细胞密度,在生产上已被应用于培养非贴壁依赖性细胞。
(5)灌流式培养 动物细胞的连续培养一般是采用灌流培养。灌流培养是把细胞接种后进行培养,一方面连续往反应器中加入新鲜的培养基,同时又连续不断地取出等量的培养液,但是过程中不取出细胞,细胞仍留在反应器内,使细胞处于一种营养不断的状态。高密度培养动物细胞时,必须确保补充给细胞足够的营养以及除去有毒的代谢物。灌流培养时用新鲜培养液进行添加,确保上述目的实现。通过调节添加速度,则使培养保持在稳定的、代谢副产物低于抑制水平的状态。采用此法,可以大大提高细胞的生长密度,有助于产物的表达和纯化。
对于有细胞排出的培养系统,进行物料衡算可得:
式中:V为反应器工作体积;F为培养液流入(或流出)速率;Sin为流入液中限制性营养物质浓度;S为反应器内该物质浓度,其余同前。
若令稀释率D=F/V,则可得出状态方程:
在稳定状态下,μ=D,即细胞比生长速率与稀释率相等。换言之,对于悬浮细胞的培养,当有细胞排出时,稀释率不得大于细胞最大比生长速率,否则细胞便会全部洗出。
由于连续培养过程可以连续不断地收获产物,并能提高细胞密度,因此,在生产中广泛被采用。如英国Celltech公司采用灌注培养杂交瘤细胞,连续不断地生产单克隆抗体,获得巨大经济效益。虽然灌注培养具有不少优点,但也存在培养基消耗量比较大,操作过程复杂,培养过程中易受污染等缺点。
(二)细胞培养的环境要求
细胞的生长、繁殖和代谢,在很大程度上受各种环境因素的影响。为了使动物细胞反应处于最佳状态,了解环境因素对其影响无疑是很重要的。影响动物细胞生长、繁殖的环境因素很多,主要有细胞生长的支持物、无菌条件、气体环境、缓冲环境、培养温度、pH、培养基及其他因素等方面。
1.支持物
体外培养的大多数动物细胞需在人工支持物上单层生长。在早期的实验中,用玻璃作为支持物,开始是由于它的光学特性,后来发现它具有合适的电荷适合于细胞贴壁和生长。
(1)玻璃 常用作支持物。它很便宜,容易洗涤,且不损失支持生长的性质,可方便地用于干热或湿热灭菌,透光性好,强碱可使玻璃对培养产生不良影响,但用酸洗中和后即可。
(2)塑料制品 一次性的聚苯乙烯瓶是一种方便的支持物。但制成的聚苯乙烯是疏水性的,不适合于细胞生长,所以细胞培养用的塑料用品要用γ射线、化学药品或电弧处理使之产生带电荷的表面,具有可润湿性。它光学性质好,培养表面平。除此之外,细胞也可在聚氯乙烯、聚碳酸酯、聚四氟乙烯和其他塑料上生长。
(3)微载体 大规模动物细胞贴壁培养最常用的支持物是微载体。其材料有聚苯乙烯、交联葡萄糖、聚丙烯酰胺、纤维素衍生物、几丁质、明胶等。通常用特殊的技术制成100~200μm直径的圆形颗粒,微载体的制备是一种较复杂的技术,微载体的价格一般也比较贵。但最大优点是使贴壁细胞可以像悬浮培养那样进行。微载体表面光滑,有的还在表面深层,使表面带有少量正电荷,适合于细胞贴附。微载体大多都是一次性的,不能重复使用。
支持物通过各种预处理后,可改善细胞的贴壁和生长性能。用过的玻璃容器比新的更适合细胞生长。这可能归因于培养后的表面的蚀刻和剩余的微量物质,培养瓶中细胞的生长也可以改善表面以利第二次接种,这类调节因素可能是细胞释放出的胶原或黏素。
2.气体环境
气体是哺乳动物细胞培养所必需的条件之一,所需气体主要有氧气和二氧化碳。氧气参与三羧酸循环供给细胞能量和生长组分;二氧化碳既是细胞代谢产物,也是细胞增殖所需成分,并对调节培养基pH有重要作用。一般来说,O2和CO2的浓度分别为95%和5%。氧供应和CO2移除的矛盾已成为动物细胞大规模培养过程放大与优化中亟待解决的关键问题。
(1)氧气 气相中的重要成分是氧气和二氧化碳。各种培养对氧的要求不同,大多数动物细胞培养适合于大气中的氧含量或更低些。据报道,对培养基硒含量的要求与氧浓度有关,硒有助于除去呈自由基状态的氧。在大规模细胞培养中,氧可能成为细胞密度的限制因素。
(2)二氧化碳 二氧化碳对动物细胞培养起着相对复杂的作用,气相中的CO2浓度直接调节溶解态CO2的浓度,溶解态的CO2受温度影响,CO2溶于培养基中形成H2CO3,产生H2CO3又能再离解:
由于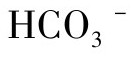 与多数阳离子的离解数很小,趋于结合态,故使培养基变酸。提高气相中CO2含量的结果是降低培养液pH,而它又被加入NaHCO3浓度所中和:
与多数阳离子的离解数很小,趋于结合态,故使培养基变酸。提高气相中CO2含量的结果是降低培养液pH,而它又被加入NaHCO3浓度所中和:
若 浓度增加,则平衡向左边移动,直到系统在pH 7.4达到平衡。如果换用其他物质,如NaOH,实际效果是一样的:
浓度增加,则平衡向左边移动,直到系统在pH 7.4达到平衡。如果换用其他物质,如NaOH,实际效果是一样的:
3.培养温度
温度是细胞在体外生存的基本条件之一,要维持培养的细胞旺盛生长,必须有恒定适宜的温度。偏离适当的温度范围,细胞会受到损伤,影响正常代谢甚至死亡。一般来说,动物细胞培养最佳温度为其体温。不同的动物细胞其最佳培养温度也不一样。例如小鼠精原细胞在34℃的条件下培养时,精原细胞增殖最多,存活时间也最长。有人还研究了培养温度对于细胞生长和细胞维持存活时间的影响。例如有人在30℃和37℃培养条件培养时,与37℃时相比,在30℃培养条件下中国仓鼠(CHO)细胞的平均比生长速率降低了92%,培养时间延长了7d,结果证明降低培养温度能够明显抑制细胞生长,延长细胞维持存活的时间。鱼属变温动物,鱼细胞对温度变化耐受力较强,冷水、凉水、温水鱼细胞适宜培养温度分别为20℃、23℃、26℃,昆虫细胞为25~28℃,人和哺乳动物细胞最适宜的温度为(36.5±0.5)℃,温度不超过39℃。细胞代谢强度与温度成正比,偏高于此温度范围,细胞的正常代谢和生长将会受到影响,甚至导致死亡。总的来说,细胞对低温的耐受力比对高温的耐受力强;如温度上升到45℃时,在1h内细胞即被杀死。在41~42℃虽然细胞尚能生存,但为时很短,10~24h后即褪变或死亡。相反,降低温度把细胞置于25~35℃时,它们仍能生长,但速度缓慢,并维持长时间不死,放在4℃,数小时后再置于37℃培养细胞仍继续生长。如温度降至冰点以下,细胞可因胞质结冰而死亡。但如向培养液中加入保护剂(二甲基亚砜或甘油),可以把细胞冻结贮存于液氮中,温度达-196℃,能长期保存下去,解冻后细胞复苏,仍能继续生长。
一般来说,变温动物细胞有较大的温度范围,但应保持在一个恒定值,且在所属动物的正常温度范围内,培养反应器既能加热,又能冷却,因为培养温度可能要求低于环境温度。
温度调节的范围最大不超过±0.5℃。培养温度不仅始终一致,而且在培养器各个部位都应恒定,在培养中温度的恒定比准确更重要。
4.pH
适宜的pH细胞生存的必要条件之一,动物细胞合适的pH一般在7.2~7.4,低于6.8或高于7.6都对细胞产生不利的影响,严重时可导致细胞褪变或死亡。不同细胞对于pH的敏感性也不同,如原代培养细胞对于pH的变动耐受性较差,可传代细胞系的耐受性反而较强。对于同一种细胞,生长期和维持期最适pH也不尽相同,对大多数细胞来说,偏酸性环境比碱性环境更利于生长,如有人研究过不同pH的培养液对兔骨髓间充质干细胞(MSCs)体外培养的影响,结果证明:培养液的pH在7.2~7.4时,MSCS生长活跃,增值速度很快;pH大于7.4时,MSCs逐渐停止增值;pH在7.1~7.19之间时,变化不大,仅增值速度稍减慢;pH小于7.1时,MSCs生长增值速度明显减慢。MSCs对碱性培养液较敏感,稍偏碱即影响细胞的增殖,对酸性环境有一定耐受。初代培养的新鲜组织或经过消化成分散状态的细胞,对环境的适应力差,此时应严格控制培养基的pH,否则,细胞难以生长。细胞量少时比细胞量多时对pH变动耐力差。生长旺盛细胞代谢强,产生CO2多,培养基pH下降快,如果CO2从培养环境中逸出,则pH升高。上述两种情况对细胞都将产生不利影响。因此,维持细胞生存环境中的pH至关重要。最常用的方法是加磷酸缓冲液,缓冲液中的碳酸氢钠,具有调节CO2的作用,因而在一定范围内可调节培养基的pH。由于CO2容易从培养环境中逸出,故只适用封闭式培养。为克服碳酸氢钠的这个缺点,有时也采用羟乙基哌嗪乙烷硝酸(HEPES),它对细胞无甚作用,主要是防止pH迅速波动,具有较强的稳定培养基pH的能力。
5.渗透压
渗透压是影响体外培养细胞生长和存活的重要因素。有些动物细胞如HeLa细胞或其他确定细胞系,对渗透压具有较大耐受性,而原代细胞和正常二倍体细胞对渗透压波动比较敏感。人血浆渗透压约290 mOsMkg-1,可视为培养人体细胞的理想渗透压,对多数细胞来说,最适培养渗透压为240~320 mOsMkg-1。但也有例外,如中华绒螯蟹血细胞在不添加血清的3×L-15培养基条件下,体外培养的最适渗透压为1100 mOsMkg-1。随着培养时间的延长,渗透压会越来越高,一般影响渗透压的主要成分为Na+、K+和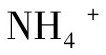 。细胞在高渗透压或低渗透压环境中,会发生皱缩或肿胀,甚至破裂,因此常用BSS溶液进行调节。
。细胞在高渗透压或低渗透压环境中,会发生皱缩或肿胀,甚至破裂,因此常用BSS溶液进行调节。
6.培养基
培养基既是细胞培养中供给细胞营养和促进增殖的基础物质,也是细胞生长繁殖的直接环境。培养基分为天然培养基和合成培养基。天然培养基从动物体液或组织中分离提取,如血浆、血清、淋巴液、鸡胚浸出液等;合成培养基是根据天然培养基的成分,模拟合成、配制的培养基。它包含细胞生长的无机盐、氨基酸、维生素、糖类等基本物质和一些特殊的添加成分结合适量添加血清,广泛应用于动物细胞培养。
7.其他因素
除上述因素外,其他因素如血清、剪切力、营养成分等对细胞也有很大影响。总之,影响动物细胞生长及产物合成的因素很多,在具体的培养过程中,需要视情况优化培养工艺。
有关食品生物技术的文章

实验二十四动物细胞培养用液的配制1.实验目的熟练掌握培养基、Hanks、D-Hanks液等平衡盐溶液及消化液(胰酶液)的配制方法。BSS与细胞生长状态下的pH值、渗透压及无菌状态一致,是组织培养基本用液,常用于配制培养基及其他用液,或者用来洗细胞等,细胞在BSS中可生存几个小时。用于原代细胞培养消化组织块则为0.1%或0.125%。......
2023-12-07

动物细胞培养技术作为现代生物医药产业的核心技术,近十年来随着抗体药物、病毒疫苗、抗生素等的需求量不断增加,以及越来越多的新产品进入临床研究,取得了前所未有的发展。动物细胞大规模培养技术是生物技术制药中非常重要的环节。......
2023-11-18

冷饮水供应系统应设置循环管道,避免水流滞留影响水质,循环回水也应进行消毒灭菌处理。图3-4-1 饮用净水的处理流程2.饮水系统设置要求饮用开水和饮冷水的用水量应按饮水定额和小时变化系数计算。③管道直饮水系统必须独立设置。......
2023-08-30

实验二十三动物细胞培养器皿的清洗与灭菌1.实验目的学会细胞培养的各种器皿的清洗与消毒。体外培养细胞所使用的各种玻璃或塑料器皿对清洁和无菌的要求程度很高。细胞培养的好坏直接与细胞培养器皿清洗的彻底与否有很大关系。③干热灭菌主要用于玻璃器皿的灭菌。将用于细胞培养的器皿放入干燥箱内,加热至160℃,保温90~120分钟。用于RNA提取实验的用品则需180℃,保温5~8小时。......
2023-12-07

目前所有细胞培养室都已采用经标准化生产、组分和含量都相对固定的各种合成培养基,如Eagle基本培养基,简称MEM,是由13种必需氨基酸、8种维生素、葡萄糖和无机盐所组成。大多数动物细胞培养必须在培养基中添加血清,但在许多情况下,细胞可在无血清条件下维持和增殖。目前合成培养基的配方都已相对固定,并形成配制好的干粉型商品。......
2023-11-18

原则上,每个自动化工序都有不同的精度要求。在这种情况下,工件位置不再精确地集中在手指之间,这可能导致连接操作中的精度问题。由于对抓取或放置精度的要求如此之高,因此应相应地调整一般条件,以避免此类错误。图3.117用公差角度来审视系统对于抓取或者放置来说十分重要摄像机测量误差可能具有不同的性质。当涉及在装配过程中对工件的纯搬运时,或如图3.117所示,当相当多的因素影响精度时,这些考虑尤其重要。......
2023-06-15

②一级负荷的设备的供电电源应在设备的控制箱内实现自动切换,切换时间应满足设备允许中断供电的要求。③二级负荷的供电应由双电源供电,当一路电源发生故障时,另一路电源不应同时受到损坏。①根据进出线回路数、设备特点及负荷性质等条件确定;②满足供电可靠、运行灵活、操作检修方便、节约投资和便于扩建等要求。......
2023-09-29

2Z105040 施工现场文明施工和环境保护的要求2Z105041 施工现场文明施工的要求文明施工是指保持施工现场良好的作业环境、卫生环境和工作秩序。一、施工现场文明施工的要求(了解)文明施工应贯穿从项目部进场至施工结束后的清场。施工现场应设置卫生间,并有水源供冲洗,每日有专人负责清洁。 禁止施工现场焚烧有毒、有害烟尘和恶臭气体的物资。 施工现场化学药品、外加剂等要妥善入库保存,防止污染水体。......
2024-01-20
相关推荐