唯物主义的确是自然主义的,但自然主义却并不一定是唯物主义的。我们主要是从自然主义的积极方面来分析希腊文化的这一特征的。希腊的自然主义首先兴起于公元前6世纪米利都自然哲学学派,即受奥尼亚学派。......
2023-12-07
薛定谔方程之于原子物理学,堪比牛顿运动定律在经典力学中的地位。早在17世纪,改变物体的运动需要外力作用的理论已为人所知。但缺乏一种精确计算方法,告诉我们任何给定物体的运动状态将如何随着外力作用而发生改变。牛顿找到了一种简练的表达式,看似简单(物体受到的外力等于其质量与加速度的乘积,即F=m×a),却能够广泛解释复杂的运动。
初学物理学的人也会知道,仅找出作用力是不够的,还必须揭示出这些力如何使物体的运动状态发生改变。有了牛顿运动定律,我们就能够确定万物的运动轨迹,从滑雪者到船行者,从跑步的人到汽车,从发射到月球的火箭到月球本身(更不用说从树上掉下来的苹果了)。我们知道牛顿运动定律是正确的,因为它对运动的计算结果完全符合实验观测的结论。
同样地,在量子领域,不能仅找到与物体运动相关的波,还需要一个方程。如果知道作用于物体的外力大小,就可以通过这个方程计算出外力作用对“物质波”的影响。
一个简单的氢原子,由原子核内的一个质子以及与质子之间存在静电吸引力的一个核外电子组成。在《守望者》漫画及电影中,曼哈顿博士额头上的符号就是一个氢原子模型。鉴于我们已经知道带负电荷的电子和带正电荷的原子核之间的静电吸引力的本质,也知道存在一种与原子中电子运动相关的波,那么我们需要的是一个“物质波方程”,它能够计算出原子中电子的性质。其计算结果,如原子的平均直径或电子的平均动量,可以与实验观测结果进行对比,以检验物质波理论的正确性。从物理学的角度讲,任何不能用实验检验的方程都是没有意义的。
尽管波函数方程比牛顿的F=m×a复杂得多,薛定谔还是找到了这样的方程。事实上,除个别简单情况外,人们经常需要用电脑来解薛定谔方程。然而,计算上可能存在的困难并不能证明方程是错误的。应用牛顿的F=m×a计算一个房间中超过1024个空气分子的加速度,会超出世界上最大的超级计算机的计算能力。虽然无法完成运算,但我们知道这样的运算在原则上是可行的。薛定谔方程的重要性在于,根据物体的相关作用力,我们可以计算出物体的波函数。尽管运算方法很复杂,但求解路径是清晰的。
我们将跳过薛定谔方程的产生过程,跳过那些数学实验和错误、物理上的直觉,跳过对能量守恒定律的创造性应用。因为真正令我们感兴趣的是量子力学如何为我们带来了以发光二极管、笔记本电脑、手机和遥控设备为代表的“未来”生活方式。对我们而言,薛定谔方程的形成过程并不重要,我们也不会尝试着去解方程,即使是单个电子在真空中沿直线运动这种最简单的情况。薛定谔方程包含在空间和时间上波函数的变化率,因此需要借助微积分来求解。此外,它还涉及虚数(负数的平方根)。我们真正需要做的是讨论薛定谔方程的意义,并指明不同的解如何促进了半导体晶体管的发明,或者半导体激光器的发明。
言归正传,薛定谔方程最常见的数学表达式如下:
-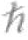 /2m∂2Ψ/∂x2+V(x,t)Ψ =i
/2m∂2Ψ/∂x2+V(x,t)Ψ =i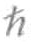 ∂Ψ/∂t
∂Ψ/∂t
其中,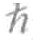 是我们熟悉的普朗克常数(
是我们熟悉的普朗克常数(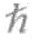 是一种数学上的缩写,表示此处的普朗克常数值应该除以2π,即
是一种数学上的缩写,表示此处的普朗克常数值应该除以2π,即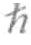 =h/2π),m是我们对其波函数(Ψ)感兴趣的物体的质量(通常是电子的质量),V在数学上代表作用在物体上的外力,i是-1的平方根[1]。Ψ随时间的变化率表示为∂Ψ/∂t,Ψ随空间的变化率表示为∂Ψ2/∂t 2。这个方程看上去既烦琐又复杂,在这里我对它进行了简化处理,将它变成简单的一维形式:电子只能沿直线运动。用这个版本的方程解释三维运动需要一些附加条件,但我们不会去求解这个方程。
=h/2π),m是我们对其波函数(Ψ)感兴趣的物体的质量(通常是电子的质量),V在数学上代表作用在物体上的外力,i是-1的平方根[1]。Ψ随时间的变化率表示为∂Ψ/∂t,Ψ随空间的变化率表示为∂Ψ2/∂t 2。这个方程看上去既烦琐又复杂,在这里我对它进行了简化处理,将它变成简单的一维形式:电子只能沿直线运动。用这个版本的方程解释三维运动需要一些附加条件,但我们不会去求解这个方程。
已知原子中电子所受的作用力,我们就可以通过求解薛定谔方程计算出电子的可能位置以及它们的能量值。在薛定谔方程中,物理量V代表外力对电子所做的功,它可以改变电子的能量。出于一些暂时无须深究的原因,V实际上指作用在电子上的“势能”。
在一般情况下,这些力随时间和距离而改变。在方程式中,符号V(x,t)表明这些力与势能V随时间t和空间x的变化而变化,V(x,t)表示在不同的位置x和不同的时间t,V可以取不同的值。有时,作用力不会随时间而改变,如带负电荷的电子和原子核中带正电荷的质子之间的静电吸引力。在这种情况下,我们只需要知道静电力如何随两个电荷间的距离发生变化,就可以确定空间中所有点的势能V。
我一再强调,V的值取决于空间位置x和时间t。对V有实质性影响的因素也会对波函数Ψ产生实质性影响。在数学上,如果一个表达式的值不是固定的,而是随地点和时间的不同而改变,这样的表达式就被称为“函数”。看过地形图的人都能理解函数的概念,地形图上的不同区域会用不同的颜色来表示,代表不同的海拔高度。这就是为什么Ψ被称作“波函数”。通过这个数学表达式,我们知道物质波的值取决于电子的位置(x)和测量时间(t)。在下一章中,我们将探讨海森堡的理论,谈一谈微观世界的物质在时间和空间上的“不确定性”。
对于一个靠近质子的电子,就像在氢原子中那样,电子受到的唯一作用力是静电吸引力。因为静电吸引力的作用不随时间发生变化,所以势能V只取决于空间中两个电荷之间的距离。因此,我们可以通过解薛定谔方程,得到与特定的势能V相对应的波函数形式。波函数Ψ也是一个数学函数,它的值随空间位置的变化而不同。然而,发生了一桩怪事(量子物理学领域的“怪事”不胜枚举):当薛定谔第一次将这个方程应用于氢原子时,他对“Ψ”代表什么的理解竟然是错误的!
薛定谔认为,Ψ不可能是与原子内部电子相关的物理量,这是因为他推导得出的关于Ψ的数学方程涉及虚数i。这看起来很可笑,因为物理上的任何可观测量必须是实数。但是,通过一些数学方法,我们可以消去数学函数中的虚数。比如,得到波函数Ψ后,对它求平方,即让它和自身相乘(Ψ×Ψ=Ψ2,读作“psi/泼赛”平方),我们会得到一个新的数学函数Ψ2。我们为什么要那么做?我们应该对数学函数Ψ2做出怎样的物理学解释?(www.chuimin.cn)
薛定谔注意到,在完整的三维形式的物质波方程中,Ψ2的物理单位是体积分之一,而波函数Ψ的单位是1/(体积1/2),这就是考虑Ψ2而不是Ψ的原因。单位是1/体积的量具有物理学意义,而单位是1/(体积1/2)的量则无法测量。薛定谔认为,如果Ψ2和电子的电荷相乘,将得出单位体积的电荷,即电子的电荷密度。这看似合理,却是错误的。Ψ2的确拥有数密度的形式,但是薛定谔对于方程解的物理意义的诠释是不正确的。
在薛定谔提出物质波方程的同一年,马克斯·玻恩指出,Ψ2实际上应该代表电子在原子内部的“概率密度”,即在原子内部任意点上发现电子的概率。薛定谔认为这是无稽之谈,但玻恩的解释在学术界得到了广泛认可。
薛定谔方程对于量子力学的意义等同于牛顿公式对于经典力学的意义。牛顿指出,从本质上说,已知施加在物体上的合力,就可以算出未来某一时刻物体在空间中的位置。薛定谔则声称,已知势能V,就能算出在过去、现在或未来的某一时刻,在某个位置上找到该电子的概率。
已知在空间中的各个位置上发现电子的概率,就能计算出该电子与原子核内质子之间的平均距离,我们将这个距离称作原子的尺寸。事实上,原子内的能量、它的平均动量,以及任何我想测量的物理量,都可以用薛定谔方程来计算。我们知道薛定谔方程是计算原子内电子的波函数Ψ的正确方法,因为根据薛定谔方程计算出的原子性质与实验观测结果非常吻合。这是检验理论的唯一有效方式,也是我们看重物质波和波函数概念的唯一原因。
起初,薛定谔将他的方程应用于最简单的原子——氢原子,其原子核内只有一个质子,核外也只有一个绕核运动的电子。对于作用在电子上的力,他使用了人们熟知的静电吸引力定律,这个定律对两个异种电荷间的相互作用的准确描述已得到广泛证实。求解的过程不涉及其他假设和临时性的猜想,他通过解方程得到了一组可能的解,即一组不同的Ψ函数,对应于电子的不同概率密度。这与被拨动的琴弦产生一组不同的可能波长的情形类似。对于每一个概率密度,都对应着一个不同的平均半径,以及一个不同的能量值。显然,氢原子中的单电子在任何时间点都只能有一个能量值和一个平均半径。薛定谔发现电子具有一组可能的能量值,其排列方式和大型报告厅的座位排列方式很像(如图6-1所示)。第一排座位离前面的黑板比较近,下一排座位距离黑板稍远,以此类推,一直到距离黑板很远的座位,坐在那里的学生可以轻而易举地溜出教室。
图6-1 用薛定谔方程求得的单电子原子可能的量子态示意图,表示为电子在报告厅中占据的座位。在这个类比中,报告厅前部,也就是图6-1的底部,是带正电的原子核所在的位置。吸收或释放能量时,电子会从一排跃迁至另一排
只有一个电子的原子好比只有一个学生的报告厅。如果这个报告厅有一定的倾斜度,前低后高,那么这名学生可以通过坐在最前排座位来降低他(她)的能量,此时这名学生处于最低能量状态。与此类似,薛定谔发现单个电子的概率密度与其最低能量值相对应,原子的这种结构被称为“基态”。如果电子吸收了额外的能量,比如吸收光或与其他原子发生碰撞,那么它可以从最前排的座位跃迁至更远的座位。(当电子有了足够的能量时,它可以彻底离开报告厅,成为一个自由电子,而留下一个带正电荷的离子对简单的氢原子而言,它会变成一个质子)。
薛定谔方程一次性地解释了为什么原子只能吸收特定波长的光。对原子中一个带正电荷的原子核吸引的电子而言,只有特定的能量值对应于薛定谔方程的有效解。电子通常处于最低能量状态——基态。从原子外部吸收能量后,它们可以从报告厅最前排的座位移动到较靠后的一排,离出口更近,只要那里有空位。那些还记得高中化学知识的人可能知道,每一个“座位”实际上可以容纳两个电子。电子所在排和它即将移至的那排之间存在精确的能量差,电子必须从一个座位移动到另一个座位,而不能在排与排之间停留。不同原子的原子核内有不同数目的质子,相应的Ψ函数也会略有不同,正如吉他上的每根弦都有不同的基本频率和泛音。
薛定谔方程带来了一个有趣的结果:在一个原子中,除特定能量值外,电子的其他能量值都是被“禁止”的。薛定谔方程的解与电子的圆形或者椭圆形轨道无关,而是关于电子的各种可能的概率密度。换句话说,一个电子有“禁止能量”值的可能性为零,我们永远也观测不到被“禁止”的能量状态。
只有当提供给原子的能量(例如,以光的形式)恰好等于排之间的能量差时,电子才能跃迁至另一排。因此,当电子从一排跃迁至另一排时,任何特定的原子都会吸收或发射某个波长的光,其他的光则会被原子忽略。
最值得注意的是,当薛定谔在方程中输入氢原子中质子和电子间的静电吸引力时,他得到了一组对应于不同概率密度的可能的波函数。在确定Ψ符合“归一化”特点(也就是我们常说的将电子在空间各处出现的概率相加,总数是1)后,薛定谔通过解方程得到了一组可能的电子能级,这与在实验中观察到的氢原子的能级跃迁完全一致。无须轨道假设,也不用忽略电子绕圆形轨道运动会辐射能量的事实,你只要将原子中带负电荷的电子和带正电荷的原子核间的相互作用力输入薛定谔方程,它就会自动告诉你光的吸收或发射可能产生的线性光谱。
薛定谔方程彻底否定了电子绕椭圆轨道运行的假说,并代之以在空间中的某个点找到电子的概率密度。在本质上,物理学又回到了认识的原点。20世纪初,科学家们曾认为原子就像一个带正电荷的实心布丁,电子则是嵌在布丁表面的棉花糖。在这个模型中,原子吸收和发射特定波长的光,这个波长对应于受到限制的电子的基本振动频率。卢瑟福证明原子有一个小的带正电荷的原子核,电子绕原子核进行轨道运动。但是,这个模型无法解释电子为什么不呈螺旋状坠入原子核,也无法解释线性吸收光谱。薛定谔的原子模型保留了小的带正电的原子核,但带负电的电子则像果冻一样以“概率密度”的形式“涂抹”在原子核上。当薛定谔在阿尔卑斯山上一边进行科学研究,一边寻欢作乐之时,沃纳·海森堡则独立地提出了电子位置的“不确定性原理”。
[1]按照数学惯例,一个正数与一个负数的乘积是一个负数,两个负数的乘积是一个正数,任何实数的平方都不为负。我们当然可以想象存在这样的数,但是它们不在我们处理的实数范围之内,因此被定义为“虚数”,并以小写的字母i表示,因此i× i=-1。
有关魔鬼物理学2:迷人又有趣的量子力学的文章

唯物主义的确是自然主义的,但自然主义却并不一定是唯物主义的。我们主要是从自然主义的积极方面来分析希腊文化的这一特征的。希腊的自然主义首先兴起于公元前6世纪米利都自然哲学学派,即受奥尼亚学派。......
2023-12-07

所幸学术界的认识在变化,台北中山人文社会科学研究所于1983年开始推行中国海洋发展史研究计划,无疑拉开了中国海洋史研究序幕,该所此后每两年举办一次研讨会,并出版会议论文集。大力开展海洋史研究需要具备若干条件,这就是:继续提高对海洋史研究重要性的认识。......
2023-07-02

通过无人机来真正使用这些理论,看一看物理学和数学是如何与无人机姿态变化相关联的,深奥的控制算法是如何通过编程语言实现的,看似繁杂的机器人硬件有着什么样的数学本质呢?通过无人机,可以让这些知识不只停留在考卷中,更能够在读者的脑海中形成具体的感知,让理论显现出确实的价值和意义,如此一来还需要什么其他的刺激因素么?赶紧抱着被子去图书馆通宵达旦吧,通过无人机你会发现那些枯燥的知识也是有生命力的。......
2023-07-05

循水道,海鳟一英寻一英寻地深入比较寂静温暖的海域,那里有密生的水草随潮摇曳,潮水的压力没有沙洲上的大。退潮时,沿海谷底层摩擦后退的水会搅起沙,带走空贝壳,在缓坡上跌撞翻滚而下。海鳟进入谷中时,海湾北面的蓝蟹从它们下方穿过。夜幕初降、退潮开始时,海鳟进入海谷。趁着下一次退潮,咕噜咕噜鱼出了水道,去大海中寻更温暖的地方。海鳟则流连不愿离开。每次退潮,潮水带入河中新水,海鳟躺卧的水道便更加寒冷。......
2023-10-18

审美的缺失最直接的后果就是学生在学习过程中观察能力、分析能力、心理调节能力和自我评价能力的缺失。长此以往,美术教师自身也不愿意做出改变,对新的课堂教学模式提不起兴趣,课堂上习惯墨守成规。学生对美术教育的认识存在以下误区,从而影响了其审美能力的培养。......
2023-07-23

参军戏的对话法,也很像现在的相声。唐“参军戏”与相声近似乃至酷似属于客观存在,在这方面,不同论者之间并无分歧,而分歧在于“说法”和“现身”方面。因此,“参军戏”和相声之间的渊源关系是应当予以肯定的。具体说来,上一节归纳的“参军戏”的特点都在后世相声中有着鲜明的体现,在侯宝林、薛宝琨、汪景寿、李万鹏所著《相声溯源》中有阐明,可参照。与唐“参军戏”一脉相承的宋“滑稽戏”也与相声艺术有着明显的渊源关系。......
2024-06-06

本论文试图通过对韩邦奇哲学思想的剖析,丰富明代哲学发展历程的研究。目前关于韩邦奇的文献资料整理和哲学思想的全面研究,在学术界还没有全面的涉及。此两篇文章都是在主要研究《正蒙拾遗》的基础上考察韩邦奇哲学思想,而还没有在综合韩邦奇所有文献资料的基础上作考察。......
2023-11-28

尼日尔河从西面流进乍得湖,后由东流出,最终汇入尼罗河。于是,他们决定兵分两路,第南沿着沙里河往东南方向行进,而克拉伯东和乌得涅则设法通过哈沙族统治的地区,向西而行去寻找尼日尔河。克拉伯东和乌得涅两人企图通过卡诺前往卡西那,但在这一段的旅途中,乌得涅死于一种不知名的疾病,克拉伯东独自一人走完了到卡诺的路程。于是,克拉伯东断然拒绝了穆罕默德·贝尔罗的建议,要求去探寻尼日尔河。......
2023-07-23
相关推荐