肠道菌群对身体有方方面面的影响,调节体重、影响胃口仅仅是肠道菌群的基本功能。对于人体来说,维持肠道菌群的正常平衡,是保证身体健康的重要一环。如果在肠胃中占据主导地位的肠道菌群健康而稳定,就能抑制致病菌的侵扰。在科学家看来,代谢发生异常,离不开失衡的肠道菌群。如果长期吃高脂高糖的食品,肠道菌群中的致病菌会增加,益生菌则会减少,很容易使从食物中摄取的能量转化为脂肪,从而为人类带来体重增加等肥胖问题。......
2023-10-28
糖尿病是一组以高血糖为特征的代谢性疾病。高血糖则是由于胰岛素分泌缺陷,或其生物作用受损,或两者兼有引起。长期存在的高血糖导致各种组织,特别是眼、肾、心脏、血管、神经的慢性损害、功能障碍。它的主要病因,第一是遗传因素,1型或2型糖尿病均存在明显的遗传异质性。糖尿病存在家族发病倾向,1/4~1/2患者有糖尿病家族史。临床上至少有60种以上的遗传综合征可伴有糖尿病。1型糖尿病有多个DNA位点参与发病,其中以HLA抗原基因中DQ位点多态性关系最为密切。在2型糖尿病已发现多种明确的基因突变,如胰岛素基因、胰岛素受体基因、葡萄糖激酶基因、线粒体基因等。第二是环境因素,如进食过多,体力活动减少导致的肥胖是2型糖尿病最主要的环境因素,使具有2型糖尿病遗传易感性的个体容易发病。1型糖尿病患者存在免疫系统异常,在某些病毒如柯萨奇病毒、风疹病毒、腮腺病毒等感染后导致自身免疫反应,破坏胰岛素β细胞。第三原因就是肠道微生物。有研究认为肠道菌群通过发酵碳水化合物生成短链脂肪酸(SCFA)对人体产生有益作用,而SCFA的缺乏与2型糖尿病(T2DM)有关。随机临床研究,给予T2DM患者等能量的不同种饮食并且收集粪便进行宏基因组测序,来证明给予膳食纤维可以促进一组特定的SCFA生产菌株的增殖,而大多数其他潜在的SCFA生产菌株数量减少或未改变。当膳食纤维促进的SCFA生产者的多样性和丰度更大时,患者的糖化血红蛋白(HbA1c)水平有更好的改善,这种现象部分是通过增加胰高血糖素样肽-1的产生造成的。这些正向应答者的促进减少了产生代谢有害化合物如吲哚和硫化氢的细菌含量。有针对性的恢复此类SCFA生产者可能为T2DM管理提供一种新的方法。
将一个随机分组、开放标签、平行对照T2DM进行临床试验研究,将临床诊断的中国汉族2型糖尿病患者(年龄35~70岁,6.5%≤HbA1c≤12.0%)随机分为对照组(U组;n=16,基于2013年中国糖尿病学会T2DM指南的患者教育和饮食建议)或治疗组[W组;n=27,由全谷物、中药和益生菌组成的高纤维饮食(WTP饮食)](图10-1-1)。两组均接受阿卡波糖(100mg,3次/天)作为标准药物。在2周的磨合期后,分别于第0天、第28天、第56天和第84天采集患者禁食静脉血,以及3小时饮食耐受性试验的30、60、120和180分钟血样、粪便样本和晨尿样本,并填写膳食频率问卷和24小时饮食记录。血液样本检测HbA1c、血清葡萄糖、总胆固醇、甘油三酯、高密度脂蛋白胆固醇(HDL-C),低密度脂蛋白胆固醇(LDL-C)、血清胰岛素、脂多糖结合蛋白、瘦素、脂联素、胰高血糖素样肽-1和多肽YY(PYY)。粪便样本检测短链脂肪酸(SCFA)、硫化氢(H2S)、吲哚,并进行微生物基因测序。此外,在W组和U组分别选择一名受试者的第0天和第84天粪便样本进行无菌C57BL/6J小鼠菌群移植实验。还对饮食诱导肥胖小鼠模型进行了 Bifidobacterium pseudocatenulatum接种实验。
实验结果发现,与基线相比,两组患者的主要预后指标HbA1c水平均显著下降且呈时间依赖趋势。但是,从第28天开始,W组的下降幅度更大(图10-1-1A)。在干预结束时,W组受试者的血糖控制良好(HbA1c<7%)比例也明显高于U组(89%与50%)(图10-1-1B)。尽管干预结束时两组之间的空腹血糖水平没有差异,但第28天时W组显著降低(图10-1-1C);餐后血糖也有类似的趋势(图10-1-1D)。本研究临床数据表明,此类碳水化合物(人体不可直接消化但可被肠道细菌发酵)的可用性增加足以引起T2DM患者的临床相关代谢状况改善,U组对于阿卡波糖带来的不可消化性淀粉增加的反应结果也证实了这一点。研究观察到,当W组添加更多种类的碳水化合物作为额外膳食纤维时,其临床结果改善更显著、更快。
为了确定肠道菌群与纤维诱导的宿主血糖控制改善之间的因果关系,将来自同一参与者的干预前、后肠道菌群移植到无菌C57BL/6J小鼠体内,接受干预后菌群移植的两组小鼠的代谢指标均优于接受干预后菌群的小鼠,所有小鼠中接受W组干预后菌群移植的小鼠空腹和餐后血糖水平最低(图10-1-1E、F),这一结果也印证了W组患者的代谢结果比U组更好。菌群移植治疗的可转移效应为通过膳食纤维调节肠道菌群,进而改善T2DM患者血糖稳态提供了证据。
接下来,确定了膳食纤维增加如何改变肠道菌群的整体结构。共在4个时间点(第0、28、56和84天)收集了172份粪便样本,进行鸟枪法宏基因组测序,共获得4893833条非冗余微生物基因。从第0天到第28天,两组的基因丰富度(每个样本检测的基因数目)显著下降而临床指标显著改善,但之后没有进一步的变化(图10-1-1F)。这一数据挑战了当前的观念,即菌群整体多样性越大,健康状况就越好。但是在第28天之后,W组的基因丰富度高于U组,这一趋势与W组的临床结果更好相符(图10-1-1F)。利用基于canopy的算法可以将个体基因合并为共丰度基因群(CAGs)。本研究用包含大于700个基因的422个CAGs来代表生态上截然不同的细菌种群的基因组。根据422个CAGs的Bray-Curtis距离,两组肠道菌群的总体结构从第0天至第28天有明显变化,但此后无进一步变化(图10-1-1G)。在干预结束时(第84天),W组和U组之间存在显著差异,反映出高纤维干预对肠道菌群明显的调节作用。
基于422个细菌基因组[共丰度基因群(CAGs)]的Bray-Curtis距离进行主坐标分析。然后,对宏基因组数据集进行了以基因为中心的分析,以探索肠道菌群改善宿主临床结果的功能性变化。WTP饮食和阿卡波糖都增加了可发酵碳水化合物的可用性,这促使我们更多关注那些利用碳水化合物的基因。本研究共检测到192236个碳水化合物活性酶(CAZy)编码基因,并将其分为315个CAZy基因家族。CAZy基因的丰富度与总基因的丰富度基本一致,也就是说,与基线相比两组都有所下降,但在第28天之后W组高于U组(图10-1-2)。根据CAZy家族数据,观察到两组干预前、后的所有样本之间存在显著的分离(图10-1-2A)。数据表明,并非整体基因丰富,而是特定功能基因(如,CAZys基因)的丰富分布更有助于确定肠道菌群中与健康相关的变化。
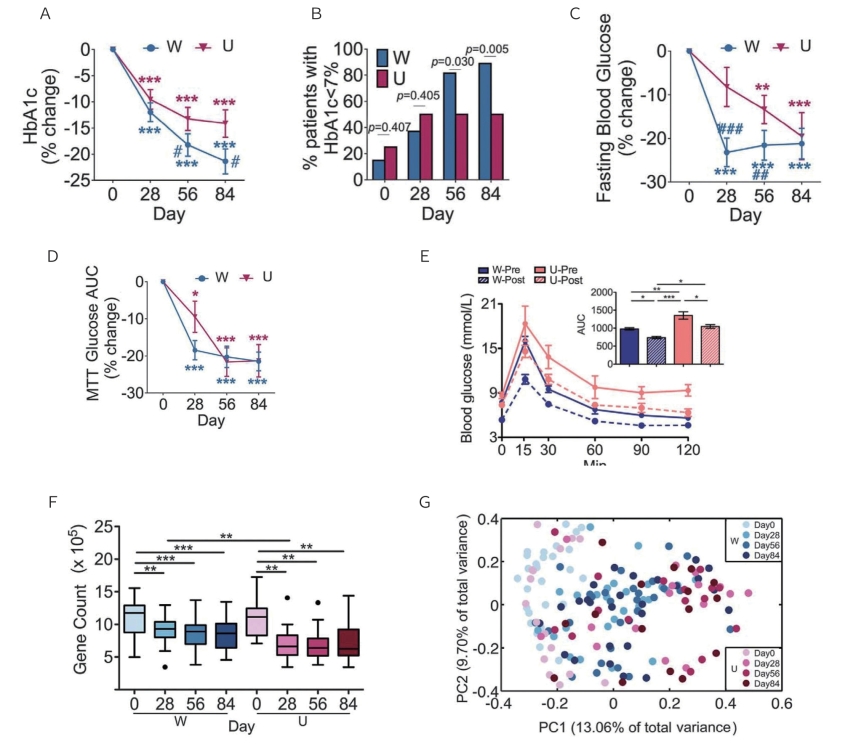
图10-1-1 高纤维饮食改变了T2DM患者的肠道菌群并改善其葡萄糖稳态
注:干预期间患者,A.HbA1c。B.血糖控制适当百分比。C.空腹血糖。D.膳食耐受试验(MTT)中葡萄糖曲线下面积(AUC)的变化。数据用和第0天比较的变化所占百分比(±SE)来表示,采用两因素重复测量方差分析(ANOVA)和Tukey’s两两检验进行组内和组间比较。同组与第0天比较,★P<0.05,★★P<0.01,★★★P<0.001;同时间点与U组比较,★P<0.05,★★P<0.01,★★★P<0.001。除(D)中U组n=15,其他分析中W组n=27,U组n=16例。E.接受患者干预前、后的肠道菌群移植的小鼠2周后的口服葡萄糖耐量试验。移植材料来源于代表性供体,一个来自W组,一个来自U组,包括干预前(第0天)和干预后(第84天)。W-Pre组、W-Post组和U-Pre组各有5只小鼠接受菌群移植,U-Post组有4只小鼠接受菌群移植。组内和组间比较采用单因素方差分析和Tukey’s两两检验,★P<0.05,★★P<0.01,★★★P<0.001。F.肠道菌群多样性(基因丰富度)。基因数量的变化采用每个样本3100万条序列校正。方框显示的是中位数和四分位间距(IQRs),长须表示的是第一和第三个四分位数的1.5倍值以内的最小值和最大值,离群值显示为单独的点。每组内的两两配对比较采用Wilcoxon配对符号秩检验(双侧)。同一时间点W组与U组比较采用Mann-Whitney检验。★★P<0.01,★★★P<0.001(Benjamini-Hochberg程序校正)。G.肠道菌群总体结构。
增加膳食纤维摄入产生的SCFAs是观察到的菌群对宿主葡萄糖稳利用编码关键酶的基因丰度来代表生产途径的丰度,例如fhs代表乙酸盐合成,but代表丁酸盐合成。W组和U组的乙酸生产途径均显著增加(图10-1-2B)。丁酸合成有4条不同的途径,其中在人类肠道中最丰富的(but作为末端基因)只在干预后的W组才显著增加(图10-1-2C)。这种编码SCFA生产途径的基因丰度的变化与测定的粪便SCFA含量基本一致(图10-1-2D、E)。在整个研究过程中,两组的乙酸浓度基本相似:第0天到第28天浓度增加,28天之后逐渐下降到略高于基线的水平(图10-1-2D);而丁酸浓度仅在W组显著增加(图10-1-2E)。第28天,两组的粪便pH值均显著降低[W组6.36±0.11(28天)与6.82±0.07(0天);U组6.21±0.18(28天)与6.79±0.09(0天)],并且在剩余时间保持在相似水平(图10-1-2F)。这种pH值的变化也表明了SCFA产量的增加和肠腔的酸化。已经知道,乙酸盐和丁酸盐通过诱导肠道产生胰高血糖素样肽-1(GLP-1)和多肽YY(PYY),进而刺激胰岛素分泌,来改善葡萄糖稳态。W组粪便乙酸和丁酸浓度增加的趋势与W组干预结束后餐后GLP-1曲线下面积(AUC)增加(图10-1-2G)和禁食PYY水平升高的趋势相符。这一发现,再加上高纤维摄入增加了餐后胰岛素的趋势,支持了SCFA驱动的肠道激素—胰岛素分泌级联效应改善葡萄糖调节的推断。
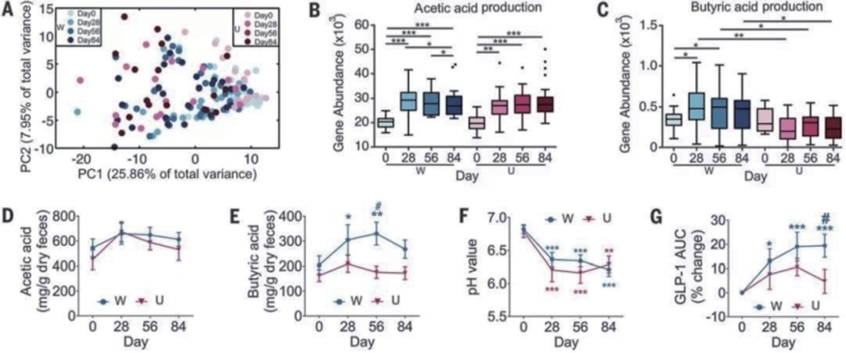
图10-1-2 高纤维饮食改变了T2DM患者肠道菌群对碳水化合物的发酵
注:A.碳水化合物活性酶(CAZy)家族基因的丰度变化。对192236个CAZy基因的丰度(log转化)进行主成分分析。PC1,主成分1;PC2,主成分2。B、C.编码乙酸生产关键酶(甲酸四氢叶酸连接酶)和丁酸生产关键酶(丁酰辅酶A:乙酸辅酶A转移酶,以but为代表)的基因的丰度变化。方框、长须和离群值表示如F所示。采用Wilcoxon配对符号秩检验(双侧检验)分析各组间的两两比较。采用Mann-Whitney检验分析同一时间点W组与U组的差异。★P<0.05,★★P<0.01,★★★P<0.001(Benjamini-Hochberg程序校正)。D、E.粪便中(D)乙酸和(E)丁酸浓度的变化。SCFAs采用气相色谱法测定,其含量以mg/g干燥粪便质量(±SE)表示。F.粪水pH的变化(±SE)。G.餐后耐受性试验中胰高血糖素样肽-1(GLP-1)的AUC的变化(±SE)。D~G均采用两因素重复测量方差分析和Tukey’s两两检验进行组内和组间比较。组内与第0天比较,★P<0.05,★★P<0.01,★★★P<0.001;同时间点与U组比较,#P<0.05。W组n=27,U组n=16例。(www.chuimin.cn)
从180个被大于20%样本共享的细菌CAGs中,组装了154个流行细菌的高质量基因组草图(每个样本总读数的57%±11%被绘制出来),这些基因组至少满足NIH人类微生物组项目6个参考基因组标准中的5个。这些肠道流行细菌的高质量基因组草图能够在有功能注释的菌株水平上分析成分变化。将141个基因组标注为SCFA生产者,因为它们至少含有SCFA生产的一个关键基因。在这些基因组中,有79个菌株对高纤维干预无应答(研究期间无改变),47个负向应答(研究期间显著减少)和15个正向应答(即研究期间显著增加)。这15个正向应答者的增多主要是在第28天达到高峰(图10-1-3A)并在之后保持稳定,这与在整体肠道菌群结构中观察到的模式一致(图10-1-1F)。这15个菌株来自3个不同的门,其中一些(如,Lachnospiraceae bacterium CAG0409和Clostridiales bacterium CAG0023)没有被详细描述过,而另一些则是众所周知的有益菌种。在W组中,15个正向应答者均具有乙酸盐生产基因,其中5个还具有丁酸盐生产能力(图10-1-3B)。在U组中,15个正性反应者中只有3个乙酸盐生产者得到了促进(图10-1-3C),这可能是阿卡波糖引起的淀粉向结肠输送的结果。这些基因组水平的数据与两组乙酸生产途径升高和粪便乙酸水平升高的趋势一致(图10-1-2B、C)。然而,高纤维膳食对丁酸盐生产途径的促进和丁酸盐生产的诱导作用仅在W组中被观察到(图10-1-2C、E)。在高纤维干预治疗T2DM研究中,15个对多种可发酵碳水化合物的可用性增加做出正向应答菌株的是SCFA生产的主要活性生产者,它们很可能是纤维诱导的SCFAs增加以促进宿主代谢结果改善的主要驱动因素。
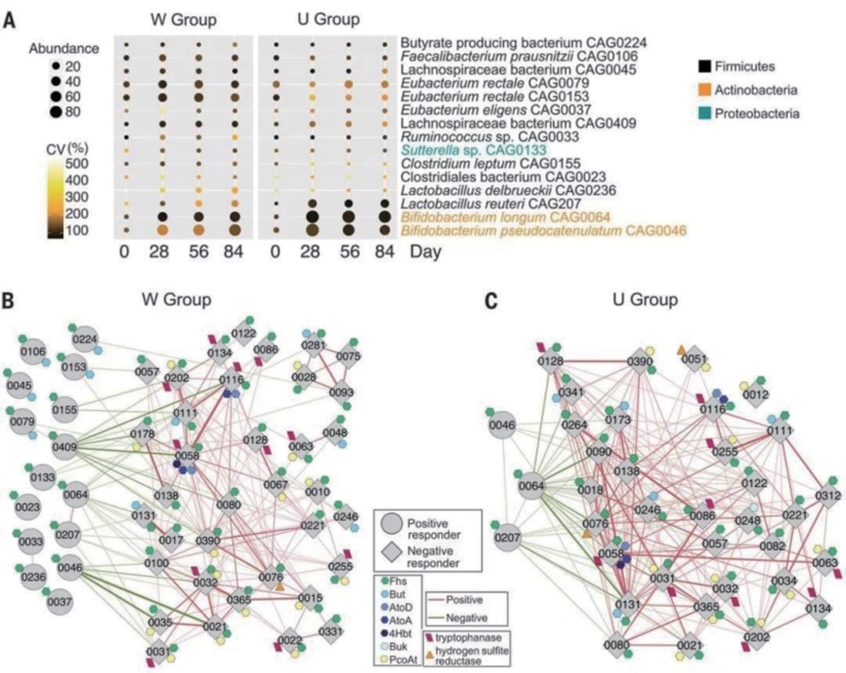
图10-1-3 高纤维饮食选择性地促进一群SCFA生产者成为主要的活跃生产者
注:A.活跃生产者丰度的时间进程变化。圆的大小和颜色分别表示菌株丰度的平均值和变异系数(CV)。网络图突出了(B)W组和(C)U组中正向和负向应答者在所有时间点的相关性。用Bland和Altman描述的方法计算了CAGs之间的相关系数。节点之间的线表示节点之间关联,线宽表示关联大小。为表述清晰,只绘制了相关性>0.4的线。Fhs,四氢叶酸甲酯;But,丁酰辅酶A∶乙酸辅酶A转移酶;AtoA,乙酰乙酸辅酶A转移酶α亚基;AtoD,乙酰乙酸辅酶A转移酶β亚基;4Hbt,丁酰辅酶A∶4-羟丁酸辅酶A转移酶;Buk,丁酸激酶;PcoAt,丙酸酯辅酶A转移酶/丙基辅酶A∶琥珀酸辅酶A转移酶。
然后研究了这15个正向应答者与肠道生态系统中其他成员之间的关系。相关分析显示,W组中每个正性应答者都至少与1个负向应答者有显著的负相关关系(图10-1-3B)。同样的,U组中正向应答者与负向应答者也呈负相关关系(图10-1-3C)。一些负向应答者含有编码色氨酸酶或亚硫酸氢还原酶的基因,这两种酶分别参与代谢有害物质吲哚和硫化氢的生产(图10-1-3B、C)。吲哚和硫化氢生产途径的基因丰度减少以及粪便吲哚和硫化氢含量减少也支持了这些细菌数量下降的现象(图10-1-3)。已经知道这些代谢物对GLP-1和/或PYY合成起抑制作用,那么这些变化就有可能有助于改善宿主葡萄糖稳态。因此,这些正向应答者在构建一个更健康的肠道生态系统中可能发挥的作用,即通过发酵碳水化合物生产这些可以改善肠道环境、抑制有害细菌的SCFAs。当这些SCFA生产者维持在一定水平时,它们的代谢活动就会创造出一种抑制致病或有害肠道细菌、维持最佳宿主健康的环境条件,如较低的肠腔pH值、较高的丁酸盐浓度及更强的“竞争性排斥”效应。
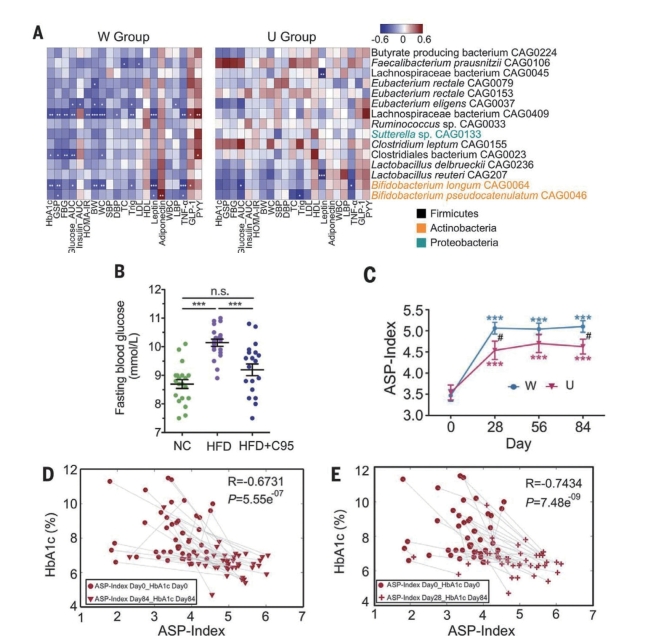
图10-1-4 T2DM患者的SCFA活跃生产者与代谢结果相关
注:A.在热图中,星号表示单个SCFA活跃生产者的丰度与临床结果之间的相关性。GSP,糖化血清蛋白;FBG,空腹血糖;HOMA-IR,(空腹血糖水平×空腹胰岛素水平)/22.5;BW,体重;WC,腰围;SBP,收缩压;DBP,舒张压;TC,总胆固醇;Trig,甘油三酯;LDL,低密度脂蛋白;HDL,高密度脂蛋白;WBC,白细胞计数;LBP,脂多糖结合蛋白;TNF-α,肿瘤坏死因子-α。★P<0.05,★★P<0.01,★★★P<0.001。B.B.pseudocatenulatum C95可减轻小鼠高脂饮食引起的葡萄糖稳态失调。数据以均数±标准差表示(每组小鼠n=19~20)。NC,正常饮食;HFD,高脂肪饮食;HFD+C95,高脂肪饮食和B.Pseudocatenulatum C95。数据分析采用单因素方差分析和Tukey’s两两检验。★★★P<0.001;n.s.,无统计学差异。C.ASP指数的时间过程变化,其中Ai为SCFA活跃生产者i的丰度。D.ASP 指数(第0天和第84天)与HbA1c(第0天和第84天)的相关性。n=43;R,相关系数。E.ASP 指数(第0天和第28天)与HbA1c(第0天和第84天)的相关性。n=43。(A)、(D)和(E)中的相关系数采用Bland和Altman描述的方法计算。
在与宿主疾病表型的关系方面,W组有7个正向应答者与至少有1项临床参数显著相关(图10-1-4A)。W组中,Lachnospiraceae bacterium C0409与13项临床参数呈负相关。然而,这种细菌对阿卡波糖无应答,并且在U组中与任何临床参数均不相关。在本研究中,产生乙酸盐的Bifidobacterium pseudocatenulatum是促进SCFA生产的最显著的细菌之一。给高脂饮食诱导肥胖小鼠接种B.pseudocatenulatum C95能显著降低其体重、体脂、空腹血糖和胰岛素抵抗程度;改善餐后血糖反应;提高盲肠乙酸盐含量(图10-1-4B、C)。为了进一步了解正向应答者是如何作为一个群体影响宿主代谢健康的,从15个高纤维促进的SCFA 生产者的丰度和多样性(Heip均匀性)衍生出了一个SCFA活跃生产者(ASP)指数。在整个研究过程中,W组的ASP指数更高,反映了更好的临床结果。尽管在干预过程中HbA1c是保持持续下降的(图10-1-3A),两组ASP指数的时间轨迹相似(图10-1-4C),即ASP指数从基线到第28天升高并在此后趋于稳定。同时,分析基线和干预终点数据时,ASP指数与HbA1c呈负相关(图10-1-4D)。这些发现证实了这一组SCFA产生对2型糖尿病的生理重要性,在可发酵碳水化合物补充方案大致相似的情况下也是如此。ASP指数是在第28天上升到一个平稳的水平,并在此后保持不变。因此,当把基线和第28天的ASP指数与基线和第84天的HbA1c绘图展示时,观察到与第84天(作为终点)的ASP指数相似的负相关关系,表明这群细菌在早期时间点(28天)的变化可以为后期(84天)的治疗结果提供信息(图10-1-4E)。在HbA1c生理性降低之前,正向应答者就大量出现。这种时间上的差异,即当宿主的新陈代谢随着肠道生态系统打破而随之改变后,肠道菌群的迅速反应增殖并达到高峰,不仅暗示着纤维引起的肠道菌群变化和宿主代谢健康改善之间的因果关系,还可能在微生物指向性的膳食干预的早期提供了一个可以预示最终有效性的关键时间窗口。
在这项研究中,确定了一组通过膳食纤维增加各种可发酵碳水化合物的可用性而选择性促进乙酸盐和丁酸盐生产菌株。这些正向应答者可能是维持肠道微生物群和人体宿主之间的互利互惠关系的关键因素;促进这群SCFA活跃生产者不仅增强了有益的功能,而且保持了良好的肠道环境以远离有害细菌。
尽管各种物理化学结构的可发酵碳水化合物的可用性增加,但只有少数具有生产SCFAs遗传能力的细菌能够利用这种新资源并成为主要的正向应答者。这样一群“以类似的方式开发同类环境资源”的物种可能被认为是生态学中的“同盟”。同盟成员不必在分类上相似,但在适应不断变化的环境时会同时出现。在例子中,15个正向应答者来自3个不同的门,但它们作为一个同盟,通过类似的方式响应可发酵碳水化合物可用性的增加,以增加肠道生态系统中原本不足的SCFA产量。当把它们看作一个功能性群体时,这组SCFA生产者同盟的丰性和均匀性与宿主的临床结果相关。与传统的分类分析相比,这种基于功能同盟的分析提供了一种更生态学相关的方法来降低微生物组数据集的维度,并有助于识别在人体健康和疾病中发挥重要功能的肠道菌群成员。研究表明,像T2DB这样的慢性疾病可能是肠道生态系统中有益功能(如碳水化合物发酵生成SCFA)缺失或不足的结果。从生态学的角度来看,碳水化合物发酵生成SCFAs是维持人体健康所必需的,可以认为是肠道菌群向人体宿主提供的一种“生态服务”。通过重建功能活跃的生态群体作为生态服务提供者(ESPs)来恢复或增强已经缺失或不足的功能,是实现有助于减轻疾病表型的更健康菌群的关键。通过个性化的营养物质的添加,针对性地促进SCFA活跃地生产ESPs,可通过控制肠道菌群来调控。
有关微生物与人类健康的文章

肠道菌群对身体有方方面面的影响,调节体重、影响胃口仅仅是肠道菌群的基本功能。对于人体来说,维持肠道菌群的正常平衡,是保证身体健康的重要一环。如果在肠胃中占据主导地位的肠道菌群健康而稳定,就能抑制致病菌的侵扰。在科学家看来,代谢发生异常,离不开失衡的肠道菌群。如果长期吃高脂高糖的食品,肠道菌群中的致病菌会增加,益生菌则会减少,很容易使从食物中摄取的能量转化为脂肪,从而为人类带来体重增加等肥胖问题。......
2023-10-28

然而,也有相反的发现表明不同年龄组参与者的肠道微生物结构没有显著差异。总的来说,衰老与肠道失调增加有关,与肠道微生物多样性呈负相关。目前,许多技术可以用来分析肠道微生物群与人类免疫学、神经学和内分泌学的关系。......
2023-11-16

哺乳动物的宿主与其肠道菌群之间的相互作用会诱导机体产生适应性免疫应答。肠道受损,会诱导全身性T细胞反应失调,最终致使远端器官的自身免疫性疾病,例如类风湿性关节炎或者自身免疫性神经炎症等。结果表明,饮食中色氨酸的限制会改变肠道菌群的代谢特性,进而影响脑炎性T细胞反应。肠道菌群、饮食色氨酸和适应性免疫之间的这种联系可能有助于制定预防自身免疫性神经炎症的治疗策略。......
2023-11-16

Larsen等人使用主成分分析观察到2型糖尿病患者组和对照组的肠道菌群差异。没有用到二甲双胍治疗的2型糖尿病的患者与非糖尿病患者相比,产生丁酸盐的细菌丰度较少。最近的另一项研究综合了277名丹麦非糖尿病患者的胰岛素抵抗、肠道微生物组和空腹血清代谢组数据,以研究肠道微生物组是否会影响胰岛素抵抗相关的代谢特征。研究特定的细菌是肥胖和2型糖尿病研究的焦点,如黏液定殖的Akkermansia muciniphila。......
2023-11-16

另外一项纳入81位研象对象的葡萄牙研究发现与患有慢性胃炎的患者相比,胃癌患者的胃部菌群多样性明显较低。然而,有研究表明胃癌缓和胃部菌群多样性较高。近期,Liu等人研究276例患者特定胃部菌群多样性和丰富度与胃癌发生的关系。通过检测胃癌患者的正常、癌旁和癌组织,研究人员发现与正常胃组织相比,胃癌和癌旁组织的菌群多样性和丰富性降低。目前,胃部菌群多样性与胃癌进展过程是否存在相关性尚不清楚。......
2023-11-16

中国学者李瑞等人研究发现组织蛋白酶K是肠道菌群失衡与结直肠癌转移之间的重要中介,结直肠肿瘤细胞分泌的组织蛋白酶K通过激活TLR4-mTOR途径诱导M2型肿瘤相关巨噬细胞的极化,从而加速结直肠肿瘤进展。临床上,CTSK在患者肿瘤组织中的过表达总是伴随着基质中M2型肿瘤相关巨噬细胞比例的增高,并且与肿瘤的转移和预后不良相关。......
2023-11-16

益生菌LGG通过抑制小鼠肝脏胆汁酸合成和促进胆汁酸排泄来预防肝纤维化,胆汁淤积性肝病的特点是肠道菌群失调和肝脏毒性胆汁酸过量。LGG治疗明显减轻了BDL小鼠的肝脏炎症、损伤和纤维化,并显著降低了肝脏BAs。因此,可以得出补充LGG可通过增加肠道FXR/FGF15信号通路介导的对BA从头合成的抑制作用来降低肝脏BA,并增加BA的排泄,从而防止BA过量诱导的小鼠肝损伤和纤维化。研究者评估了肝脏和肠道组织的炎症反应和系统性炎症。......
2023-11-16

肝移植前后患者的肠道菌群中MDRB的定殖及对肠道菌群的影响,为未来肝移植患者术后治疗提供了更全面的治疗思路。耐多药细菌感染仍然是肝移植后发病和死亡的主要原因。肝脏疾病晚期的肠道营养不良可能使患者的肠道更易于被MDRB感染和定植,进而加剧营养不良。但是,LT术后MDRB定植与营养不良之间的关系目前尚不明确。......
2023-11-16
相关推荐