肠—脑轴人体肠道微生物组以多种方式影响人类大脑健康:结构性细菌成分如脂多糖为先天免疫系统提供低级强直性刺激。通过这些不同的机制,肠道微生物塑造了下丘脑—垂体—肾上腺轴的应激反应的结构。菌群在健康状态和疾病状态影响CNS。......
2023-11-16
为了评估哪些微生物的变化与AD相关,并可能作为AD的潜在生物标志物,建立了基于代表性微生物的多变量回归模型,并利用ROC曲线评估其鉴别和预测能力。如图7-5-4所示,基于具有代表性的20个优势属的判别模型有效区分了AD、HC和aMCI。仅以肠杆菌科相对丰度为基础建立模型,也对AD具有良好的鉴别效果。值得注意的是,这些模型可以区分AD与HC(图7-5-4A)和aMCI(图7-5-4)。两种模型的数据拟合良好。因此,基于肠道微生物的模型可以区分AD患者与aMCI患者及本研究中中国队列中的健康个体,提示肠道微生物具有预测和鉴别AD患者严重程度的作用。
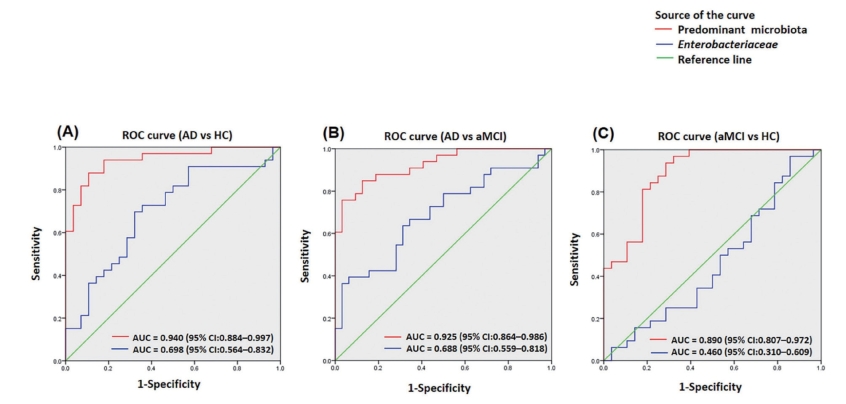
图7-5-4 利用在任一疾病组中平均丰度均大于1%的优势微生物或肠杆菌科进行
研究发现aMCI期和AD期患者的肠道微生物组成均与健康个体存在显著差异,肠道微生物的改变与AD的临床参数,尤其是AD病情严重程度的指标存在显著相关性。基于优势菌群的判别模型可以有效区分aMCI、AD与HC,以及AD与aMCI。肠杆菌科是AD患者肠道微生物中变形杆菌门家族唯一丰度增加的菌,基于肠杆菌科的模型可以有效区分AD与aMCI、HC。本研究的结果可为了解AD增加了新的数据,并能够为AD的干预或标记提供新的靶点。
与aMCI患者和健康对照组相比,AD患者的肠道微生物多样性显著降低。人类肠道微生物主要为厚壁菌门、拟杆菌门和变形杆菌门。本队列研究中,与aMCI和HC相比,AD患者的厚壁菌门的相对丰度明显降低,而变形杆菌的比例较高。这与之前发表的文献一致,该文献发现重度抑郁症患者的肠道微生物中厚壁菌门丰度较低,变形杆菌门丰度较高。NicholasM.Vogt等人最近也在美国AD患者中发现厚壁菌门丰度广泛减少。本研究还发现aMCI患者的拟杆菌门丰度显著增加,但与HC组相比,AD患者中拟杆菌门丰度未见改变。同时,拟杆菌门丰度与MMSE评分之间存在显著的相关性,拟杆菌门在AD前期(aMCI)具有一定的作用。人类AD与厚壁菌门的广泛减少有关,肠道微生物可能是早期预防aMCI向AD发展的潜在微生物靶点。未来还需要进一步的研究来探索来自不同种族背景的AD患者的微生物变化。
AD患者的肠道微生物的厚壁菌门中,可产生短链脂肪酸(SCFAs)的梭菌科、毛螺菌科和瘤胃球菌属丰度显著降低,并与反映AD认知状态的参数(MMSE、MoCA评分)呈正相关。这可能是由于SCFAs可为宿主和结肠上皮细胞提供营养、调节黏膜屏障通透性、保护血脑屏障等,与AD发病机制密切相关。肠道微生物在与大脑发育、生理、心理和行为相关的过程中发挥着积极的作用。AD患者膜转运(细菌分泌系统)和糖基生物合成和代谢(LPS生物合成)功能模块的逐渐富集,表明肠道微生物与宿主之间存在潜在的主动沟通。与此相反,AD患者中参与氨基酸代谢的功能群的改变,可能导致代谢紊乱、脂多糖积累和神经递质、激素和免疫系统调节剂的耗竭,这些都与神经退行性疾病相关。
变形杆菌门的丙型变形菌纲、肠杆菌目和肠杆菌科丰度从HC、aMCI到AD阶段逐渐增加,且这些变化与AD的临床严重程度显著相关。基于肠杆菌科变化所建立的预测模型可以清晰地区分AD、aMCI和HC。变形杆菌门中肠杆菌科及其近缘成员可能在AD的发生发展过程中发挥重要作用。AD患者特殊的肠道微生物将有助于在早期发现AD风险人群,从而进一步阐明肠道微生物对大脑疾病的影响。研究报道了与中国健康老年人相比,aMCI和AD患者肠道微生物群的特征。结果表明,AD患者的微生物组成发生了显著改变,其特征是SCFAs生成菌所在的厚壁菌门丰度降低,而具有促炎作用的变形杆菌丰度增加,且与AD的严重程度相关。基于优势微生物或肠杆菌科的分类模型可以区分AD、aMCI和HC,表明微生物组分析可用于预测AD疾病的严重程度。本研究的结论将有助于以肠道微生物为靶标的AD患者的早期诊断和治疗。Hertel等人通过整合纵向代谢组学和肠道微生物组的计算模型,展示了帕金森病中人和微生物硫代谢的复杂变化。次级牛磺酸结合胆汁酸与帕金森病的严重程度和发病率有关,揭示了多组学整合分析在帕金森病中的潜在临床价值。①纵向代谢组学揭示了帕金森病患者的转硫作用出现异常。②肠道微生物的代谢模型显示微生物的硫代谢发生变化。③微生物硫代谢的改变与沃氏嗜胆菌(Bilophila wadsworthia)和嗜黏蛋白艾克曼(Akkermansia muciniphila)有关。④牛磺酸结合的胆汁酸与帕金森病有关。
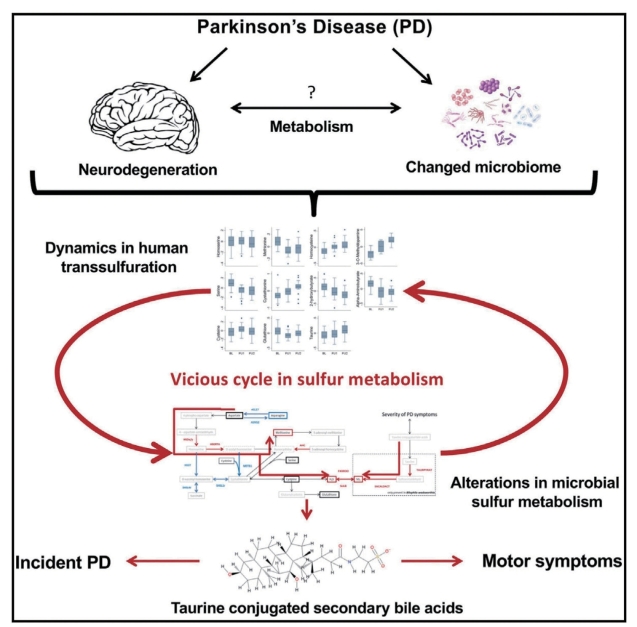
图7-5-5 示意图
帕金森病(PD)对人体的新陈代谢具有全身性影响,而肠道微生物组的作用也逐渐显现出来。这里,整合分析了来自30名新发且未经药物治疗的PD患者和30名匹配的对照人群(具有基于约束的肠道微生物群落建模,该建模来自独立的未经药物治疗的PD队列)的纵向代谢组学数据,和来自普通人群的前瞻性数据。主要结果是:①PD患者与对照组之间,蛋氨酸和半胱氨酸相互转化(胱硫醚为该转化的代谢中间体)的相关代谢产物的纵向轨迹不同。②多巴胺能药物治疗表现出强的脂质组特征。③牛磺酸结合的胆汁酸与运动症状的严重程度相关,普通人群中低水平的硫酸化牛磺石胆酸盐与PD的发病率有关。④计算模型预测了由A.muciniphila和B.wadsworthia驱动的硫代谢变化,这与代谢组的变化是一致的。多组学整合揭示了微生物与宿主的硫共代谢中PD的特定模式,这可能与PD的严重程度有关。
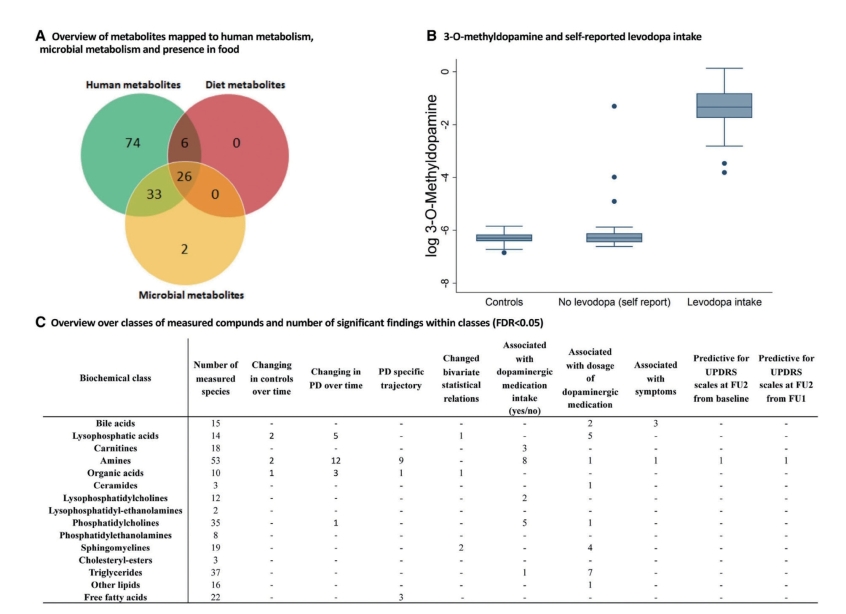
图7-5-6 代谢组学分析和取决于左旋多巴摄入量的3-O-甲基多巴胺水平的概述
注:A.Venn图,表示测得的代谢物映射到人类虚拟代谢数据库中,该数据库包含人类代谢重建、818种微生物代谢重建,以及大于8000种食品的成分。B.左旋多巴摄入量(自我报告)和3-O-甲基多巴胺水平。C.检测化合物的生化分类以及每个类别下重要发现的概述。(www.chuimin.cn)
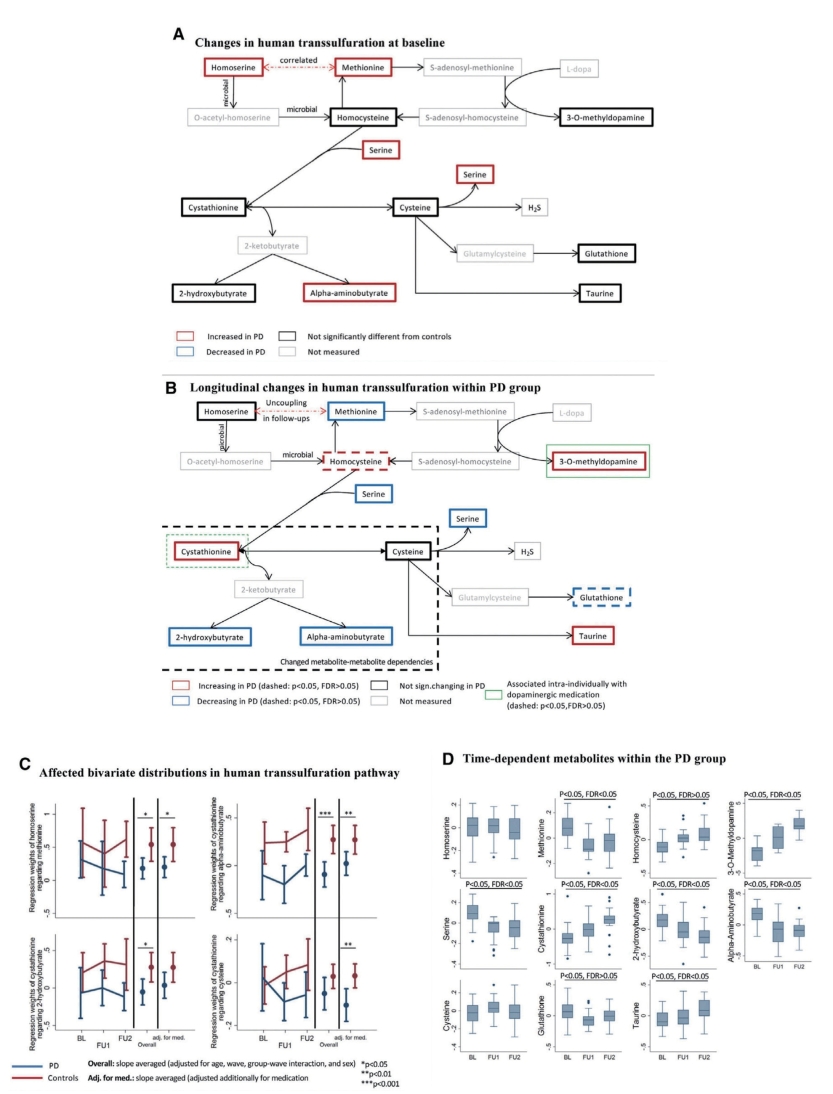
图7-5-7 与PD相关的人体转硫途径的纵向变化
注:A.基线时人体转硫途径的变化,突出显示了代谢物浓度的变化(相比于对照组)(P<0.05,FDR<0.05)。B.PD组内转硫作用的纵向变化,突出显示了PD组中具有明显轨迹的代谢物(实线:P<0.05,FDR<0.05;虚线:P<0.05,FDR>0.05)。C.显示了3个时间点,转硫途径中代谢物与代谢物关联的改变。D.显示了3个时间点,PD组内所有测得的转硫途径化合物的箱线图。对数浓度以单个平均值为中心。BL,基线;FU1,随访I;FU2,随访II。
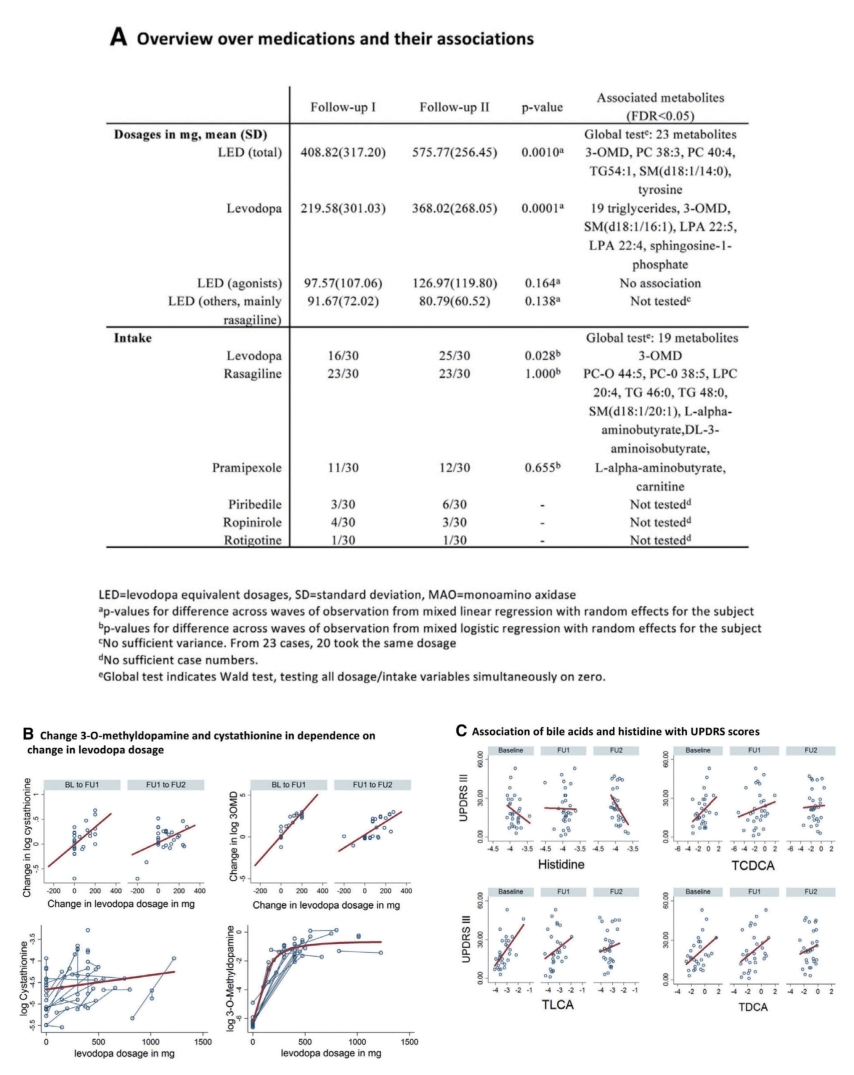
图7-5-8 代谢组中多巴胺能药物治疗的特征
注:A.多巴胺能药物治疗的结果概述,汇总了经过多重检验校正后的重要结果(FDR<0.05)。注意:全局检验没有效果。B.3-O-甲基多巴胺和胱硫醚的变化取决于左旋多巴剂量的变化。下方的图:被连接的点属于同一个体;胱硫醚的变化与左旋多巴的剂量无关,而3-O-甲基多巴胺的水平随左旋多巴剂量的升高而升高,当左旋多巴剂量达到一定高的水平后,3-O-甲基多巴胺基本保持不变。C.胆汁酸和组氨酸与UPDRSIII评分的关联(所有FDR<0.05)。BL,基线;FU1,随访I;FU2,随访II;PC,磷脂酰胆碱;TG,甘油三酸酯;UPDRS,帕金森病统一评分量表。
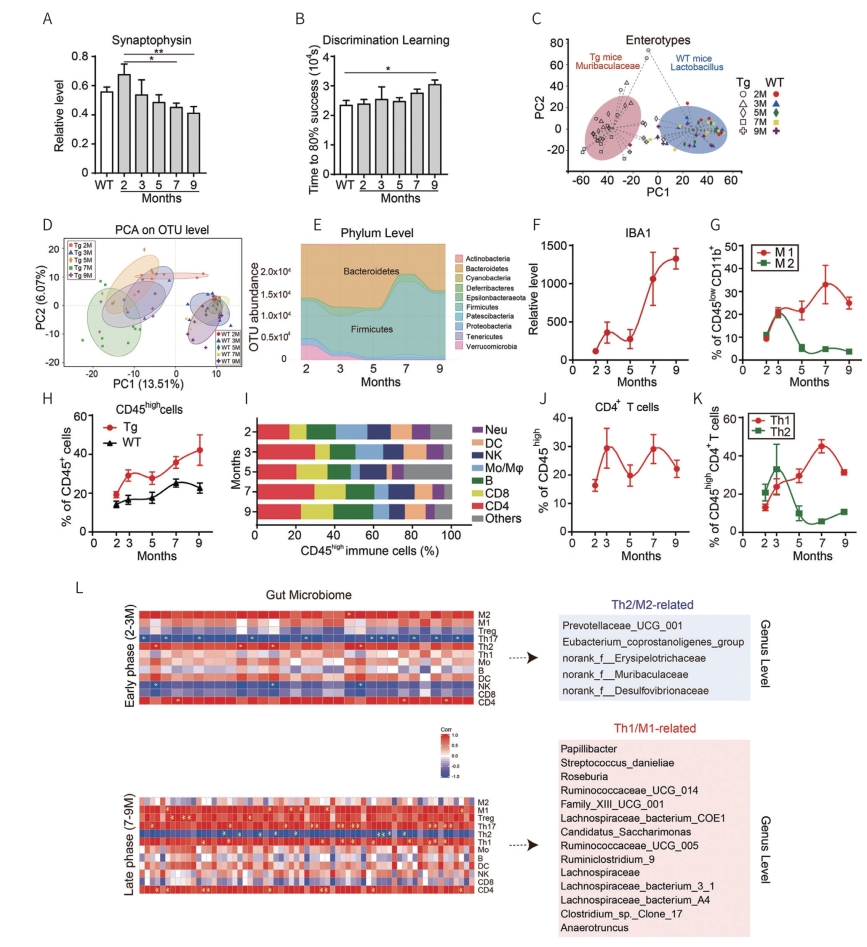
图7-5-9 个体化微生物组模型的分析结果
注:A.5XFAD转基因(Tg)小鼠在2、3、5、7、9月龄海马突触素相对RNA表达水平的变化及野生型(WT)小鼠2月龄海马突触素相对RNA表达水平的变化。B.在评估5XFAD转基因(Tg)小鼠在2、3、5、7和9个月龄和野生型(WT)小鼠在2个月龄(n=4~8)的辨别学习能力的试验中,为获得80%的成功所用的104秒时间的变化。C.5XFAD转基因(Tg)小鼠和野生型小鼠在2、3、5、7、9月龄肠道菌群在属水平的肠型分析。D.不同时间点5XFAD转基因(Tg)小鼠和野生型小鼠肠道菌群组成的主成分分析。E.5XFAD转基因(Tg)小鼠在不同月份肠道菌群中基于out水平的丰度变化。免疫荧光染色阳性密度的变化,反映了XFAD转基因(Tg)小鼠海马小胶质细胞在2、3、5、7、9个月时相对于2月龄野生型(WT)小鼠的激活比例。G.5XFAD 转基因(Tg)小鼠在2、3、5、7和9个月时(n=4~8)全脑匀浆中检测到激活的M1和M2型小胶质细胞的变化。
肠道菌群失调与阿尔茨海默病(AD)进展之间存在关联,但肠道菌群在AD发病机制中的具体作用仍不清楚。本文中,研究者发现了将肠道菌群失调和AD进展相关神经炎症相关联的潜在的机制。研究者借助AD小鼠模型,首次发现在AD进展过程中,肠道菌群组成的变化可以导致外周循环中苯丙氨酸和异亮氨酸的积累,从而促进Th1细胞等外周免疫细胞的分化和增殖,而大脑浸润的局部的Th1免疫细胞与M1小胶质细胞活化有关,诱发大脑神经炎症,最终导致AD相关的神经炎症。更为重要的是,在两组小型独立队列研究中,轻度认知障碍(Mild Cognitive Impairment,MCI)患者中,其外周循环的苯丙氨酸和异亮氨酸浓度以及血液中Th1细胞比例均有升高。此外,在国内一项三期临床实验中发现,寡糖类抗AD药物GV-971,通过重塑肠道菌群平衡,降低菌群代谢产物特别是苯丙氨酸和异亮氨酸的产生,降低外周及中枢炎症,减少脑内Aβ蛋白沉积和Tau的过度磷酸化,从而改善认知功能障碍。综上所述,本研究突出强调了肠道菌群失调诱发的相关神经炎症在AD进展中的重要作用,为阐明AD复杂疾病的发病机制提供了全新的研究视角,同时提供了一种通过重塑肠道菌群来治疗AD的新的治疗策略。
为了评估肠道微菌群的变化在AD发病机制中的作用,研究者使用了5XFAD转基因(Tg)小鼠模型,该模型目前广泛用于AD研究中,用来研究AD相关的病理特征,包括严重加速的认知障碍、出生后 2个月的淀粉样蛋白沉积、出生后4个月的突触变性,以及6个月的行为学改变等。实验小鼠大脑海马体中突触素的表达水平从第7个月显著下降到第9个月,表明突触退化(图7-5-9a),而Tg小鼠的行为测试显示9个月大时辨别学习能力明显下降(图7-5-9b)。然后,研究者使用16SrRNA基因扩增子测序比较了AD进展中不同阶段的Tg小鼠和WT小鼠的肠型变化。结果发现,肠道菌群中有显著的聚类效应,Tg小鼠聚类为Muribaculaceae家族下的Norank属,WT小鼠聚类为Lactobacillus属(图7-5-9c)。
研究者发现,在Tg小鼠的AD进展过程中,肠道菌群组成发生了显著的变化,而在WT小鼠中几乎没有观察到任何变化(图7-5-9d)。利用OTUs跟踪Tg小鼠体内不同菌门丰度的动态变化,发现在疾病进展过程中Tg小鼠肠道微生物有两种明显的变化。在2月龄时,Bacteroides,Firmicutes和Verrucommicrobia是门水平上最丰富的三种细菌(分别为47.3%、33.0%和12.2%)。在7月龄时,Firmicutes成为优势门(62.8%),而Bacteroides和Verrucommicrobia的丰度明显下降,表明菌群的类型发生了变化(图7-5-9e)。这些结果表明,Tg小鼠与WT小鼠的肠道微生物形成的强烈对比是,Tg小鼠的肠道菌群是高度动态变化的。同时,在另一种广泛用于AD研究的模型APP/PS1双转基因小鼠模型也得到了类似的结果。小胶质细胞激活的标志IBA1在AD小鼠脑组织切片中的免疫染色显示了小胶质细胞激活的两个明显阶段,分别在第3个月和第7~9个月(图7-5-9f)。在2~3个月大的早期阶段,M1和M2小胶质细胞比例都持续增加,而在接下来的几个月中,M1亚型比例继续增加,并在第7~9个月达到高峰,而M2型小胶质细胞从3个月到5个月下降,此后保持较低水平(图7-5-9g)。观察到Tg小鼠大脑中CD45high细胞的频率明显高于WT小鼠,与IBA1染色结果相似(图7-5-9f、h)。研究者进一步分析了在AD进展过程中的一系列时间点中CD45high细胞亚型的变化(图7-5-9i)。浸润性Th1和Th2细胞是CD4+细胞的两种主要亚型,研究者发现在实验观察期间其表现出与M1和M2小胶质细胞相似的动力学变化(图7-5-9k)。此外,研究者还分析了在AD进展的早期和晚期肠道微生物丰度和大脑免疫细胞比例之间的相关性。研究者注意到,细菌的丰度变化在早期(2~3个月)与Th2和M2细胞的变化一致(图7-5-9l,顶部),在晚期(7~9个月)则与Th1和M1细胞的变化相关(图7-5-9l,底部)。
有关微生物与人类健康的文章

肠—脑轴人体肠道微生物组以多种方式影响人类大脑健康:结构性细菌成分如脂多糖为先天免疫系统提供低级强直性刺激。通过这些不同的机制,肠道微生物塑造了下丘脑—垂体—肾上腺轴的应激反应的结构。菌群在健康状态和疾病状态影响CNS。......
2023-11-16

与HC组相比,AD患者厚壁菌门的相对丰度明显下降;与HC组和aMCI组相比,AD患者的变形杆菌高度富集;拟杆菌门在aMCI组显著富集,在AD组则下降至正常水平。与aMCI组相比,AD组的瘤胃球菌科丰度显著下降。与HC组相比,aMCI 组富含具有致病性的韦荣菌科细菌。图7-5-2AD、aMCI组HC组代表性肠道微生物的分类学丰度比较因此,AD患者的关键菌为丰度降低的梭菌科、瘤胃球菌属以及丰度增加的变形杆菌门、丙型变形菌纲、肠杆菌目、肠杆菌科等。......
2023-11-16

并证明你的结论.分析根据题意知,相同质量的砝码不会同时出现在天平的两个秤盘之中,所以可以转化为求解不定方程的问题.解假定当天平平衡时,用9克的砝码|x|只,当该砝码出现在被称物体所在的秤盘中时,x取负整数.同理,假定13克的砝码用了|......
2023-08-13

图2.33单击“色板”面板标题栏中的双箭头以展开面板,这样就可以看到它的内容。图2.34注意:许多面板只需要双击选项卡两次即可最大化。再次双击会使此面板最小化。图2.35颜色参考单击同一组中的“颜色”面板选项卡。图2.36从控制面板的顶部应用程序栏最右侧的工作区切换器中选择“重置基本功能”。图2.37注意:如果将该面板组拖放到停放区中现有的面板上,两组面板组将合并。图2.38根据需求排列面板并编组,有助于提高工作效率。......
2023-11-20

1 SRAM和Truvativ生产的零件比较精简,GXP系列牙盘组便是一个例证。以下拆卸和安装步骤对SRAM的Red、Force、Rival,以及Truvativ的Noir、Stylo和Firex都适用。至此,螺栓应当已经向外旋出,继续逆时针旋转螺栓,直到曲柄从中轴的花键上脱落。5 安装过程也很简单。安装前要保证螺纹干净,没有毛刺,在碗组的螺纹上涂抹足量的润滑剂,并确定是否需要添加垫片。将链条放在不会影响安装的位置,之后将轴杆穿过五通,直至其无法继续伸出。......
2023-08-30

如果咱们玩斗地主,78910JQK,这个序列是有意义的,在扑克牌里叫顺子,在基因组里可类比于一个基因。现在你明白了吧,说一个物种基因组有多大,就是问这个物种有多少张“扑克牌”,也即多少个碱基对。460Mb,也就是4.6亿对;大豆的基因组有多大啊?1Gb,大约是10亿对;那小麦的基因组呢?你可能有点儿混乱了,难道不是物种越高等,基因组就越大么?物种的基因组大小和它的复杂性之间没有严格的对应关系,这个现象被称为“C值悖论”。......
2023-10-28

第八章政策目标的选择和配组第一节体制和政策的关系——体制中的不稳定因素能通过政策克服吗?这些同志由此出发,认为不应实行逆风向而动的反周期政策,而应倡导系统的自我组织,自我协调,不是平息风波,熨平周期,而应当是冲浪,驾驶波浪。反周期不应当是临时的应急措施,而应当是长期的方针。资本主义经济体制内蕴含着有效需求不足的内在机制,这使得许多国家频繁地发生销售危机,价格下跌,生产下降。......
2023-12-02

图2-3气门组零件2.气门组的拆装气门组的拆卸步骤①依次拆卸进、排气气门锁片。图2-5气门组零部件注意:气门导管一般是镶嵌在气缸盖上的,不需要拆卸气门导管;还有些发动机根本就没有安装气门导管,而是在气缸盖上直接加工出气门杆孔的。......
2023-10-05
相关推荐