综上所述,HFD过程中增加的内皮通透性和细菌易位表明GVB破坏是NASH发展的早期事件,通常发生在肝脏脂肪变性之前。在HFD期间观察到GVB的中断后,研究者评估了它在NASH诱导中的作用。先前已经证明,干扰内皮细胞中的Wnt/β-catenin信号通路是鼠伤寒沙门菌诱导GVB破坏的一种机制。这表明,在完整的GVB存在下,游离细菌进入肝脏的易位受到阻碍。总之,这些结果表明IEB本身的损伤不足以诱导NASH,而GVB干扰也是必需的。......
2023-11-16
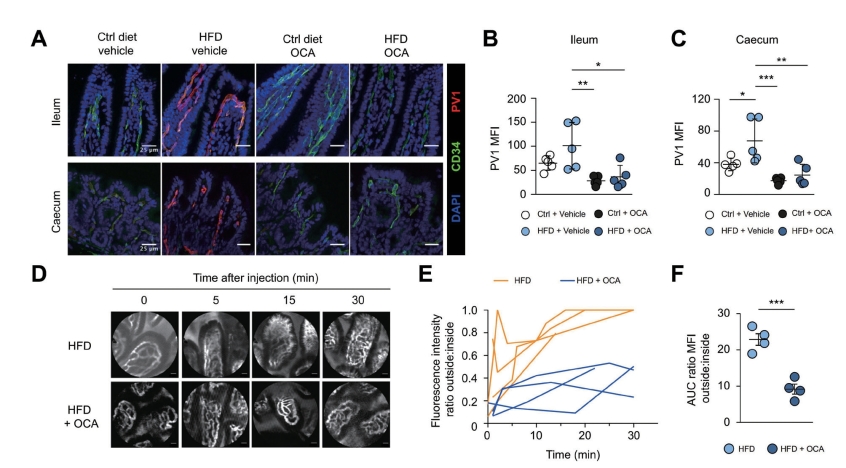
图5-5-5 FXR激活控制GVB紧密性
注:A~F.小鼠喂饲Ctrl饲料或HFD持续1周并补充OCA。A~C.回肠和盲肠切片分析PV1表达。D~F.小鼠静脉注射500kDaFITC-葡聚糖,通过活体探针进行共聚焦显微镜成像。D.在指示的时间的内窥镜视频的代表性照片显示。E.外/内荧光比随时间绘制。F.计算每只小鼠的AUC。
除了HFD模型导致类似于轻度NASH的代谢紊乱,研究者还测试了MCDD模型,该模型概括了更严重的NASH病理特征。首先评估了MCDD是否可以在GVB中引起扰动。用MCDD或对照饲料喂养小鼠1周,评估回肠中PV1的表达。如图所示,MCDD诱导PV1表达明显上调,OCA可纠正这种上调作用。这些结果表明,MCDD也可诱导GVB损伤,并且OCA在该模型中也具有保护作用。为了评价OCA改善NASH的疗效,用MCDD喂养小鼠2周,在肝损伤发生后通过血清中ALT浓度的升高和肝脏中的脂质积累来评估其疗效。然后每天给仍然喂食MCDD的小鼠口服OCA持续2周,发现MCDD诱导的上调的PV1表达被OCA在回肠和结肠中恢复,表明其能够封闭受损的GVB并防止进一步的MCDD诱导的损伤。此外,2周的OCA治疗治愈了肝脏损伤,降低了ALT水平和肝脏中的脂质积累。这些数据提示,OCA可能通过FXR激活,再通过上皮细胞间接或直接对内皮细胞的作用来控制GVB完整性。事实上,FXR在内皮细胞中表达,具有调节炎症、血管紧张等功能。由于GVB的完整性受Wnt/β-catenin信号通路的控制,实验评估了OCA是否可以激活该通路,即将原代内皮细胞暴露于OCA,评估β-catenin下游靶基因的表达。结果表明,OCA不仅上调了Lef1和Ccdn1β-catenin靶基因,而且上调了紧密连接蛋白Cldn5和ZO-1的编码基因。总之,OCA可以通过激活Wnt/β-catenin信号通路并上调紧密连接蛋白而直接作用于内皮细胞,从而实现GVB保护和内皮细胞封闭。在证明GVB损伤是NASH发生的前提条件后,也分析了是否可以检测到NASH患者肠道中PV1的上调,故测试了9例NASH患者结肠镜检查期间获得的结肠活检组织中PV1的表达。并作为对照,分析了来自肿瘤患者的结肠健康部分。NASH患者肠内皮血管中PV1的表达上调,表明GVB在人类NASH的发病机制中也受到损害。
研究发现,由于GVB紊乱引起的肠道通透性增加可能是导致整个细菌或细菌代谢产物通过门静脉循环转移到肝脏,并最终进入体循环的原因。通过保护GVB,激活内皮细胞中的Wnt/β-catenin信号通路,可以预防NASH及其相关的代谢综合征。这提示,GVB可以作为一个新的治疗靶点。然而,由于目前的研究不能仅在肠内皮细胞中控制Wnt/β-catenin信号通路的激活,因此不能排除肝内皮细胞中该通路激活的伴随效应。此外,研究证明,用OCA靶向FXR可以导致内皮细胞中Wnt/β-catenin信号通路的激活和GVB的封闭,从而抑制潜在有害细菌及其相关代谢物的进一步易位,对NASH控制具有明显的影响。这可能有助于解释OCA在NASH患者中的有益作用。同时,深入研究肠道上皮屏障的作用,特别是GVB在其他系统性疾病中的作用,有助于整个肠—肝脑轴的临床研究,并可能为其治疗干预提供新的研究策略。
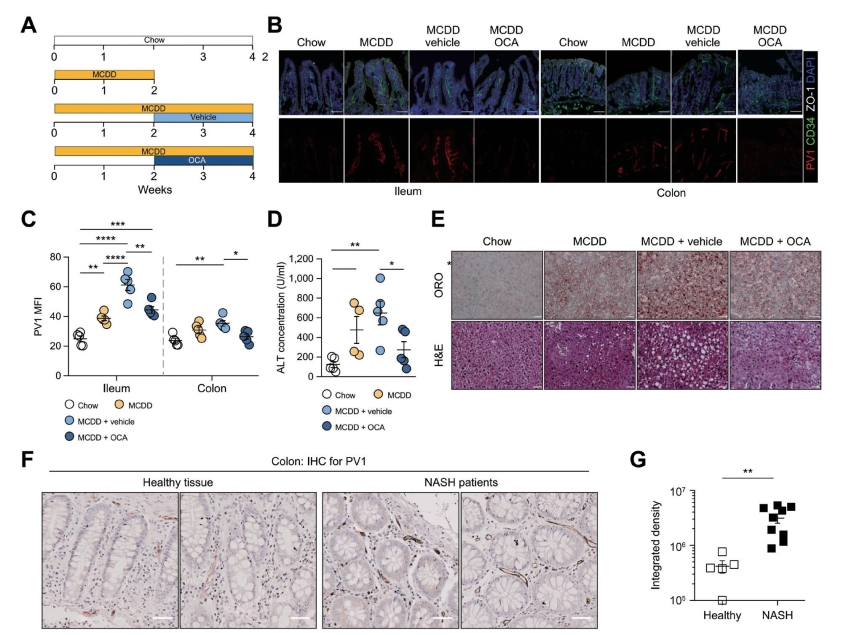
图5-5-6 奥贝胆酸治疗可改善MCDD模型的GVB和肝损伤(www.chuimin.cn)
注:A.小鼠在给予OCA或其载体前喂食饲料或MCDD2周。B.回肠和结肠切片进行CD34(绿色)、PV1(红色)、ZO-1(白色)和DAPI(蓝色)表达染色。C.对CD34+区域进行PV1 MFI定量。D.测定喂食CHOW或MCDD和OCA处理或不处理的小鼠血清ALT浓度。E.肝脏切片进行H&E或ORO染色分析。F.NASH患者的健康组织或结肠进行PV1染色。G.对两组PV1染色进行定量。
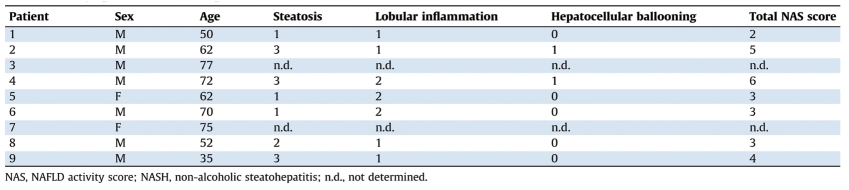
表5-5-1 NASH患者的病理学特征
脂肪性肝病一般要经历一系列的病理状态,从肝脏脂肪堆积(脂肪变性),到肝细胞变性(膨胀),炎症(脂肪性肝炎),最终进展为肝硬化和肝细胞癌。脂肪性肝病可能是长期过量饮酒(酒精性肝病)或内脏肥胖和代谢综合征(不饮酒)的结果,导致非酒精性脂肪肝(NAFLD),而非酒精性脂肪性肝炎可演变为非酒精性脂肪性肝炎(NASH)。几个可能并行作用的因素与NASH的发展有关,包括遗传易感性、表观遗传学改变、胰岛素抵抗、脂质代谢异常、氧化应激、脂毒性、线粒体功能障碍、内质网应激、肝细胞凋亡、肝星状细胞的激活、免疫细胞的激活和募集,以及炎性细胞因子的产生、脂肪因子的改变和肠道菌群失调。
该研究较好地将微生物与上皮和肠道血管通透性的增加以及NASH的发展联系起来,并发现①肠道血管屏障的破坏是NASH发病机制的早期事件,也是饮食诱导失调的结果。②同时,GVB的损害是持续的,因为仍然在NASH的炎症模型中观察到(60%HFD)。此外,GVB干扰是NASH发展所必需的,而GVB也可以作为药物干预的新靶点。③FXR激动剂OCA可以激活Wnt/β-catenin信号通路,从而封闭GVB。同时,HFD喂养期间给予OCA可以抑制GVB中PV1的上调和随后增加的通透性,并且还能够恢复MCDD模型中PV1的表达。该研究也为肠—肝脑轴的临床研究及干预治疗提供新的研究思路。
肠道微生物的重要作用已在临床前NAFLD/NASH模型和NASH患者中明确确立。小肠内细菌过度生长及定性微生物群异常可损害肠黏膜的屏障功能,导致黏膜通透性增强,内毒素随之转移至体循环。肠屏障在肝脏疾病发展中的作用已被确定,但仍有几个问题尚待解决,比如目前并不清楚肠道通透性增加是否是肝病的原因或结果,还需未来进一步深入研究探讨。
有关微生物与人类健康的文章

综上所述,HFD过程中增加的内皮通透性和细菌易位表明GVB破坏是NASH发展的早期事件,通常发生在肝脏脂肪变性之前。在HFD期间观察到GVB的中断后,研究者评估了它在NASH诱导中的作用。先前已经证明,干扰内皮细胞中的Wnt/β-catenin信号通路是鼠伤寒沙门菌诱导GVB破坏的一种机制。这表明,在完整的GVB存在下,游离细菌进入肝脏的易位受到阻碍。总之,这些结果表明IEB本身的损伤不足以诱导NASH,而GVB干扰也是必需的。......
2023-11-16

小鼠灌胃LPS后24小时发现ZO-1表达显著降低,表明IEB遭到损伤;48小时后LPS引起内皮细胞PV1表达增加,且呈剂量依赖性,表明内皮细胞暴露于高浓度LPS时GVB受到了破坏。上述结果表明,HFD喂养的早期,导致IEB破坏从而引发细菌易位,随后是GVB遭到破坏。图5-5-1周的HFD喂养足以引起肠道血管屏障的破坏注:A~C.小鼠在取肠前,分别用对照组饮食和HFD喂养48小时。......
2023-11-16

所有血管的内壁都衬着一层薄薄的上皮细胞,称之为内皮细胞。实际上毛细血管就是由单层内皮细胞相互连接、卷曲而成的。因此,预防动脉硬化的根本措施是保持内皮细胞屏障的完好。当血管内皮细胞受到损伤时,它也会召集炎症细胞,在血管壁上发生炎症反应。因此,预防动脉硬化的第一要务,就是保护血管内皮细胞不受损伤。......
2023-11-03

使用这种方法,研究者确认GVB通透性增加导致了细菌易位,在HFD喂养的小鼠中,其肠道血管对染料具有渗透性。有趣的是,尽管体重和脂肪组织大小增加,但观察到的GVB和IEB破坏先于肝脏脂肪变性、脂肪细胞扩大或胰腺损伤的任何迹象。此外,GF小鼠对HFD诱导的NASH具有抵抗力,证实了假设,即肠道细菌易位是导致NASH发展的原因。综上所述,这些结果表明HFD修饰了肠道微生物组成,导致了影响GVB的生态失调,并与肠血管通透性增加相关。......
2023-11-16

3.术前应用抗生素,控制和预防腹腔感染。肠黏膜刮除后即形成肠浆肌层片,去除系膜的控制钳,缝扎肌层的活跃出血点,修剪肠片边缘后即制成带血管蒂的肠浆肌层片。肠片的浆膜面覆盖在肠瘘部肠袢的浆膜面上既有利于愈合,又可减少瘢痕挛缩。2.胃肠减压保留至胃肠功能恢复后。图2-31剖开截取的肠管对系膜面的肠壁图2-32刀片刮除肠片上的肠黏膜图2-33将带蒂肠片浆膜面覆盖瘘口部位缝合固定两圈图2-34肠外瘘带蒂肠浆肌层片覆盖修补术......
2024-01-08

因而古代诗人写有不少观棋诗。唐代诗人温庭筠、可隆、释子兰、释贯休等,南唐诗人李从谦等,宋代诗人郑侠、石介、邵雍、苏轼、黄庭坚、强至等,清代诗人钱谦益、吴伟业、袁枚、毕沅等,都写有题为《观棋》或诗题中有“观棋”或“观弈”词语的诗。古代诗人喜欢观棋,或认为观棋可以置身局外,不为输赢累心。毕沅认为,观棋者中有高手,对棋势看得清楚明白,并用轻蔑的眼光看着困惑的弈棋者。......
2023-11-21

糖尿病是以血糖升高为主要表现的新陈代谢性紊乱。即使Ⅰ型糖尿病患者也应该注意体育锻炼,因为服用胰岛素存在着可能用药量过大而诱发心血管疾病的危险。对糖尿病患者来说,体育锻炼最大的作用是控制体重。体育锻炼是糖尿病患者康复中一个不容忽视的重要组成部分。(二)Ⅱ型糖尿病患者锻炼的注意事项锻炼的持续时间是最重要的因素,应该长于Ⅰ型糖尿病。......
2023-11-03
相关推荐