NASH患者肠内皮血管中PV1的表达上调,表明GVB在人类NASH的发病机制中也受到损害。这可能有助于解释OCA在NASH患者中的有益作用。F.NASH患者的健康组织或结肠进行PV1染色。该研究较好地将微生物与上皮和肠道血管通透性的增加以及NASH的发展联系起来,并发现①肠道血管屏障的破坏是NASH发病机制的早期事件,也是饮食诱导失调的结果。肠道微生物的重要作用已在临床前NAFLD/NASH模型和NASH患者中明确确立。......
2023-11-16
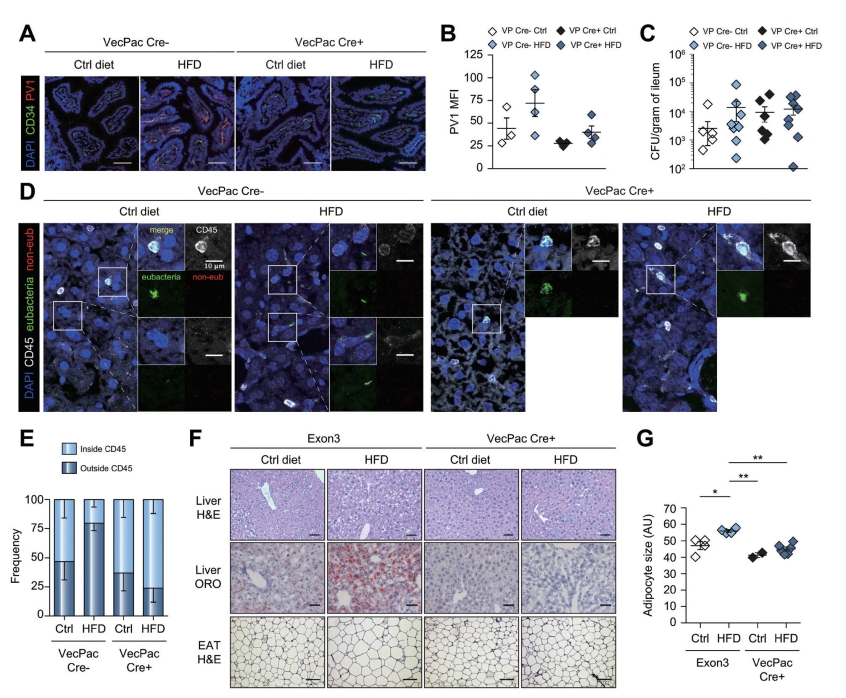
图5-5-4 内皮特异性功能增强的小鼠对脂肪变性诱导具有抵抗力
注:(A-E)β-catenin获得功能的小鼠用他莫西芬喂养2天诱导重组,然后用Ctrl饮食或HFD喂养1周或(F、G)18周;(A、B)回肠切片分析PV1的表达和(C)确定CFU。(D、E)肝脏切片在CD45(白色)和DAPI(蓝色)染色之前提交真细菌(绿色)和非EUB(红色)Fish原位杂交。侧面图像显示主图像中由正方形划分的放大区域的合并和单独染色。为每只小鼠计数细菌,并(E)测定CD45+细胞内或外的细菌百分比。F.喂养18周后,对EAT和肝脏切片进行H&E或ORO染色分析。第一行,肝脏苏木精伊红染色;第二行,肝脏ORO染色;第三行苏木精伊红染色,测量脂肪细胞直径并显示在G。(www.chuimin.cn)
在雌性C57BL/6小鼠中进行6周的HFD喂养后也获得了类似的结果,这些小鼠也出现延迟的疾病发展和更广泛的糖尿病前期状态(图5-5-4A)。同样在这种情况下,小鼠增加了它们的体质量和内脏脂肪组织(图5-5-4B)以及在没有肝脏脂肪变性或胰岛素抵抗的情况下(图5-5-4B),它们显示肠血管内皮细胞上PV1表达增加,ZO-1表达减少(图5-5-4E)。综上所述,HFD过程中增加的内皮通透性和细菌易位表明GVB破坏是NASH发展的早期事件,通常发生在肝脏脂肪变性之前。在HFD期间观察到GVB的中断后,研究者评估了它在NASH诱导中的作用。先前已经证明,干扰内皮细胞中的Wnt/β-catenin信号通路是鼠伤寒沙门菌诱导GVB破坏的一种机制。因此,使用VE-cadherinCre[Cdh5(PAC)-creERT2]小鼠与β-catlox(Ex3)/lox(Ex3)杂交,后者包含β-catenin基因外显子两侧的2个FLOX序列,从而迫使小鼠仅在内皮细胞中激活β-catenin。服用他莫昔芬后,在Cre+小鼠中,β-catenin的第3外显子被删除,导致β-catenin的不可降解形式和功能获得(GOF)表型。当β-连环蛋白被组成性激活时,GVB不能被干扰。使用外显子3的浮动小鼠β-catlox(Ex3)/lox(Ex3)或Cre-litterate小鼠作为对照,它们来自相同的母系(共享相同的菌群),具有相似的结果。Cre+和Cre-小鼠喂养对照饲料或HFD1周,来评估PV1可及性。如图5-5-4A、B,HFD不能诱导β-cateninGOF小鼠PV1上调。正如预期的那样,由于GOF只发生在内皮细胞,上皮细胞不受影响,细菌在HFD后仍然可以转移到回肠和盲肠(图5-5-2C)。接下来,分析了肝脏的细菌移位,发现Cre+β-cateninGOF小鼠在喂食HFD时与对照组小鼠相似(图5-5-4D、E)。在HFD喂养的Cre-小鼠中,可以找到游离的细菌,而不是被CD45+免疫细胞内化,而在Cre+小鼠中检测到的大多数细菌是在免疫细胞内。这表明,在完整的GVB存在下,游离细菌进入肝脏的易位受到阻碍。当小鼠喂食HFD较长时间,以诱导肝脏脂肪变性时,观察到Cre+GOF小鼠没有出现脂肪细胞扩大(图5-5-4F、G),并且完全不受NAFLD的保护,如组织学和肝脏中缺乏脂质积累所示(图5-5-4F)。在Cre+GOF小鼠中,还观察到HFD诱导的血糖水平的改善。有趣的是,HFD喂养10天导致Cre-小鼠脂肪组织中的白细胞募集,包括CD8+T细胞和炎性单核细胞,而不是Cre+GOF小鼠。总之,这些结果表明IEB本身的损伤不足以诱导NASH,而GVB干扰也是必需的。
有关微生物与人类健康的文章

NASH患者肠内皮血管中PV1的表达上调,表明GVB在人类NASH的发病机制中也受到损害。这可能有助于解释OCA在NASH患者中的有益作用。F.NASH患者的健康组织或结肠进行PV1染色。该研究较好地将微生物与上皮和肠道血管通透性的增加以及NASH的发展联系起来,并发现①肠道血管屏障的破坏是NASH发病机制的早期事件,也是饮食诱导失调的结果。肠道微生物的重要作用已在临床前NAFLD/NASH模型和NASH患者中明确确立。......
2023-11-16

小鼠灌胃LPS后24小时发现ZO-1表达显著降低,表明IEB遭到损伤;48小时后LPS引起内皮细胞PV1表达增加,且呈剂量依赖性,表明内皮细胞暴露于高浓度LPS时GVB受到了破坏。上述结果表明,HFD喂养的早期,导致IEB破坏从而引发细菌易位,随后是GVB遭到破坏。图5-5-1周的HFD喂养足以引起肠道血管屏障的破坏注:A~C.小鼠在取肠前,分别用对照组饮食和HFD喂养48小时。......
2023-11-16

使用这种方法,研究者确认GVB通透性增加导致了细菌易位,在HFD喂养的小鼠中,其肠道血管对染料具有渗透性。有趣的是,尽管体重和脂肪组织大小增加,但观察到的GVB和IEB破坏先于肝脏脂肪变性、脂肪细胞扩大或胰腺损伤的任何迹象。此外,GF小鼠对HFD诱导的NASH具有抵抗力,证实了假设,即肠道细菌易位是导致NASH发展的原因。综上所述,这些结果表明HFD修饰了肠道微生物组成,导致了影响GVB的生态失调,并与肠血管通透性增加相关。......
2023-11-16

梁武帝不但不治他的罪,还主动地安慰他,宽以待之。梁武帝分封了不少同姓王。梁武帝有令,诸王在外,必须有职有权。梁武帝最大的失误在于轻信了侯景,最后导致了破坏性极大的“侯景之乱”。起兵前宣布梁武帝和梁朝百官的罪状,说他们“割剥民众,以供贪欲”。梁武帝的子孙们都拥兵自重,不肯恋战,号称百万的梁军不堪一击,侯景很快就攻占了建康城,立萧正德为帝。梁武帝病饿而死。......
2023-08-31

大学的不同功能之间是相互区别、相互联系、相互促进、相互制约的,处理得好,能促进大学功能的发挥;反之,则会引起功能整体性遭到破坏,从而导致大学功能的错位与失衡。然而,这样的大学已失去了共同的理念和目的,已称不上有机体。大学只作为象牙塔或服务站,显然是两个不幸的极端。然而,在充满活力的大学系统中,大学的功能却因为大学在对社会发展要求的回应中,有所偏废,发生错位,这是大学发展极为不幸的遭遇。......
2023-11-26

图62负外部性条件下的海洋生态补偿在海洋生态系统服务市场不完全的条件下,海洋资源的开发影响到海洋生态系统服务造成其损失,由于海洋生态破坏者的边际私人成本MPC小于该破坏行为的边际社会成本MSC,因而存在负外部性现象。而如果从整个社会福利的角度出发,海洋资源开发行为所造成的海洋生态服务损失量应低于Q*,只有这样才能实现海洋生态资源的可持续利用。......
2023-11-09

从历次地震看,底部空旷的建筑物遭受破坏是普遍现象,主要是底部空旷形成了结构的软弱层,软弱层的位移变形大,钢筋混凝土柱承受不了大变形而破坏。有些柱子则因承载力不足而造成薄弱层破坏。地震时附近没有发生地面裂缝或其他地面变形,建筑物主要是经受地面摇晃振动,底层柱子严重破坏,裙房柱子全部是普通配箍柱,混凝土全部碎裂,竖向钢筋压屈,主楼底部为螺旋配箍柱,保护层脱落。......
2023-08-23

3.术前应用抗生素,控制和预防腹腔感染。肠黏膜刮除后即形成肠浆肌层片,去除系膜的控制钳,缝扎肌层的活跃出血点,修剪肠片边缘后即制成带血管蒂的肠浆肌层片。肠片的浆膜面覆盖在肠瘘部肠袢的浆膜面上既有利于愈合,又可减少瘢痕挛缩。2.胃肠减压保留至胃肠功能恢复后。图2-31剖开截取的肠管对系膜面的肠壁图2-32刀片刮除肠片上的肠黏膜图2-33将带蒂肠片浆膜面覆盖瘘口部位缝合固定两圈图2-34肠外瘘带蒂肠浆肌层片覆盖修补术......
2024-01-08
相关推荐