综上所述,HFD过程中增加的内皮通透性和细菌易位表明GVB破坏是NASH发展的早期事件,通常发生在肝脏脂肪变性之前。在HFD期间观察到GVB的中断后,研究者评估了它在NASH诱导中的作用。先前已经证明,干扰内皮细胞中的Wnt/β-catenin信号通路是鼠伤寒沙门菌诱导GVB破坏的一种机制。这表明,在完整的GVB存在下,游离细菌进入肝脏的易位受到阻碍。总之,这些结果表明IEB本身的损伤不足以诱导NASH,而GVB干扰也是必需的。......
2023-11-16
在发现跨越上皮的细菌易位后,研究者假设如果GVB被破坏,如PV1表达增加所示,在肝脏中也应该检测到细菌。为了检测细菌的存在和位置,使用探针进行FISH分析来检测Eubacteria16SrRNA的区域,并对CD45进行免疫染色来检测淋巴细胞。实验发现,对照组小鼠的肝脏中含有少量的细菌,这些细菌大多位于CD45+免疫细胞内,尽管尚不清楚这些细菌是驻留的肝脏细菌还是从其他地方穿梭过来的。相反,在喂食HFD的小鼠的肝脏中,在免疫细胞外的薄壁组织中发现了细菌,这表明它们可以自由迁移到肝脏。与细菌易位增加一致的是,喂食HFD的小鼠血清中的LPS水平始终高于喂食对照饲料的小鼠(图5-5-3C)。为了从功能上评估GVB是否被有效破坏,进行了荧光内窥镜检查。用HFD或对照饲料喂养小鼠1周,静脉注射类似细菌大小的高分子量FITC-葡聚糖荧光探针(500KDa),通过荧光活体内窥镜评估染料向回肠固有层渗出的能力。使用这种方法,研究者确认GVB通透性增加导致了细菌易位,在HFD喂养的小鼠中,其肠道血管对染料具有渗透性。有趣的是,尽管体重和脂肪组织大小增加,但观察到的GVB和IEB破坏先于肝脏脂肪变性、脂肪细胞扩大或胰腺损伤的任何迹象。众所周知,HFD会引起小鼠肠道微生物组成的变化,因此在观察到IEB和GVB破坏是HFD引起的早期事件后,研究者通过进行粪便微生物移植(FMT)来评估饮食诱导的微生物变化是否是GVB破坏的原因。结果表明,与SPF小鼠相比,成年无菌小鼠表现出更高的PV1表达,这表明微生物可能参与控制GVB。然而,无菌小鼠的微生物重建不会导致PV1正常化,这表明至少在成年小鼠中GVB的损害不能被微生物纠正。此外,GF小鼠对HFD诱导的NASH具有抵抗力,证实了假设,即肠道细菌易位是导致NASH发展的原因。基于这些原因,研究者对SPF小鼠进行FMT,供体小鼠分别饲喂HFD或对照饲料,1周后收集粪便及相关黏液菌群,转入受体小鼠体内。受体小鼠被维持在标准的饲料中,1周后分析体重增加并收集其器官。与从对照饮食中接受FMT的小鼠相比,接受来自HFD喂养的小鼠的FMT的小鼠即使喂食标准饮食,也显示出更多的附睾脂肪组织。此外,用来自HFD喂养的小鼠的FMT处理的小鼠的GVB显示出增加的PV1表达。综上所述,这些结果表明HFD修饰了肠道微生物组成,导致了影响GVB的生态失调,并与肠血管通透性增加相关。
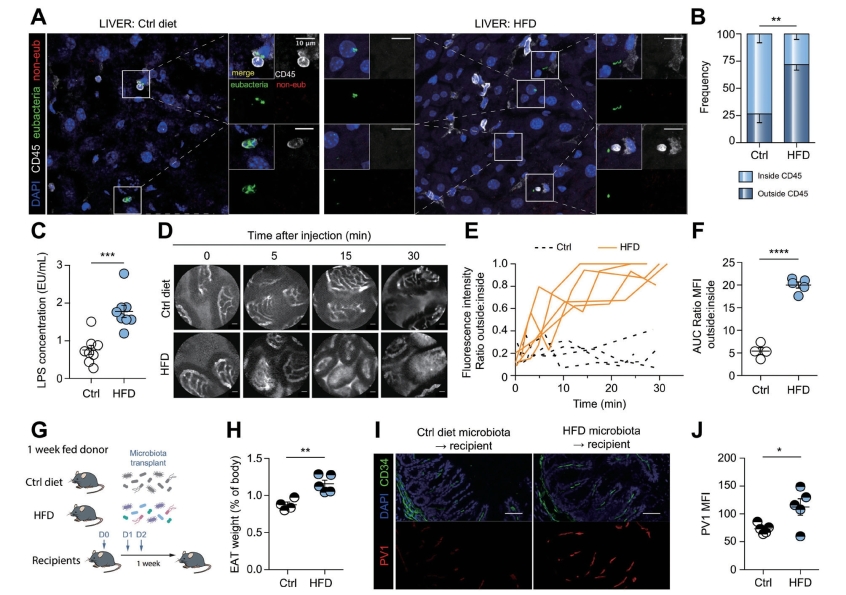
图5-5-3 GVB泄漏导致菌群相关移位(www.chuimin.cn)
注:A.用对照(Ctrl)饲料或HFD喂养(A~F)小鼠1周。(A)肝脏切片进行菌体(绿色)和非EUB(红色)Fish原位杂交,然后进行CD45(白色)和DAPI(蓝色)染色。侧面图像显示主图像中由正方形划分的放大区域的合并和单独染色。B.为每只小鼠计数细菌,并测定CD45+细胞内外的细菌百分比。C.测定HFD喂养1周小鼠血清中LPS水平。D、F.1周龄小鼠静脉注射500 kDa FITC-葡聚糖,通过活体探针共聚焦显微镜成像。来自内窥镜视频在指定时间点的代表性照片以C表示。E.随时间绘制荧光比率。F.计算每只小鼠的AUC。G.对1周喂养的供体进行粪便微生物移植,1周后对受体进行分析。H.测定器官和体重,并计算进食重量(占身体的百分比)。(I)盲肠为PV1(红色),CD34(绿色)和DAPI(蓝色)染色,在CD34+区域(J)上进行PV1的量化。
有关微生物与人类健康的文章

综上所述,HFD过程中增加的内皮通透性和细菌易位表明GVB破坏是NASH发展的早期事件,通常发生在肝脏脂肪变性之前。在HFD期间观察到GVB的中断后,研究者评估了它在NASH诱导中的作用。先前已经证明,干扰内皮细胞中的Wnt/β-catenin信号通路是鼠伤寒沙门菌诱导GVB破坏的一种机制。这表明,在完整的GVB存在下,游离细菌进入肝脏的易位受到阻碍。总之,这些结果表明IEB本身的损伤不足以诱导NASH,而GVB干扰也是必需的。......
2023-11-16

小鼠灌胃LPS后24小时发现ZO-1表达显著降低,表明IEB遭到损伤;48小时后LPS引起内皮细胞PV1表达增加,且呈剂量依赖性,表明内皮细胞暴露于高浓度LPS时GVB受到了破坏。上述结果表明,HFD喂养的早期,导致IEB破坏从而引发细菌易位,随后是GVB遭到破坏。图5-5-1周的HFD喂养足以引起肠道血管屏障的破坏注:A~C.小鼠在取肠前,分别用对照组饮食和HFD喂养48小时。......
2023-11-16

NASH患者肠内皮血管中PV1的表达上调,表明GVB在人类NASH的发病机制中也受到损害。这可能有助于解释OCA在NASH患者中的有益作用。F.NASH患者的健康组织或结肠进行PV1染色。该研究较好地将微生物与上皮和肠道血管通透性的增加以及NASH的发展联系起来,并发现①肠道血管屏障的破坏是NASH发病机制的早期事件,也是饮食诱导失调的结果。肠道微生物的重要作用已在临床前NAFLD/NASH模型和NASH患者中明确确立。......
2023-11-16

指令有右移位指令、左移位指令、循环右移位指令、循环左移位指令。循环移位指令类别见表1-12。SHRB指令如图1-15所示,移位寄存器以功能框的形式编程,指令名称为SHRB。在语句表中,移位寄存器的指令格式为SHRB DATA,S_BIT,N。例如,移位寄存器指令的应用如图1-16所示。图1-16 移位寄存器指令应用从图1-16中可以看出,S_BIT=V10.0,N=4>0,最高位为V10.3。......
2023-06-26

原核生物中还有另一类生物称作古细菌,是科学家依据演化关系而另辟的类别。细菌的形状相当多样,主要有球状、杆状,以及螺旋状。细菌对人类活动有很大的影响。总的来说,这世界上约有5×1030个细菌,其生物量远大于世界上所有动植物体内细胞数量的总和。在此后的30亿年间,细菌和古细菌都是主要的生物。之后,细菌又发生了第二次的剧烈演化,有一部分的古细菌与其他细菌内共生,成为了现今真核生物的祖先。......
2023-11-16

最后,是从因果思维转向相关思维。当全部数据都加入分析的时候,只要有一个反例,因果关系就不成立,因此在大数据时代,因果关系变得几乎不可能。大数据透露出来的信息,确实会得出颠覆性的结论,所以我们不能用因果关系去探求其中的关联,而应该用相关思维去利用大数据带来的结论与价值。......
2023-07-02

(五) 静脉血栓栓塞症由于PTE与DVT在发病机制上存在关联,是同一种疾病的两个不同阶段,因此统称为VTE。但有约20%确诊为APTE的患者血气分析结果正常。其局限性主要在于对亚段及远端肺小动脉血栓的敏感性较差。低危患者如果CT结果正常,可排除PTE;对临床评分为高危的患者,CT肺动脉造影结果阴性并不能除外单发的亚段PTE。对怀疑PTE的患者,应常规检测有无下肢DVT。其低度可疑组中仅有5%确诊为PTE。......
2023-12-07

人体数据知多少人体是一架最精密、最高级的“机器”,各种“零件”规格有度、功能奇特。科学家们通过人体数据的测定来说明其奥秘。器官:分布在人体全身的器官约有100个,其中包含各种组织800多种。人体血管总数加在一起约达10万6千多米长,可围绕地球数圈。尽管放射性元素在裂变时会放出高能粒子损伤人体细胞,但由于量少,且人体组织具有自行修复的机能,故受伤的细胞可随时得以修复。......
2023-12-04
相关推荐