另外一项纳入81位研象对象的葡萄牙研究发现与患有慢性胃炎的患者相比,胃癌患者的胃部菌群多样性明显较低。然而,有研究表明胃癌缓和胃部菌群多样性较高。近期,Liu等人研究276例患者特定胃部菌群多样性和丰富度与胃癌发生的关系。通过检测胃癌患者的正常、癌旁和癌组织,研究人员发现与正常胃组织相比,胃癌和癌旁组织的菌群多样性和丰富性降低。目前,胃部菌群多样性与胃癌进展过程是否存在相关性尚不清楚。......
2023-11-16
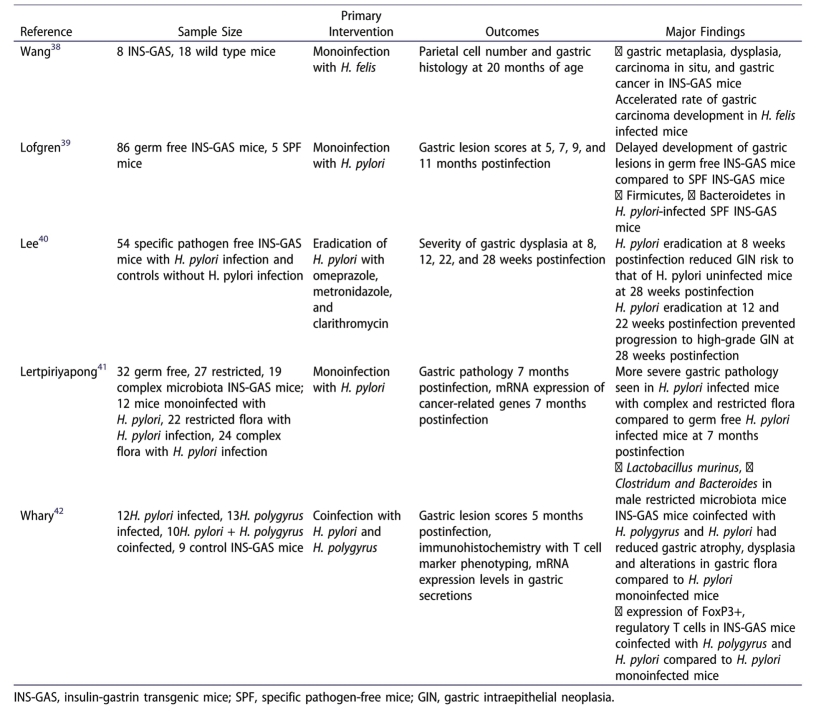
前面提到的几项研究表明,胃微生态环境与胃癌的发生有关。甚至对某些微生物在胃癌发生、发展过程中的潜在作用也给出合理的解释。虽然上述研究未阐明因果关系,但最近基于转基因小鼠模型的研究进一步阐明了胃微生态环境与胃癌的关系。胰岛素—胃泌素转基因(INS-GAS)小鼠模型具有较高的循环胃泌素水平,并持续促进胃酸生成,导致萎缩性胃炎。此外,80%的转基因小鼠在感染Hp后6个月内即可发展为胃肠道肿瘤,高于人类感染Hp后进展为肿瘤的比例。利用INS-GAS小鼠模型,几项研究尝试揭示微生物与胃癌发展之间的因果关系(表3-4-3)。
2008年,第一项基于转基因小鼠模型的研究表明微生物与胃癌间存在关联。
Lee等人在用三联疗法(甲硝唑、奥美拉唑、克拉霉素)治疗INS-GAS小鼠后发现,在这些小鼠中根除Hp可以降低感染几周后小鼠胃不典型增生的严重程度。更为有趣的是,他们在用三联疗法治疗未感染Hp的INS-GAS小鼠后发现相似结果。该研究揭示抗生素治疗对Hp以外的微生物具有潜在作用。鉴于这项研究仅关注在根除Hp在胃癌发展中的作用,未观察经三联疗法治疗后微生物多样性或特定微生物丰度的变化。
其他研究也利用INS-GAS小鼠模型来探索胃微生物与胃癌之间的联系。特别的是,有研究尝试在INS-GAS小鼠模型中证明微生物如何影响胃癌的发展。通过操纵转基因小鼠模型,Lofgren等人发现,在感染Hp11个月后,与INS-GAS小鼠相比,无菌INS-GAS小鼠的胃部病变减少且微生态环境更复杂。为深入探索上述结果,Lertpiriyapong等人评估多样化菌群的存在是否是胃部疾病进展的必要条件。为此,研究人员比较了3组(复杂型、无菌型和局限型)具有不同微生物组成的INS-GAS小鼠在感染后发生胃癌的风险。该研究发现菌群构成局限组与复杂组的小鼠中发展为胃癌的比例相似,但是与无菌小鼠相比,菌群构成局限组小鼠发生胃炎、上皮缺损、泌氧腺萎缩、上皮增生和异型增生的情况显著增加。综上所述,Hp可以与其他微生物协同作用,促进胃癌的发生。在感染Hp后,其他微生物可能在胃癌的发生发展中起一定作用,但不一定是胃癌发生的必要条件。既往研究推测Hp感染引起的胃萎缩所致的贲门失弛缓症,可能除了引起下消化道细菌定植外,还可能导致共生细菌的过度生长,且这种过度生长的细菌可能在胃癌的发生发展中起一定作用。然而,在INS-GAS小鼠模型中,似乎只有有限和复杂的微生物构成具有相似的可能性导致胃癌的发生。
除了表明在Hp感染后,胃其他微生物对胃癌的发展起作用外,基于INS-GAS小鼠模型的研究还可为胃部疾病进展过程中个体的潜在治疗干预提供线索。例如,研究人员发现与单独感染Hp的INS-GAS小鼠相比,混合感染的INS-GAS小鼠具有较低可能性发生Hp相关性胃萎缩和异型增生并且更不容易在肠道菌群较不丰富的INS-GAS小鼠中定植。研究人员假设,这一发现是由于蠕虫诱导Th2相关炎症反应上调,并增加了调节性T细胞向胃的聚集,从而保持了壁细胞功能,维持正常pH。本研究提示,由其他致病菌引起的免疫调节反应可能是预防Hp相关性胃炎向胃癌进展的一种潜在治疗方式,值得进一步研究。
表3-4-3 基于INS-GAS小鼠模型的微生态与胃癌研究(www.chuimin.cn)
近年来,科研人员和临床医生日渐关注菌群在传染病、癌症、呼吸系统疾病、代谢性疾病和自身免疫性疾病等疾病过程中作用。然而,由于胃的酸性条件和以往培养技术的局限性,以前的胃部微生物的研究具有巨大挑战性,但随着新PCR技术和宏基因组的出现,胃微生物的研究在过去十年内显著增加。
到目前为止,大多数研究表明在从健康发展到胃癌的过程中,胃微生物发生了变化。然而,尽管有一个普遍的共识,即胃癌患者的微生物与对照组相比存在差异,但迄今为止,所存在的差异是多样性增加还是减少尚不明确。虽然大多数研究在分析时使用了相同的物种多样性衡量标准(Chao1或Shannon指数),但数据收集和测序技术等方面有所不同,故目前还不清楚这是否影响了基因组构建和随后的微生物物种鉴定。胃微生物与胃癌进展研究的一个主要局限性是这些研究都是回顾性且相互关联的。由于胃癌的发展需要几十年的持续时间,在整个过程中跟踪相同的人是不可行的,因此所有研究只能采用横断面研究设计,在某个时间点评估不同类型患者的菌群多样性。因此,需要进行纵向和前瞻性研究来评估肠道菌群随时间的变化。但是这些研究的可行性较差,因为只有3%的感染Hp的人可能发展为胃癌。既往研究在没有确定任何个体的胃微生物基线组成的情况下,已经将不同阶段的胃病患者的微生物相互比较,而在这些研究中无法解释饮食、疾病史或种族差异对患者胃微生物的影响。此外,疾病的治疗方式或患者后期的生活方式的改变也可能影响胃微生物。因此,难以在胃微生物和胃癌之间建立任何形式的因果联系,不过收集有关治疗和饮食的资料可能有助于控制混杂因素。
虽然关于胃微生物在胃癌发展过程中的作用仍然没有被证明因果关系,但基于INS-GAS小鼠模型的研究有助于阐明胃微生物在胃癌发展中的作用。Hp感染后其他胃部微生物的存在加速了胃癌的发展,但可能只有有限的微生物才能实现如此效果。应该开展Lertpiriyapong等人研究的重新实验以确认只有有限的胃微生物是加速INS-GAS小鼠胃癌发展所必需的。此外,关于免疫调节在防止胃病进展中的作用的进一步研究也是极有必要的,因为INS-GAS小鼠模型表明,其他病原体(如,蠕虫)的混合感染可通过上调调节性T细胞而起到保护作用。特别是宏基因组学研究可确定参与这一过程的微生物的基因家族。此外,虽然还没有发现Hp感染后发生胃癌所必需的单个微生物,但多项研究在胃癌患者中发现了几种丰度增加的微生物。这些菌属可能有促进肿瘤发展的机制,包括引发炎症、为肿瘤生长提供能量或产生致癌的N-亚硝基化合物。而其他看似具有保护作用的菌属在胃癌患者中减少,例如 Sphingobium Yanoikuyae。鉴于与人体相比,在INS-GAS小鼠模型中操纵微生物可行性更高,因此会开展进一步研究。未来应该开展大规模、多中心、前瞻性研究,确定胃癌相关的特异性微生物及胃癌进展过程中微生物的动态变化。随着胃微生物研究的增加,微生物的变化有可能成为预测疾病进展的标志物。此外,类似于根除Hp,可以通过操纵其他胃部微生物进行治疗从而降低发展为胃癌的风险。
胃癌是世界范围内主要的一种消化道肿瘤。随着高通量测序技术的不断发展,对于幽门螺杆菌之外的胃部菌群与胃部疾病的关联性研究逐渐兴起,但是仍然较少,且多为小样本量、横断面、单中心研究。本文通过整理现有的相关文献发现,与胃部健康个体相比,不同阶段胃癌患者或癌前病变/癌前疾病患者的胃微生物构成存在差异,但差异的结论尚不一致。胃中部分定植菌与胃癌发生相关,但仍有待寻找特异性的胃癌相关微生态。而基于胰岛素—胃泌素(INS-GAS)转基因小鼠模型的研究可以为深入探索胃微生物与胃癌的关联程度奠定基础。
有关微生物与人类健康的文章

另外一项纳入81位研象对象的葡萄牙研究发现与患有慢性胃炎的患者相比,胃癌患者的胃部菌群多样性明显较低。然而,有研究表明胃癌缓和胃部菌群多样性较高。近期,Liu等人研究276例患者特定胃部菌群多样性和丰富度与胃癌发生的关系。通过检测胃癌患者的正常、癌旁和癌组织,研究人员发现与正常胃组织相比,胃癌和癌旁组织的菌群多样性和丰富性降低。目前,胃部菌群多样性与胃癌进展过程是否存在相关性尚不清楚。......
2023-11-16

研究表明,在SCZ小鼠中,血清色氨酸在异源肠道微生物移植后立即下降。与HC小鼠相比,SCZ小鼠肠、脾、肝和血清中的色氨酸水平降低,血清5-HT水平降低,而肠、脾、肝中Kyn途径在异源微生物群移植结束时激活,但在10天后恢复到正常水平。小鼠行为学与血清色氨酸及其分解代谢产物的相关性分析表明,只有色氨酸与认知障碍呈正相关。图7-1-2移植SCZ粪便微生物的受体小鼠外周色氨酸代谢紊乱......
2023-11-16

为了研究汉族肥胖者肠道菌群的改变是否与宿主体内循环代谢物有关,对肥胖组和对照组人群的血清进行了非靶向代谢组学分析。氨基酸的靶向代谢组学进一步证实了瘦人和肥胖者之间代谢物的差异。综上所述,肠道微生物群的改变,特别是肥胖者肠道内拟杆菌属的减少可能与循环中较高的AAA和BCAA浓度有关。以上数据表明,肠道菌群的代谢可能与血清中肥胖相关氨基酸的水平有关。图11-1-3肠道微生物与血清氨基酸的关系......
2023-11-16

Hp感染引起的胃酸分泌障碍可能促进其他微生物在胃内定植,虽然微生物多样性与胃癌的相关性尚未达成共识,但已有多项研究表明特定的微生物与胃癌之间存在关联。虽然该研究无法表明因果关系,但部分揭示微生物在胃癌患者中过度表达的潜在机制。另一项研究表明,与对照组相比,Lachnospiracea在胃癌患者的相对丰度更高。特别是Fusobacterium菌属,该菌属是一种促炎性口腔菌属,曾因其在结肠癌和乳腺癌发生中的潜在作用而备受关注。......
2023-11-16

根据几项研究,构成肺微生物群的两个主要门为拟杆菌门和硬壁菌门。非肿瘤疾病中的肺微生物群微生物与各种炎症性肺疾病之间的关系是一个公认的问题。这些微生物群物种的持续存在将疾病转变为慢性病和慢性炎症。流感嗜血杆菌、肠杆菌属、大肠杆菌、肺炎球菌、军团菌和莫拉菌属等微生物已得到证实能驱动肺组织炎症。研究表明,在一些病例中,这些微生物与肺癌相关。该领域的最新研究证实,微生物群应被视为重要的诊断和预防指标。......
2023-11-16

一些疾病特别是心脑血管疾病和恶性肿瘤已成为威胁人类健康的主要杀手,医院往往是人满为患。由于缺少直接的证据,肠道微生物与人类健康之间的关系一直没有得到很好的解释。肠道微生物基因组与人体基因组一起,通过与环境因素的相互作用,通过不同方式影响人体的健康。如此庞大的肠道微生物群体通过与宿主的长期协同进化,已经成为一个与人体密不可分的后天获得的重要“器官”。......
2023-11-16

益生菌LGG通过抑制小鼠肝脏胆汁酸合成和促进胆汁酸排泄来预防肝纤维化,胆汁淤积性肝病的特点是肠道菌群失调和肝脏毒性胆汁酸过量。LGG治疗明显减轻了BDL小鼠的肝脏炎症、损伤和纤维化,并显著降低了肝脏BAs。因此,可以得出补充LGG可通过增加肠道FXR/FGF15信号通路介导的对BA从头合成的抑制作用来降低肝脏BA,并增加BA的排泄,从而防止BA过量诱导的小鼠肝损伤和纤维化。研究者评估了肝脏和肠道组织的炎症反应和系统性炎症。......
2023-11-16

阿尔茨海默症以进行性神经退行性疾病和认知功能障碍为临床特征,是世界范围内老年人致残的主要原因之一。然而,关于AD患者,尤其涉及AD患者患病过程中的肠道微生物失调的研究还比较少。该研究纳入97名50~85岁的受试者,其中阿尔茨海默症患者33名、AD发病前遗忘性轻度认知障碍患者32名、健康对照32名。aMCI组、AD组患者受教育程度与HC组相当,但AD组受教育程度低于aMCI组。与HC组相比,AD患者的抽象功能评分降低,aMCI患者无明显变化。......
2023-11-16
相关推荐