然而,也有相反的发现表明不同年龄组参与者的肠道微生物结构没有显著差异。总的来说,衰老与肠道失调增加有关,与肠道微生物多样性呈负相关。目前,许多技术可以用来分析肠道微生物群与人类免疫学、神经学和内分泌学的关系。......
2023-11-16
除了在致癌和肿瘤进展中的作用外,越来越多的证据表明肠道微生物群介导了化疗和免疫治疗的疗效和毒性。这使得肠道微生物群可以作为生物标志物来预测治疗反应或不良反应,同时也可以通过调节以改善患者癌症治疗和预后。虽然仍处于发展阶段,但一些研究已经为使用新颖和个性化的方法管理患者提供了见解。
5.1 化疗的治疗应用
新发现的证据表明,肠道菌群可以通过微生物移位、免疫调节、代谢、酶降解和生态多样性减少等多种机制,调节化疗药物的抗癌作用,包括5-氟尿嘧啶、环磷酰胺、吉西他滨和草酸铂等。在经过抗生素治疗或无菌处理的小鼠中,肿瘤浸润的骨髓源性细胞对治疗反应较差,导致化疗后活性氧产生不足和细胞毒性。肠道菌群在化疗耐药中的作用也被研究,根据实验数据显示F.nucleatum可以激活自噬,从而产生对奥沙利铂和5-氟尿嘧啶的耐药性。测量F.nucleatum和以它作为治疗目标可以为结直肠癌患者预后预测和治疗提供新的策略。此外,肠道菌群还控制着伊立替康(CPT-11)的代谢和副作用。伊立替康是SN-38的前体药,一种拓扑异构酶抑制剂,常用来治疗结直肠癌。从药理上讲,SN-38被宿主肝酶葡萄糖醛酸化为非活性结合物(SN-38G)。SN-38G通过胆汁排泄到达肠道,肠道细菌β-葡萄糖醛酸酶水解为SN-38,造成肠道损伤和严重腹泻。选择性抑制剂给予可以防止小鼠肠道中SN-38的活化及其伴随的毒性,说明了一种修饰微生物活性以减少化疗药物副作用的方法。
5.2 免疫治疗的治疗应用
免疫治疗是许多癌症的有效治疗方法,已成为癌症治疗的主要支柱。免疫检查点抑制剂可以去除T细胞激活的抑制信号,保证肿瘤反应T细胞能够产生有效的抗肿瘤反应。肠道微生物群是免疫治疗中有效免疫应答所必需的,并可影响针对程序性细胞死亡1(PD-1)、程序性细胞死亡1配体1(PD-L1)轴和细胞毒性T淋巴细胞相关抗原4(CTLA-4)轴的免疫检查点抑制剂的应答。特异性细菌与免疫治疗反应呈正相关,包括Akkermansia muciniphila、B.fragilis、Bifidobacterium spp.、Eubacterium limosum、Faecalibacterium spp.和Alistipesshahii。重要的是A.shahii灌胃重建了经抗生素处理小鼠对结肠肿瘤的免疫治疗反应。一项研究综合了3项抗PD-1抗体反应的鸟枪法宏基因组数据,观察到免疫治疗反应者中A.muciniphila和Ruminococcus champanellensis的富集,尽管在最初的研究中存在差异。这一发现为检测这些核心细菌作为免疫治疗反应的预测生物标志物提供了可能性。此外,2019年发表的一项研究已经确定了一个由11个菌株组成的联合体,该联合体可以增强免疫检查点抑制剂的作用,以抑制从小鼠结肠腺癌细胞系衍生的皮下肿瘤模型中的肿瘤生长。总的来说,这些结果意味着需要识别一致的微生物信号,这些信号可以预测免疫治疗反应,可以整合到临床试验和未来的病人护理中。肠道微生物群可能与免疫治疗的不良反应有关,如免疫检查点抑制剂相关结肠炎。拟杆菌门的增加与免疫检查点抑制剂相关结肠炎的抵抗力相关,而多胺转运和维生素B生物合成途径中基因的缺乏与大肠杆菌敏感性的增加相关。此外,一项病例报告了两例通过粪便微生物群移植成功治疗的难治性免疫治疗相关结肠炎,分别于53天和78天完成两个剂量后,完成肠道微生物变化,并彻底解决结肠炎。尽管免疫治疗可能不会像在其他恶性肿瘤中那样在所有结直肠癌亚型中治疗成功,但抗PD-1和抗CTLA-4检查点抑制剂可对微卫星不稳定性高或DNA错配修复缺陷的转移性结直肠癌提供持久的免疫反应。这部分结直肠癌表现出高突变负荷、肿瘤新表位、肿瘤浸润淋巴细胞和免疫检查点上调,使它们有利于PD-1阻断。虽然仍在研究中,但考虑到这些药物在某些结直肠癌患者中的广泛使用,肠道微生物群可用于增强治疗效果和最小化免疫治疗的副作用。
5.3 其他微生物相关的治疗方法
采用微生物制剂或它们的产物来预防或缩小肿瘤有巨大的潜力。这些新方法中许多的临床前数据都很有希望,包括使用抗生素抑制癌症相关细菌(例如,甲硝唑可以缩小Fusobacterium阳性异种移植小鼠的肿瘤体积)、补充共生物质增强癌症治疗(如,Bifidobacteria spp.、A.muciniphila和 Bacteroides spp.能改善抗肿瘤T细胞反应)、使用小分子抑制剂减少治疗的不良反应(如,针对细菌β-葡萄糖醛酸酶来最小化伊立替康产生的毒素)或预防癌症(如,针对细菌ClbP酶减少大肠杆菌素)。虽然FMT还没有在结直肠癌患者中验证,但目前正在进行试验其与癌症免疫治疗或化疗相结合的效果。此外,由于结直肠癌中宿主与微生物的相互作用部分是由微生物代谢物介导的,因此化学方法是一种很有前途的治疗策略这包括可以改变肠道微生物群(益生菌)或微生物群的代谢物(后生物)的食物成分。其他的新方法可能包括生物工程肠道微生物群、益生菌的基因工程合成和传递,或通过细菌素/噬菌体修饰肠道微生物群。更多的研究以评估这些工程产品在结直肠癌背景下的临床应用潜力是必要的。
 (www.chuimin.cn)
(www.chuimin.cn)
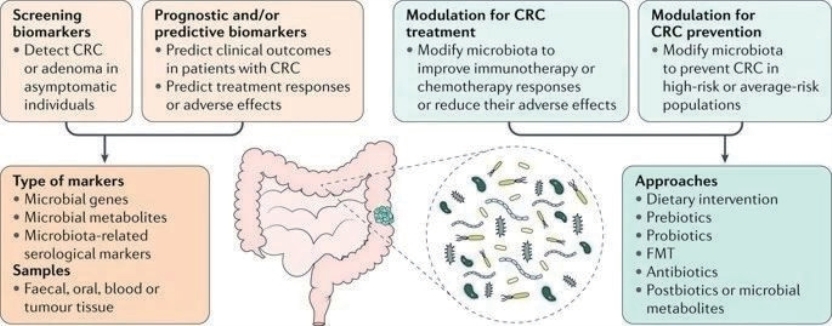
图3-1-11 其他微生物相关的治疗方法
结直肠癌中肠道微生物群的几个潜在临床应用,包括筛查、预后和预测生物标志物的发展,以及针对结直肠癌预防和治疗的微生物群调节。
5.4 未来的研究方向
过去十年的广泛研究已经确定了癌症微生物群的重要身份,特别是就位于肠道微生物群所在位置的结直肠癌。肠道微生物群与宿主上皮细胞相互作用密切,在结直肠癌发生中起重要作用。随着研究对致癌机制的阐明,为结直肠癌诊断和管理的新方法探索提供了前所未有的机遇,但也避免不了存在挑战。这些挑战包括在不同人群中验证生物标志物的科学性挑战、确定最佳生物标志物组合和阈值的方法学挑战,以及开发一种方便易接受的结直肠癌筛查试验的技术性挑战。要克服这些挑战,就需要评估不同种族患者的多种生物标志物,从而得出跨人群的最佳诊断算法。此外,还需要研究人员和行业合作伙伴共同努力,将其转化为临床产品。肠道微生物群调节的转化前景更具挑战性。尽管人们对操纵肠道微生物群有着浓厚的兴趣,但目前缺乏最佳方法的共识。虽然一些有益的微生物种类可以作为益生菌使用,但结直肠癌背景下的临床效益和相关微生物菌株仍有待确定。个体间益生菌的黏膜定殖存在巨大的差异,需要开发个性化而非通用方法来修饰微生物。有必要进行微生物活性和临床研究以确定微生物群的稳定性和效用,并制定一个监管框架以管理其作为癌症治疗或预防的一部分。虽然FMT对复发性艰难梭菌的治疗成功激发了人们对这一方法的极大兴趣,但它在其他疾病(包括免疫检查点抑制剂相关性肠炎)中的临床应用还需要更多对照试验的数据支持。还有必要为在其他疾病条件下安全使用FMT建立一个更好的监管框架。最后,虽然抗生素可以用来清除潜在的有害细菌以加强癌症治疗或预防癌症,但许多抗生素是非特异性的,可能会使肠道生态失调永久化。在这样挑战性前景下,有几个结直肠癌微生物的研究发展方向。首先,必须努力确定需要调整微生物群的患者群体及其临床效益。例如,微生物群调节在预防家族性结直肠癌综合征、散发高危个体、术后结直肠癌病例或一般平均风险人群中有用吗?微生物群干预增强癌症治疗效果或减少治疗副作用的确切临床终点是什么?如何比较它们与其他癌症辅助治疗的重要性和益处风险比?要回答这些重要问题,需要精心设计的前瞻性临床试验。第二,需要努力找到最好的干预方法来控制微生物群。益生菌、益生元、抗生素、FMT和其他生活方式的改变(如饮食改变、间歇性禁食或锻炼)在微生物群调节方面的比较?如何比较这些方法的实施性、耐久性、动力学和功效?在使用这些可能的干预措施之前,需要进行更多的研究以便了解这些科学和技术问题。最后,需要进一步了解致癌机制以及癌症治疗反应。司机细菌和乘客细菌是什么,它们在结直肠癌发生中扮演什么角色?不同微生物的免疫调节机制是什么?未来的研究应采用不同的动物模型和前瞻性纵向临床研究,以进一步了解微生物群在结直肠癌形成、进展及其治疗反应中的作用,并应对个体化用药的挑战。随着这一飞速发展领域的令人兴奋进展,微生物群将成为未来癌症预防和治疗的重要组成部分。
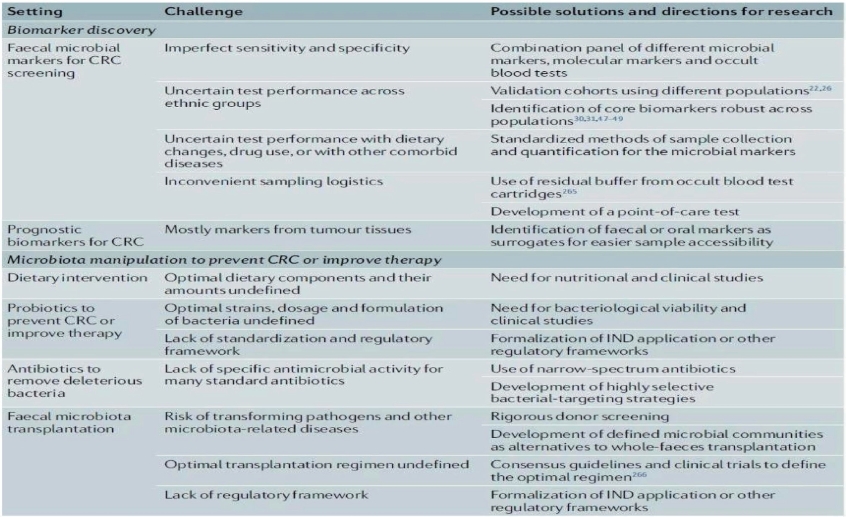
图3-1-12 肠道菌群在结直肠癌临床应用中的挑战及可能的解决方案
有关微生物与人类健康的文章

然而,也有相反的发现表明不同年龄组参与者的肠道微生物结构没有显著差异。总的来说,衰老与肠道失调增加有关,与肠道微生物多样性呈负相关。目前,许多技术可以用来分析肠道微生物群与人类免疫学、神经学和内分泌学的关系。......
2023-11-16

动物研究的早期证据支持微生物在结直肠癌发展中的作用。在此背景下,一些研究调查了结直肠腺瘤患者的肠道微生物群。2019年发表的一项研究收集了来自中国616名接受结肠镜检查患者的粪便样本,发现多发性结直肠腺瘤和黏膜内癌病例中微生物群转变明显。......
2023-11-16

结直肠癌是最常见的癌症之一,并在全球造成重大的疾病负担。2018年,在全球所有癌症中,结直肠癌发病率排名第三,死亡率排名第二。根据双胞胎和家庭研究的证据估计结直肠癌的遗传率仅为12%~35%。这种微生物群已经成为一些癌症的重要环境因素,包括结直肠、肝脏、胆道,甚至乳房癌症。近几年动物和人类研究的证据,总结了肠道微生物群和结直肠癌之间的关系密切,其相关临床应用的潜力无穷。......
2023-11-16

为了研究汉族肥胖者肠道菌群的改变是否与宿主体内循环代谢物有关,对肥胖组和对照组人群的血清进行了非靶向代谢组学分析。氨基酸的靶向代谢组学进一步证实了瘦人和肥胖者之间代谢物的差异。综上所述,肠道微生物群的改变,特别是肥胖者肠道内拟杆菌属的减少可能与循环中较高的AAA和BCAA浓度有关。以上数据表明,肠道菌群的代谢可能与血清中肥胖相关氨基酸的水平有关。图11-1-3肠道微生物与血清氨基酸的关系......
2023-11-16

上述结果表明,肠道共生真菌成分的改变与结直肠癌的发生有关。D.结直肠癌与对照组真菌科水平的丰富程度不同,使用多元统计模型检测丰度差异,并对年龄、BMI和性别等混杂因素进行校正。......
2023-11-16

根据几项研究,构成肺微生物群的两个主要门为拟杆菌门和硬壁菌门。非肿瘤疾病中的肺微生物群微生物与各种炎症性肺疾病之间的关系是一个公认的问题。这些微生物群物种的持续存在将疾病转变为慢性病和慢性炎症。流感嗜血杆菌、肠杆菌属、大肠杆菌、肺炎球菌、军团菌和莫拉菌属等微生物已得到证实能驱动肺组织炎症。研究表明,在一些病例中,这些微生物与肺癌相关。该领域的最新研究证实,微生物群应被视为重要的诊断和预防指标。......
2023-11-16

阿尔茨海默症以进行性神经退行性疾病和认知功能障碍为临床特征,是世界范围内老年人致残的主要原因之一。然而,关于AD患者,尤其涉及AD患者患病过程中的肠道微生物失调的研究还比较少。该研究纳入97名50~85岁的受试者,其中阿尔茨海默症患者33名、AD发病前遗忘性轻度认知障碍患者32名、健康对照32名。aMCI组、AD组患者受教育程度与HC组相当,但AD组受教育程度低于aMCI组。与HC组相比,AD患者的抽象功能评分降低,aMCI患者无明显变化。......
2023-11-16

益生菌LGG通过抑制小鼠肝脏胆汁酸合成和促进胆汁酸排泄来预防肝纤维化,胆汁淤积性肝病的特点是肠道菌群失调和肝脏毒性胆汁酸过量。LGG治疗明显减轻了BDL小鼠的肝脏炎症、损伤和纤维化,并显著降低了肝脏BAs。因此,可以得出补充LGG可通过增加肠道FXR/FGF15信号通路介导的对BA从头合成的抑制作用来降低肝脏BA,并增加BA的排泄,从而防止BA过量诱导的小鼠肝损伤和纤维化。研究者评估了肝脏和肠道组织的炎症反应和系统性炎症。......
2023-11-16
相关推荐