实验二基因工程表达产物分离纯化1.实验目的熟悉大肠杆菌包涵体表达产物的分离纯化原理及工艺流程。①先复性再纯化以包涵体形式表达的产物经复性后,采用各种色谱柱技术进行进一步的分离纯化。大肠杆菌系统表达产物分离纯化的主要任务是高效获取高比活性的表达产物,去除宿主蛋白质、核酸、内毒素等主要杂质类型。......
2023-12-07
【目的要求】
1.了解有机溶剂分步沉淀酶蛋白的原理和方法。
2.掌握测定碱性磷酸酶活力和比活力的方法。
【实验原理】
碱性磷酸酶(AKP)是一种底物特异性较低,在碱性环境中能水解多种磷酸单酯化合物的酶,需要镁和锰离子为激活剂。AKP具有磷酸基团转移活性,能将底物中的磷酸基团转移到另一个含有羟基的接受体上,如磷酸基团的接受体是水,则其作用就是水解。碱性磷酸酶最适pH范围为8.6~10.0,主要存在于小肠黏膜、肾、骨骼、肝和胎盘等组织的细胞膜上。
本实验采取有机溶剂分步沉淀法从兔肝或肾组织匀浆液中提取分离碱性磷酸酶。利用乙醇、丙酮、正丁醇等有机溶剂可以降低酶的溶解度,是通过降低介质的介电常数及其对酶蛋白的脱水作用达到目的。由于降低了溶液的介电常数,带有相反电荷的酶蛋白表面残基之间的吸引力增加,导致酶蛋白凝集而易从溶液中沉淀出来。此类有机溶剂也溶解于水,与水分子结合而导致蛋白质的脱水作用,进一步加强酶蛋白的沉淀析出。
在制备肝匀浆时,采用低浓度醋酸钠可以达到低渗破膜的作用,而醋酸镁有保护和稳定AKP的作用。匀浆液中加入正丁醇能使部分杂蛋白变性,可通过过滤而除去。含有AKP的滤液再进一步用冷丙酮和冷乙醇进行分离纯化。根据AKP溶解于终浓度33%的丙酮或终浓度30%的乙醇中,而不溶解于终浓度50%的丙酮或终浓度60%的乙醇中的性质,采用离心的方法重复分离提取,可使AKP得到部分纯化。
酶的比活力是指每单位质量(mg)酶制剂蛋白样品中含的酶活力单位。随着酶蛋白逐步被纯化,其比活力随之逐步升高,因此,比活力可以用来鉴定酶的纯化程度。
AKP活力测定采用磷酸苯二钠法。在一定的pH和温度条件下,待测液中的碱性磷酸酶作用于底物磷酸苯二钠,使之水解放出酚。酚在碱性溶液中,与4-氨基安替比林作用并经铁氰化钾氧化生成红色醌类化合物。根据红色深浅可以测定酶活力高低,从而计算出酶的活力单位。
碱性磷酸酶蛋白含量测定采用考马斯亮蓝染色法。考马斯亮蓝与蛋白着色,在一定浓度范围内蛋白质含量与颜色深浅成正比。根据测得的酶制剂蛋白毫克数及酶活力单位数计算比活力,可鉴定酶的纯化程度。
【试剂与器材】
1.试剂、材料
(1)0.5mol/L醋酸镁溶液 称取醋酸镁(相对分子质量214.45)107.25g溶于蒸馏水中,稀释至1000mL。
(2)0.1mol/L醋酸钠溶液 称取醋酸钠(相对分子质量82.03)8.2g溶于蒸馏水中,稀释至1000mL。
(3)0.01mol/L醋酸镁-醋酸钠混合液 取0.5mol/L醋酸镁20mL,0.1mol/L醋酸钠100mL,混匀后加蒸馏水稀释至1000mL。
(4)丙酮。
(5)95%乙醇。
(6)正丁醇。
(7)pH8.8Tris-醋酸镁缓冲液 称取三羟甲基氨基甲烷(Tris)12.1g,用蒸馏水溶解并稀释至1000mL,即成0.1mol/L Tris溶液。取100mL0.1mol/L Tris溶液,加800mL蒸馏水、100mL0.1mol/L醋酸镁,混匀后用1%醋酸调pH至8.8,再用蒸馏水稀释至1000mL即可。
(8)复合底物液 称取磷酸苯二钠6g、4-氨基安替比林3g,分别溶于煮沸并冷却后的蒸馏水中,两液混合并稀释至1000mL。加入4mL氯仿,贮存于棕色瓶内,置冰箱中保存。此液可用一周,使用时0.1mol/L pH10.0碳酸盐缓冲液等量混合即可。
(9)0.1mol/L pH10.0碳酸盐缓冲液 称取Na2CO36.36g及NaHCO33.36g溶于蒸馏水中,溶解后稀释至1000mL。
(10)0.5%铁氰化钾溶液 称取铁氰化钾5g、硼酸15g,分别溶于400mL蒸馏水中。溶解后将两液混合,加蒸馏水至1000mL。置于棕色瓶中,暗处保存。
(11)酚标准液 称取重结晶酚1.5g溶于0.1mol/L HCl中,并用此盐酸稀释至1000mL即成贮备液。取上述酚液25mL于250mL碘量瓶中,加50mL0.1mol/L NaOH并加热至65℃,再加入0.1mol/L碘液25mL,盖好瓶塞,放置30min后,加浓盐酸5mL,再以0.1%淀粉液作指示剂,用0.1mol/L标准Na2S2O3滴定,滴定反应如下:
3I2+C6H5OH—→C6H2I3(OH)+3HI
I2+2Na2S2O3—→2NaI +Na2S4O6
根据上述反应,3分子碘(相对分子质量254)与1分子酚(相对分子质量94)起作用,因此每毫升0.1mol/L碘溶液(含碘12.7mg)所相当的酚毫克数为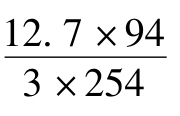 =1.567。假设0.1mol/L碘液25mL与25mL酚液作用后,剩余的碘用Na2S2O3滴定为XmL,则25mL酚溶液中所含酚量为(25-X)×1.567,由此推算酚贮备液浓度。最后将贮备液稀释成0.1mg/mL应用液。
=1.567。假设0.1mol/L碘液25mL与25mL酚液作用后,剩余的碘用Na2S2O3滴定为XmL,则25mL酚溶液中所含酚量为(25-X)×1.567,由此推算酚贮备液浓度。最后将贮备液稀释成0.1mg/mL应用液。
(12)标准蛋白溶液 称取牛血清白蛋白100mg溶于9g/L NaCl溶液,稀释至100mL。
(13)考马斯亮蓝试剂 称取考马斯亮蓝G-250100mg溶于50mL95%乙醇,加入100mL85%磷酸(质量浓度),用蒸馏水稀释至1000mL。
(14)新鲜兔肝或兔肾。
2.器材
可见分光光度计;低速离心机;吸量管(0.1mL,5mL,10mL);试管及试管架;恒温水浴锅;玻璃组织匀浆器;烧杯(100mL,500mL);刻度离心管。(www.chuimin.cn)
【操作方法】
1.碱性磷酸酶的分离纯化
(1)匀浆 称取新鲜兔肝2g或兔肾1g,剪碎,置于玻璃组织匀浆器中,加入0.01mol/L醋酸镁-醋酸钠混合液6mL,匀浆3~4min。匀浆液倒入刻度离心管,记录体积。取0.1mL于另一试管中,加4.9mL pH8.8Tris-醋酸镁缓冲液稀释,作为A液,待测比活力用。
(2)提取 加2mL正丁醇于匀浆液中,用玻棒充分搅拌2min,室温放置20min。纱布过滤,滤液置于刻度离心管中。
(3)丙酮沉淀 滤液中加入等体积的冷丙酮,混匀,3000r/min离心5min。将上清液倒弃,在沉淀中加入0.5mol/L醋酸镁4mL,用玻棒充分搅拌使其溶解,记录悬液体积。取0.1mL于另一试管中,加入pH8.8Tris醋酸镁缓冲液4.9mL,作为B液待测比活力用。
(4)分步分离 于悬液中加入冷95%乙醇,使乙醇最终浓度达30%,混匀,2000r/min离心5min。将上清液倒入另一离心管中,弃沉淀。上清液中加入冷95%乙醇,使乙醇最终浓度达60%,混匀,3000r/min离心5min。弃上清液,沉淀中加入0.5mol/L醋酸镁3mL,充分混匀,记录体积。取0.1mL于另一试管中,加pH8.8Tris-醋酸镁缓冲液2.9mL,作为C液待测比活力用。
(5)其余悬液中加入冷丙酮,使丙酮最终浓度达33%,混匀,2000r/min离心5min。弃沉淀,上清液中加入冷丙酮,使丙酮最终浓度达50%,混匀,3000r/min离心5min。弃上清液,沉淀中加入pH8.8Tris-醋酸镁缓冲液5mL,混匀,2000r/min离心5min。上清液为部分纯化的酶液,作为D液用于比活力测定。
2.碱性磷酸酶的活力测定
(1)取6支试管,编号,按表3-22操作。
(2)加入复合底物液后,立即混匀,在37℃水浴中准确保温15min。保温结束后,各管加入0.5%铁氰化钾液2.0mL,立即混匀以终止酶促反应。静置显色15min,以空白管调零,于510nm波长处比色。
表3-22 碱性磷酸酶的活力测定
(3)酶活力计算 规定在37℃下与底物作用15min产生1mg酚为1个酶活力单位。故每毫升酶液中的酶活力单位数为:
3.碱性磷酸酶蛋白质含量测定
(1)取6支试管,编号,按表3-23操作。
各管充分混匀,2min后以空白管调零,于595nm波长处比色。
(2)蛋白质含量计算。
表3-23 碱性磷酸酶蛋白质含量测定
4.比活力及得率的计算
(1)比活力计算:
(2)纯化倍数计算:
(3)得率计算:
【结果处理】
将实验结果填入表3-24。
表3-24 碱性磷酸酶分离纯化结果
【要点提示】
1.分清实验过程中每次离心后保留的是上清液,还是沉淀。
2.由前述碱性磷酸酶分离纯化过程可见,A液、B液均稀释50倍,C液稀释30倍,D液未稀释,如D液颜色过深则需适当稀释后再测定。
3.比色应在显色后1h内完成。
【思考题】
酶的纯度可用哪些方法表示?
有关生物化学实验指导的文章

实验二基因工程表达产物分离纯化1.实验目的熟悉大肠杆菌包涵体表达产物的分离纯化原理及工艺流程。①先复性再纯化以包涵体形式表达的产物经复性后,采用各种色谱柱技术进行进一步的分离纯化。大肠杆菌系统表达产物分离纯化的主要任务是高效获取高比活性的表达产物,去除宿主蛋白质、核酸、内毒素等主要杂质类型。......
2023-12-07

酶的分离、纯化属生物工程的下游过程。酶的产量是以活力单位表示的,在整个分离过程中每一步都需要进行比活力和总活力的检测、比较。只有这样才能确定酶的分离、纯化程度。要了解酶的实际纯度,尚需采用电泳等测定方法。一般试剂级及药用级用酶纯度要求高,则采取提纯倍数高的方法。而食品级酶在整个分离、纯化工程中要注意卫生,防止污染,各方面均需综合考虑。......
2023-11-22

可利用低温下不同的脂肪酸或脂肪酸盐在有机溶剂中的溶解度不同来进行分离纯化。(二)尿素包合法尿素包合法是针对脂肪酸进行分离纯化的主要方法。饱和脂肪酸相对于不饱和脂肪酸更易与尿素化合,形成稳定配合物。结晶法是一种温和的分离程序,对于易氧化的多烯酸、饱和脂肪酸与单烯酸的分离,常用溶剂有甲醇、乙醚、石油醚和丙酮等,每克常用5~10 mL溶剂稀释。......
2023-06-24

凝胶柱层析又称分子筛层析,是对混合物中各组分按分子大小进行分离的层析技术。当MetHb混合液流过凝胶柱时,溶液中高铁血红蛋白由于直径大于凝胶网孔而只能沿着凝胶颗粒间的孔隙以较快的速度流过凝胶柱,最先流出层析柱。这样经过凝胶层析后即可除去高铁氰化钾,从而得到高铁血红蛋白纯品。吸取上层澄清的血红蛋白液备用。在距离床面1mm处沿管内壁轻轻转动加入鸡血红蛋白样品0.5mL。......
2023-11-06

选择合适的pH及适当浓度的三氯乙酸或丙酮,可以从蛋清中除去大量的非卵类黏蛋白,获得鸡卵类黏蛋白的粗提液。初步纯化的鸡卵类黏蛋白,经DEAE-纤维素离子交换柱进一步纯化,可除去少量的杂蛋白,得到鸡卵类黏蛋白的纯溶液。鸡卵类黏蛋白在280nm处的消光系数=4.13,即蛋白质浓度为1mg/mL时溶液的吸光度A280=0.413,据此可以测定鸡卵类黏蛋白的含量。将收集的蛋白液体放置冰箱,准备进一步用DEAE-纤维素柱层析纯化。......
2023-11-06

糖化酶广泛分布于能直接以淀粉为营养源的所有生物体中。糖化酶的分离纯化实质是活性蛋白质的提纯过程。实验中选用工业糖化酶粗粉为原料。经离心分离获得的沉淀部分即为糖化酶的粗制品。经盐析法初步分离的糖化酶溶液含有大量的硫酸铵,会妨碍酶的进一步纯化,因此必须去除。脱盐后的糖化酶溶液经等电点沉淀、有机溶剂沉淀等处理可得到较纯的酶制剂。合并经检查不含的各管收集液,即为脱盐后的糖化酶液。......
2023-11-06

课题设计细胞内的核酸包括DNA与RNA两种分子,均与蛋白质结合成核蛋白。DNA与RNA性质上的差异决定了两者的最适分离与纯化的条件是不一样的。临床常见的标本有血液、尿液、唾液、组织及培养细胞等;核酸分离与纯化的方法非常多,如何恰当地收集与准备材料,选择适宜的分离与纯化方法是一个首要的问题。近年来,有关试剂盒的开发与自动化仪器的使用,能批量制备核酸样品,大大提高了分离与纯化的效率。......
2023-11-04

生物科学是20世纪自然科学中发展最迅速的学科,其中生物化学与分子生物学的发展尤为突出,出现了许多新思想、新成果和新技术,主要依赖于生物化学与分子生物学实验技术的不断发展和完善。生物化学的发展离不开生化实验技术的发展,实验技术每一次的新发明都极大地推动了生物化学研究的进展,因此学习和掌握各种生物化学实验原理和技术是极为重要的。......
2023-11-06
相关推荐