实验类型 验证性教学时数 3操作视频一、实验目的了解pH、温度、激活剂和抑制剂对酶活力的影响。对一种酶来说,只能在一定的pH范围表现其活力,否则酶即失活。酶通常在某一特定pH时,表现最大活力,此时的pH称为酶的最适pH。......
2023-11-04
【目的要求】
1.学习测定糖化酶活力的基本原理和操作方法。
2.掌握测定酶活力的一般操作程序及要领。
【实验原理】
糖化酶(淀粉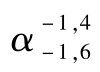 -葡萄糖苷酶EC3.2.1.3),广泛分布于能直接以淀粉为营养源的所有生物体中。糖化酶催化淀粉水解,从淀粉分子非还原性末端开始,分解α-1,4葡萄糖苷键生成葡萄糖。葡萄糖分子中含有醛基,能被次碘酸钠氧化,过量的次碘酸钠酸化后析出碘,再用硫代硫酸钠标准溶液滴定过剩的碘,计算出酶活力。
-葡萄糖苷酶EC3.2.1.3),广泛分布于能直接以淀粉为营养源的所有生物体中。糖化酶催化淀粉水解,从淀粉分子非还原性末端开始,分解α-1,4葡萄糖苷键生成葡萄糖。葡萄糖分子中含有醛基,能被次碘酸钠氧化,过量的次碘酸钠酸化后析出碘,再用硫代硫酸钠标准溶液滴定过剩的碘,计算出酶活力。
1.葡萄糖分子中的醛基被碘氧化
2.过剩的碘与氢氧化钠作用,生成次碘酸钠
I2+2NaOH—→NaOI +NaI +H2O
3.加酸后次碘酸钠和碘化钠作用析出游离碘
NaOI +NaI +H2SO4—→I2+Na2SO4+H2O
4.用硫代硫酸钠标准液滴定过剩的碘
I2+2Na2S2O3—→Na2S4O6+2NaI
通过滴定时所消耗的Na2S2O3的量,可以得出糖化酶催化淀粉水解后所产生的葡萄糖的量,根据公式可计算出糖化酶的活力。
【试剂与器材】
1.试剂
(1)0.1mol/L pH4.6乙酸缓冲液 称取乙酸钠(NaAc·3H2O)6.7g,溶于水中,加冰乙酸2.6mL,调至pH4.6,用水稀释至1000mL。
(2)0.05mol/L Na2S2O3标准溶液 称取13g硫代硫酸钠(Na2S2O3·5H2O)和0.2g Na2CO3,用新煮沸过的冷水溶解并稀释至1000mL,配制一周后用碘酸钾标定。
(3)0.1mol/L碘溶液 称取36g碘化钾溶于100mL水中,加入14g碘逐渐溶解,加3滴盐酸,用水稀释至1000mL,棕色瓶保存。
(4)1mol/L H2SO4溶液 量取浓硫酸5.6mL,缓慢注入80mL水中,冷却后稀释至100mL。
(5)0.1mol/L NaOH溶液。
(6)2%可溶性淀粉溶液 称取可溶性淀粉2g(预先100℃烘干约2h至恒重),用少量蒸馏水调匀,徐徐倾入已沸的蒸馏水中,煮沸至透明,冷却定容至100mL,此溶液需当天配制。
(7)20% NaOH溶液。
2.器材
恒温水浴锅;电子天平;试管及试管架;吸量管;旋涡混合器;比色管(50mL);碱式滴定管(25mL);碘量瓶。(www.chuimin.cn)
【操作方法】
1.待测酶液的制备
称取酶粉1~2g,准确至0.0002g(或吸取液体酶1.00mL),先用少量的乙酸缓冲液溶解,并用玻璃棒捣研,将上清液小心倾入适当的容量瓶中。沉渣部分再加入少量缓冲液,如此捣研3~4次,最后全部移入容量瓶中,用缓冲液定容至刻度,摇匀。四层纱布过滤,滤液供测定用。
2.酶活力测定
于甲、乙两支50mL比色管中,分别加入2%可溶性淀粉溶液25mL和pH4.6乙酸缓冲液5mL,混匀,置40℃恒温水浴中预热5min。在甲管(样品)中加入待测酶液2mL,立刻混匀,在此温度下准确反应30min,立即各加20% NaOH溶液0.2mL,混匀。将两管取出迅速冷却,并于乙管(空白)中补加待测酶液2mL,混匀。吸取上述反应液各5mL,分别置于碘量瓶中,准确加入0.1mol/L碘溶液10mL,再加0.1mol/L NaOH溶液15.0mL。摇匀,密塞,于暗处反应15min。取出,加1mol/L H2SO4溶液2mL,立即用0.05mol/L Na2S2O3标准溶液滴定,直至蓝色刚好消失为其终点。
3.结果计算
酶活单位定义:在上述条件(40℃,pH4.6)下,1h分解可溶性淀粉产生1mg葡萄糖的酶量为一个酶活力单位。
式中 A——空白消耗硫代硫酸钠标准溶液的体积,mL;
B——样品消耗硫代硫酸钠标准溶液的体积,mL;
c——硫代硫酸钠标准溶液的浓度,mol/L;
90.05——与1.00mL1mol/L硫代硫酸钠标准溶液相当的葡萄糖的质量,g;
32.2——反应液的总体积,mL;
5——吸取反应液的体积,mL;
1/2——吸取酶液2.00mL以1.00mL计;
n——酶液稀释倍数;
2——反应30min,换算成1h的酶活力系数。
所得的结果取整数表示。
【要点提示】
1.不同稀释倍数,应做相应的空白试验。
2.酶液浓度在样品与空白消耗Na2S2O3的差值为3~6mL为宜。
【思考题】
糖化酶活力测定中应注意哪些因素?
有关生物化学实验指导的文章

实验类型 验证性教学时数 3操作视频一、实验目的了解pH、温度、激活剂和抑制剂对酶活力的影响。对一种酶来说,只能在一定的pH范围表现其活力,否则酶即失活。酶通常在某一特定pH时,表现最大活力,此时的pH称为酶的最适pH。......
2023-11-04

学习福林-酚法测定蛋白酶活力的原理和操作方法。枯草芽孢杆菌蛋白酶粉。表3-21 酪氨酸标准曲线的绘制以不含酪氨酸的“0”号管为空白,分别测定各管吸光度。滤液根据酶活力再次用缓冲液稀释至适当浓度供测试用。......
2023-11-06

可用于蛋白质的定性或定量测定。因此,一切蛋白质或二肽以上的多肽都有双缩脲反应,但有双缩脲反应的物质不一定都是蛋白质或多肽。因此,虽然蛋白质和氨基酸均有茚三酮反应,但能与茚三酮呈阳性反应的不一定就是蛋白质或氨基酸。含有色氨酸的蛋白质也有此反应。......
2023-11-06

生物科学是20世纪自然科学中发展最迅速的学科,其中生物化学与分子生物学的发展尤为突出,出现了许多新思想、新成果和新技术,主要依赖于生物化学与分子生物学实验技术的不断发展和完善。生物化学的发展离不开生化实验技术的发展,实验技术每一次的新发明都极大地推动了生物化学研究的进展,因此学习和掌握各种生物化学实验原理和技术是极为重要的。......
2023-11-06

实验八糖化酶的制备及酶活力测定一、糖化酶的制备1.实验目的掌握糖化酶摇瓶实验的基本操作。显微镜观察菌丝形状,测量发酵液pH,测定糖化酶活力。葡萄糖分子中含有醛基,能被次碘酸钠氧化,过量的次碘酸钠酸化后析出碘,再用硫代硫酸钠标准溶液滴定,由此可计算酶活力。......
2023-12-07

(一)实验室安全在生物化学实验中,经常要与有腐蚀性,易燃、易爆和毒性很强的化学药品及有潜在危害性的生物材料直接接触,经常要用到煤气、水、电。酒精及其他可溶于水的液体着火时,应用石棉网或沙土扑灭。进行遗传重组的实验室应根据有关规定加强生物安全的防范措施。(二)实验室应急处理在生物化学实验中,如不慎发生受伤事故,应立即采取适当的急救措施。汽油、乙醚、甲苯等有机溶剂着火时,应用石棉网或沙土灭火。......
2023-11-06

实验类型 综合性教学时数 6一、实验目的学习测定蛋白酶活力的方法,掌握分光光度计的原理和使用方法。胰蛋白酶活力越高,生成的酪氨酸越多。蛋白酶活力单位定义:在30℃,pH7.5的条件下,反应8min,以每分钟水解酪蛋白产生1μg酪氨酸为1U。......
2023-11-04

溶菌酶广泛用于医学临床,有抗菌的作用,可抗感染、消炎、消肿、增强体内免疫反应等。另外,近年来溶菌酶已成为基因工程及细胞工程必不可少的工具酶。测定溶菌酶活力时,可用某些细菌细胞壁作底物,以单位时间内被它水解的细胞壁的量表示酶活力的大小。因此,可利用测定450nm波长下,菌悬液在该酶作用后透光度增加,以此表示溶菌酶的活力。计算所得溶菌酶的酶活力单位。......
2023-11-06
相关推荐