能量方程式是建立流体通过旋转叶轮时,获得能量的定量关系式。此方程式是欧拉在1756年首先推导出来的,所以又称欧拉方程。能量方程的表达式 已知原动机传给风机轴的功率P为P=Mω式中,M为通风机叶轮轴的力矩(N·m);ω为通风机叶轮的旋转角速度(1/s)。pT∞=ρ 式即为能量方程的表达式。能量方程式的修正 实际情况下,叶轮叶片数有限,流体具有粘性,因而实际应用时,应对式进行修正。......
2023-08-20
通风机输送的气体往往不是单一成分,而是由多种气体组成的混合物,如空气,还有烟气等。组成混合气体的各单一气体称为混合气体的组元,当各组元均为理想气体时,由它们所组成的混合气体也必定是理想气体,因此,前述理想气体热力性质的分析,均适用于理想气体的混合物。
(1)分压力定律和分容积定律 处于平衡状态下的理想气体混合物,内部各处温度均匀一致,因而每一组元的温度都相等,都等于混合气体的温度。同样,由于处于平衡状态,每一组元的分子都均匀地分布在混合物的容器中,即各组元所占的容积都相等,都等于混合物的容积。
1)分压力和道尔顿分压力定律。在容器中,每一组元的分子都会对容器壁撞击而产生一定的压力,各组元在理想气体混合物的温度下单独占据混合物所占据的容积V时,产生的压力称为该组元的分压力,用pi表示,见图1-7。
各组元气体分子的热运动不应该存在其他组元分子而受到影响,应与各组元单独占据混合物所占体积的热运动一样。理想气体混合物的压力是各组元分子撞击器壁而产生的。实验证明,理想气体混合物的压力p,等于各组元的分压力pi之和,称为道尔顿分压力定律。即
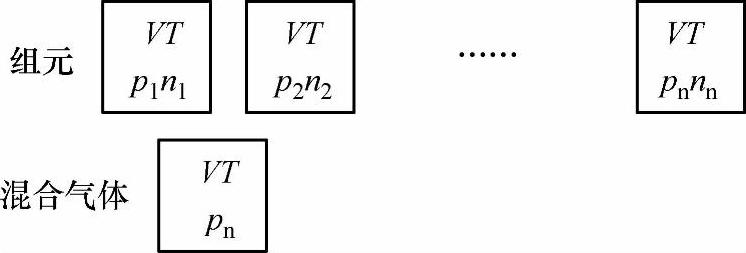
图1-7 分压力
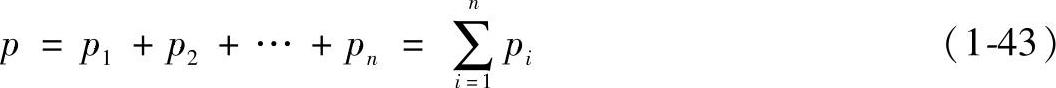
2)分体积和分体积定律。所谓分体积,是指各组元处于混合物的温度和压力下,单独存在时所占据的体积,用Vi表示,如图1-8所示。
实验证明,理想气体混合物的体积V,等于各组元的分体积Vi之和,称为亚美格分体积定律。即
实际上,理想气体混合物中各组元都充满了整个体积,所谓分体积,只是假想将各组元在混合气体的温度和压力下,分别集中于各自所占据的体积内,以便于用体积来表示各组元气体数量的多少。
(2)理想气体混合物的成分 理想气体混合物的性质取决于各组元的性质和数量。混合气体中某组元的量与混合气体总量之比,称为混合气体中该组元的含量。由于采用不同的物量单位,混合气体各组元的含量有不同的表示方法。
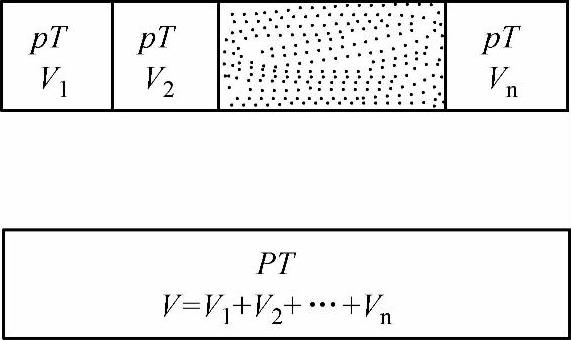
图1-8 分体积
1)质量分数wi。在理想气体混合物中,各组元的质量mi与混合物总质量m之比,称为该组元的质量分数,符号为wi,即

因为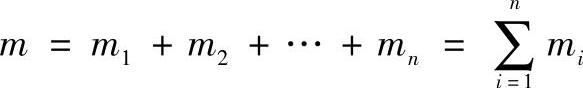
因此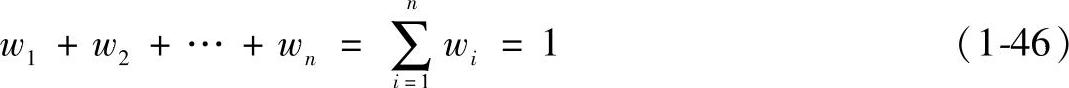
2)体积分数φi。理想气体混合物中,某组元的体积Vi与混合物总体积V之比,称为该组元的体积分数。记为φi。即

根据分体积定律,有
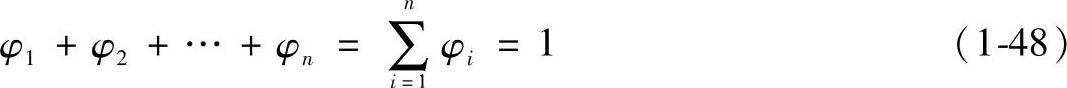
3)摩尔分数xi
理想气体混合物中,某组元的物质的量ni与混合物总物质量n之比,称为该组元的摩尔分数。符号为xi,即

因为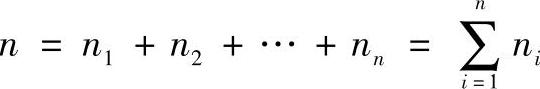 所以
所以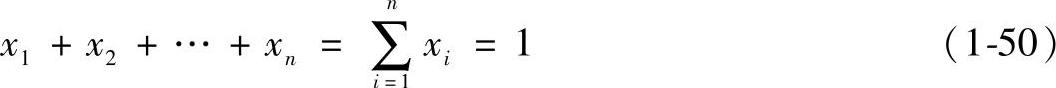
经证明,各含量之间的换算关系如下:
体积分数与摩尔分数在数值上相等。即
φi=xi (1-51)
质量分数与体积分数(或摩尔分数)的换算关系为

式中,Mi、M为某组元气体、混合气体的摩尔质量。
(3)折合摩尔质量与折合气体常数 气体常数取决于气体的摩尔质量。为了便于计算,取混合物的总质量m与混合物的总物质的量n之比为混合物的摩尔质量,称为折合摩尔质量或平均摩尔质量。即
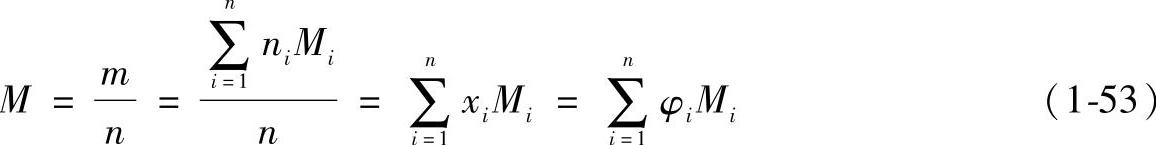
即混合气体的折合摩尔质量等于各组元的摩尔质量与它们的体积分数(或摩尔分数)乘积的总合。
求出理想气体混合物的折合千摩尔质量后,即可求出混合气体的折合气体常数R[J/(kg·K)]为
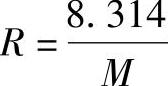
(4)混合气体的比热容 确定混合气体比热容的依据是能量守恒定律,即在加热过程中,一定数量的混合气体温度升高1℃所需要的热量,应等于各组元气体温度升高1℃所需热量的总合。故混合气体的比热容为

即混合气体的比热容,等于各组元气体的比热容与其质量分数的乘积之和。同样,混合气体的摩尔热容和摩尔定容热容分别为

有关建筑及空调风机的工程设计、使用与维修的文章

能量方程式是建立流体通过旋转叶轮时,获得能量的定量关系式。此方程式是欧拉在1756年首先推导出来的,所以又称欧拉方程。能量方程的表达式 已知原动机传给风机轴的功率P为P=Mω式中,M为通风机叶轮轴的力矩(N·m);ω为通风机叶轮的旋转角速度(1/s)。pT∞=ρ 式即为能量方程的表达式。能量方程式的修正 实际情况下,叶轮叶片数有限,流体具有粘性,因而实际应用时,应对式进行修正。......
2023-08-20

流体在空间的流动可以说都是三元流动,运动参数是空间三个坐标的函数。因此对于工程技术中的问题,在保证一定精度的条件下,尽可能将三元流动简化为二元流动,甚至一元流动来求近似解。流场的运动参数只是两个坐标的函数时称为二元流动。若实际流体的粘性很小,可以忽略,以管横截面上的平均流速来描述管内流动,即将二元流动化为一元流动求解。图2-3 圆管内流动a)二元流动 b)一元流动......
2023-08-20

某一点的声强,是指该点在单位时间内通过垂直于声传播方向的单位面积上声波的能量。正常人耳引起听觉的声强为10-12W/m2,引起人耳听觉疼痛的声强是10W/m2。从痛阈到听阈,声强比值达1013倍,数值过大,极不方便。况且声音的强弱只有相对意义,所以声强绝对值实际上是不怎么经常用的。为了方便起见,选用正常人耳的听阈声强值作为基准声强,并用对数表示,则LI为:式中,LI为声强级;I0为基准声强,I0=10-12W/m2,这样基准声强下的听阈声就是零分贝。......
2023-08-20

几何相似 这是指模型与实物的几何形状相同,对应的线性长度比为一定值,对应角度相等。几何相似是运动相似的先决条件。根据气体流动的气动热力过程及能量传递过程的相似要求,两个通风机的气流过程相似条件可归结如下:几何相似、叶片进口的速度三角形相似、雷诺数相等。下面将证明只要满足上述相似条件,两个通风机一定是相似的。......
2023-08-20

大气压力测定仪表 测量大气压力常采用空盒气压表、标准水银气压表。标准水银气压表是根据大气压力与真空管中水银柱压力相平衡的原理制成。它还可作为空盒气压表的标定仪表使用。玻璃管内可装水、酒精或水银等,应根据所测气体压力大小而决定采用何种液体。读数时应注意方法。图9-1 U形管液柱压力计图9-2 读数方法2)微压计。微压计适用于测量微小压力,测量准确。......
2023-08-20

通风机基本频率的确定 通风机的基本频率按式确定。在通风机进气口或排气口,其噪声级最大。从各声源到接收器的减噪量,即接收器的声压级L。将上面计算结果代入式计算,得各部声源的减噪量=dB=44dB于是各部声源必需的减噪量如下:进气口 减噪量=dB=16dB机壳 减噪量=dB=14dB管道 减噪量=dB=13dB根据必需的减噪量,考虑消声计划,进行噪声控制的设计......
2023-08-20

选用这里所给出的局部阻力系数时,遇到以下几种情况时必须进行修正:对于不等于90°的弯头 要乘以系数εθ。表6-20 进风口的局部阻力系数(三)当断面①处有网格时,按式修正。表6-24 进风口的局部阻力系数(七)注:对于矩形罩,θ系指大角。出风口的局部阻力系数见表6-25~表6-32,相应的图见图6-18。图6-19 弯头的局部阻力系数用简图图6-19 弯头的局部阻力系数用简图(续)①C-190°圆形弯头。......
2023-08-20
相关推荐