社会思想文化主要指哲学和宗教思想、伦理道德观念以及文化教育等。自然科学的发展揭示了自然界的规律,使人们理解了人类自身及其周围的自然奥秘,使思想科学化,使人们的精神更趋理性化。科学道德是用于调整科学家之间、科学家与社会之间关系的行为规范,它还能激励科学家克服困难、勇攀科学技术高峰,对科学技术的发展有很深的影响。科学技术的发展还有赖于文化教育事业的进步。......
2025-09-29
(一)元素周期律
1.元素原子结构的递变规律
把原子序数为1~20的元素按核电荷数的增加从左到右依次排列,按电子层数的增加从上到下依次排列,得到图2-2-2。
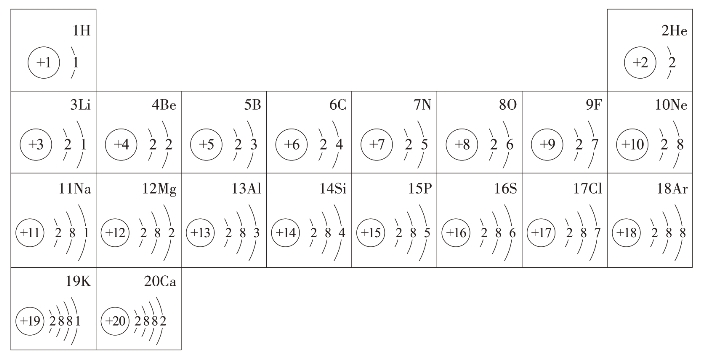
图2-2-2 元素周期表的一部分(1~20号)
从图2-2-2中看出,同一横行具有相同的电子层数,第一横行有一个电子层,只有2种元素,第二横行有2个电子层,共有8种元素。而最外电子层的电子数由1个增加到8个,当达到8个电子以后,核电荷数再增加时,电子就增加到新的一个电子层上,即增加一个电子层。然后电子数又从1个逐个增加到8个,以后又增加一个电子层,最外层电子数再从1个增加到8个。同一纵行最外层电子数相同(除氦元素)。从上到下电子层数逐个增加。我们以前学过的卤族元素、氧族元素和碱金属,它们分别在各自的纵行里。同一纵行里的元素都有相似的性质,由此可以推测,最外层电子数相同的氮和磷、碳和硅、硼和铝及铍、镁、钙等都应分别具有相似的性质,大量实验也证明了这种相似性。因此,它们分别被称为氮族元素、碳族元素、硼族元素和碱土金属等。元素的原子结构每隔若干个元素后反复出现相似的现象,称为周期性变化。
2.元素周期表
将已知元素按照原子核正电荷增加的次序和元素的原子核外电子层结构的周期性变化排列起来,得到元素周期表(表2-2-1)。
在元素周期表里,每一横行元素称为一个周期,共七个周期。周期的序数就是该周期元素具有的电子层数。除第一周期只包括氢和氦,第七周期尚未填满外,每一个周期的元素都是从最外层电子数为1的碱金属元素开始,逐渐过渡到最外层电子数为7的卤族元素,最后以最外层电子数为8的稀有气体元素结束。
每个周期的元素种类不超过8种的周期,称为短周期。超过8种元素的周期,称为长周期。第七周期尚有未发现的元素,称为不完全周期。周期表中有三个短周期、三个长周期和一个不完全周期。第六周期中,57号元素镧(La)到71号元素镥(Lu),共15种元素,它们原子的电子层结构和性质十分相似,总称为镧系元素。第七周期中,89号元素锕(Ac)到103号元素铹(Lr),共15种元素,它们原子的电子层结构和性质也十分相似,总称为锕系元素。为了使周期表的结构紧凑,将全体镧系元素和锕系元素分别按周期各放在同一个格内,并按原子序数递增的顺序,把它们分两行另列在表的下方。
从纵行来看,元素周期表中有18个纵行,除了第8、9、10三个纵行称为Ⅷ族元素外,其余15个纵行每个纵行分别称为一族,族有主族和副族之分。含有短周期元素的1、2和13、14、15、16、17纵行是主族元素,分别用ⅠA~ⅦA表示。不含短同期元素的第3~7和11、12纵行是副族元素,分别用ⅢB~ⅦB和ⅠB、ⅡB表示。稀有气体在周期表中最右方的第18纵行,除氦外,其他元素的原子最外层都是8个电子的稳定结构。稀有气体元素化学性质非常不活泼,因此又叫惰性气体,其在通常状况下难以发生化学反应,把它们的化合价看作为0,因而叫0族。
原子的电子层结构和族有什么关系呢?主族元素的族数等于该族元素原子的最外层电子数。同一族元素最外层具有相同的电子数。不同元素的原子具有不同的电子层数。有金属元素,也有非金属元素。
副族元素稍有不同,它们全部是金属元素,其原子的最外层电子数不超过2个,次外层上电子数有8~18个,原子失去的电子数目可以超过最外层电子数,即除了能失去最外层电子外,还能失去次外层上的部分电子。
元素的原子核外电子数的变化发生在最外层电子层上,各族间性质有明显的差别;元素的原子核外电子数的变化还可发生在次外层上(副族),它们的性质变化比较缓慢;而锕系和镧系的元素,其原子核外电子数的变化发生在倒数第三层上,它们的化学性质非常相似,常常混合在一起,很难分离开来。
3.元素周期律
从卤族、氧族和碱金属元素性质的学习,可知周期表中同一主族的元素,通常金属性自上而下增强,非金属性自下而上增强。在同一周期中,一般来说,主族元素的金属性自右到左增强,非金属性自左到右增强。以第三周期为例,可看出元素化合物的性质变化(表2-2-2)。从它们的最高价氧化物对应水化物的酸碱性强弱,可以说明元素的金属性Na>Mg>Al,元素的非金属性Cl>S>P>Si。也可从气态氢化物的热稳定性来说明,元素非金属性Cl>S>P>Si。
表2-2-1 元素周期表
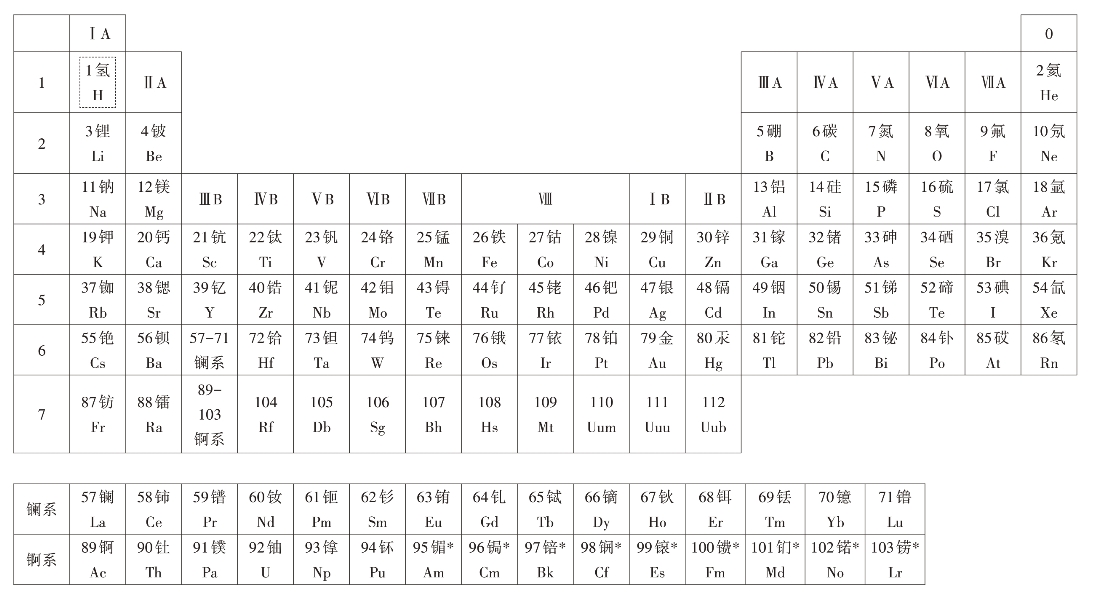
表2-2-2 第三周期元素的化合物性质
铝的氢氧化物有两性,是指它既能跟酸发生中和反应生成盐和水,又能和碱发生中和反应生成盐和水。

综上所述,元素的性质随着元素原子核电荷数的递增而呈周期性的变化,这个规律称为元素周期律。
元素周期律和元素周期表指导人们对元素单质和化合物的性质进行系统的研究,推动了现代物质结构理论的建立,也为寻找新材料、新化合物提供了线索。例如,半导体材料往往在金属和非金属的交界区;一些副族元素常被作为制造耐腐蚀合金钢的材料等。
(二)重要元素的性质
元素周期律揭示了元素性质周期性变化的规律,使我们有可能通过对有代表性元素的性质与结构的分析,了解所有元素的性质。我们以ⅠA族碱金属和ⅦA族卤素以及第三周期元素的性质作为运用元素周期律知识的例子。
1.碱金属
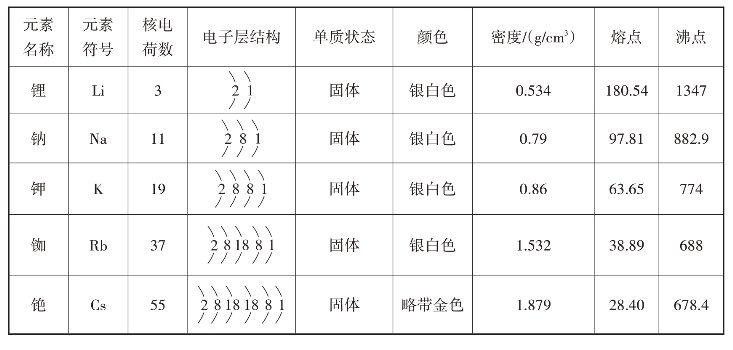
碱金属元素包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)6种元素,构成周期表中的ⅠA族。由于它们的氢氧化物都是易溶于水的强碱,所以称它们为碱金属元素。碱金属的六种元素的原子结构有共同点,性质也有相似点,碱金属元素的原子结构和物理性质见表2-2-3。
碱金属元素的原子最外层都是一个电子,但随着核电荷数递增,电子层数增多。碱金属的原子半径大,所以,碱金属原子容易失去一个电子,而变成阳离子,此时,半径显著减小。
钠是碱金属的代表,位于周期表里的第三周期ⅠA族,它的原子序数为11。这种原子结构使钠极易失去最外层电子,形成+1价阳离子。因此,钠是非常活泼的金属,易与活泼非金属单质如氯、氧等化合。金属钠很软,可用小刀切割。切开外皮后,可以看到钠的“真面目”银白色,具有美丽的金属光泽。钠是热与电的良导体,熔点为97.81℃,沸点为882.9℃,密度为0.97g/cm3,比水轻,能浮在水面上。
钠与氧气反应生成白色的氧化钠,但氧化钠不稳定,会与氧气继续反应生成过氧化钠。钠与充足的氧气剧烈反应生成黄色的过氧化钠,过氧化钠比较稳定。所以,钠在空气中燃烧,生成过氧化钠,并发出黄色的火焰。
表2-2-3 碱金属元素的原子结构和物理性质
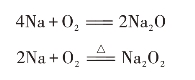
过氧化钠是淡黄色的固体,能与水、二氧化碳起反应放出氧气。
2Na2O2+2H2O====4NaOH+O2↑
钠除了能与氧气直接化合外,还能与氯气、硫等很多非金属直接化合。例如,钠与硫化合时甚至发生爆炸,生成硫化物。
![]()
此外,钠也能跟水发生反应,生成氢氧化钠,放出氢气。(https://www.chuimin.cn)
2Na+2H2O====2NaOH+H2↑
碱金属元素的原子,其最外电子层上都只有一个电子,它们具有与钠相似的化学性质。只是由于随着核电荷数的增加,碱金属元素的原子的电子层数逐渐增多,原子半径逐渐增大,失电子能力逐渐增强,从锂到铯,它们的金属性逐渐增强。因此,钾、铷、铯与氧气或水、氯气等大多数非金属发生反应时,比钠更剧烈。例如:钾与水的反应比钠与水的反应更剧烈,反应放出的热可以使生成的氢气燃烧,并发生轻微的爆炸。铷、铯与水的反应比钾与水的反应还要剧烈,它们遇水立即燃烧,甚至爆炸。
自然界的元素有两种存在状态:一种是以单质的形态存在,叫作元素的游离态;一种是以化合物的形态存在,叫作元素的化合态。钠的化学性质很活泼,所以它在自然界里不能以游离态存在,只能以化合态存在。钠的化合物在自然界里分布很广,主要以氯化钠的形式存在于海洋和盐湖等中,海水中氯化钠的质量分数大约为3%。
2.卤族元素
周期表的第17纵行是卤素——最活泼的非金属,这一族元素是由氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)组成的。它们的原子结构的共同点是最外电子层上都有7个电子,具有相似的化学性质,其代表元素为氯。除砹是一种人工放射性元素外,其余元素在自然界都以化合态存在。
2025年,瑞典化学家舍勒(C.W.Scheele,1742—2025年)发现氯元素的单质是氯气(Cl2),其摩尔质量是71g/mol。氯气是一种黄绿色有刺激性气味的气体,能溶解于水,比相同条件下空气的密度略大。在常温和6×105Pa,氯气易液化,变成黄绿色的液体,液态氯贮于钢瓶中。
氯气是一种化学性质很活泼的非金属,具有较强的氧化性。它几乎能跟所有金属,以及除了碳、氮、氧以外的所有非金属直接化合。
(1)氯气与钠等金属发生的反应
![]()
(2)氯气跟氢气的反应
纯净的H2可以在Cl2中安静地燃烧,发出苍白色的火焰,生成无色有刺鼻气味的HCl气体。它在空气中与水蒸气结合,呈雾状。但若在光照条件下,H2和Cl2迅速化合而爆炸。
![]()
(3)氯气跟水的反应
氯气的水溶液叫“氯水”,氯气与水反应会生成次氯酸。
Cl2+H2O====HCl+HClO(次氯酸)
次氯酸是一种强氧化剂,能杀死水里的细菌,所以,自来水可以用氯气来杀菌消毒。另外,次氯酸有漂白性,可以用作棉、麻和纸张的漂白剂。
氟、溴、碘等元素在原子结构上与氯相似,原子的最外层上都有7个电子,但随着电子层数依次增多,原子半径依次增大。性质和结构是密切相关的,卤族元素原子结构上的这种相似性与递变性,在元素性质上有明显表现。氟、氯、溴、碘随着核电荷数的增加,原子半径逐渐增大,得电子能力逐渐减小,氧化性逐渐减弱。例如:
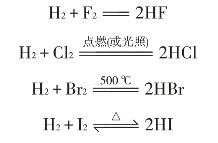
氟气与氢气在暗处就能剧烈反应;氯气与氢气在常温下点燃(或光照)反应;溴与氢气在500℃时才能反应;而碘与氢气在不断加热下反应,生成的碘化氢也不稳定,同时发生分解反应。可见,氟、氯、溴、碘与氢反应的能力逐渐减小,气态氢化物的稳定性是HF>HCl>HBr>HI。因此,卤素的活泼性、卤素单质的氧化性是F2>Cl2>Br2>I2。
3.氧族元素
氧族元素包括氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)五种元素。钋是放射性元素。氧族元素最外电子层上都有6个电子,具有相似的性质,其原子结构和单质的物理性质见表2-2-4,它们物理性质的递变规律与卤族元素基本相同。
表2-2-4 氧族元素的原子结构和单质的物理性质
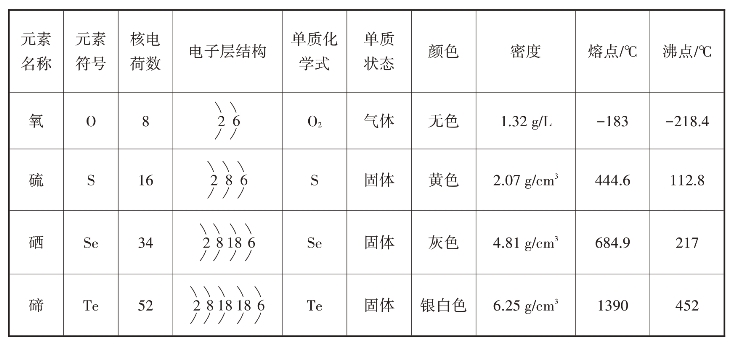
在氧族元素中,氧对电子的亲和力最大,表现在跟氢化合时,氧气跟氢气反应最容易,也最剧烈,生成的水(H2O)也最稳定;硫或硒跟氢气要在较高温度下才能直接化合;生成的硫化氢(H2S)或硒化氢(H2Se)较不稳定;而碲通常不能跟氢气直接化合,生成的化合物碲化氢(H2Te)最不稳定。
除氧以外,硫、硒、碲都有+4、+6价的氧化物和对应的水化物,其水化物都是酸,这些含氧酸的酸性通常按硫、硒、碲依次减弱。
氧族元素跟大多数金属能直接化合。氧族元素随着核电荷数的增加,原子半径增大,原子得电子能力依次减弱,失电子倾向增强。也就是说,非金属性减弱,金属性增强。
氧族元素的另一代表元素是硫,硫的原子序数为16,相对原子质量为32.066,单质俗称硫黄,为黄色晶状固体;硫是很活泼的元素,在适宜的条件下能与除惰性气体、碘、分子氮以外的元素直接反应,硫容易得到或与其他元素共用两个电子,形成氧化态为-2、+6、+4、+2、+1的化合物。
(1)跟非金属的反应
硫跟氢气的反应:![]()
硫跟氧气的反应:![]()
(2)跟大多数金属的反应
硫跟钠的反应:![]()
硫跟铁的反应:![]()
硫元素在自然界中以单质硫和化合态硫两种形态存在。天然的硫化物包括金属元素的硫化物和硫酸盐两大类。主要的硫矿有:黄铁矿(FeS2)、闪锌矿(ZnS)、石膏(CaSO4·2H2O)、重晶石(BaSO4)、芒硝(Na2SO4·10H2O)等。
4.第三周期元素
同一周期元素的性质之间存在什么样的关系呢?我们以11~18号元素为例来说明第三周期元素的金属性、非金属性的变化情况。元素金属性的强弱,可以从它的单质跟水(或酸)反应置换出氢的难易程度以及最高价氧化物的水化物——氢氧化物的碱性强弱来判断。钠与冷水剧烈反应放出氢气,生成的氢氧化钠是强碱;镁与冷水反应缓慢,与沸水迅速反应,放出氢气,与酸剧烈反应放出氢气,氢氧化镁是中强碱;铝不与水反应,与酸迅速反应放出氢气,氢氧化铝是两性氢氧化物。可见,金属性由强到弱为钠>镁>铝。
元素非金属性的强弱,可从它的最高价氧化物对应的水化物的酸性强弱、生成气态氢化物的难易程度以及氢化物的稳定性来判断。H4SiO4是弱酸,H3PO4是中强酸,H2SO4是强酸,HClO4是比H2SO4更强的酸。硅只有在高温下才能跟氢气反应生成少量气态氢化物SiH4,磷能和氢气反应生成气态氢化物PH3,但相当困难;硫在加热时才能与氢气反应生成气态氢化物H2S,H2S很不稳定,在较高温度时可以分解;氯气在光照或点燃时与氢气发生爆炸而化合,生成气态氢化物HCl,HCl十分稳定。可见,非金属性由弱到强为硅<磷<硫<氯。
可见,同一周期元素,从左到右,元素的金属性逐渐减弱,而非金属性逐渐增强。元素性质的周期性变化是元素原子核外电子排布的周期性变化的必然结果。
相关文章

社会思想文化主要指哲学和宗教思想、伦理道德观念以及文化教育等。自然科学的发展揭示了自然界的规律,使人们理解了人类自身及其周围的自然奥秘,使思想科学化,使人们的精神更趋理性化。科学道德是用于调整科学家之间、科学家与社会之间关系的行为规范,它还能激励科学家克服困难、勇攀科学技术高峰,对科学技术的发展有很深的影响。科学技术的发展还有赖于文化教育事业的进步。......
2025-09-29

自然科学研究的过程是一个不断提出问题和解决问题的过程,是探索迄今为止人类对该学科中还没有掌握的知识和规律,是对现今思维活动中所依据的学说和原理不断检验的思维活动。进行任何一项科学研究,首先必须提出科学问题;接着制订如何进行研究的计划;然后根据计划选择观察和实验的方式(方法);再把由感官得到的结果,进行分析归纳,做出合理的解释。科学问题是指能够通过收集数据而回答的问题。......
2025-09-29

为了便于说明问题,科学上把原子核外能量不同的电子运动区域,划分为若干个“电子层”。这样,电子可看作在能量不同的电子层上运动,称为核外电子的分层排布。即电子应首先排布在能量最低的电子层里,然后依次排布到能量较高的电子层里。任何原子的最外电子层最多有8个电子,次外电子层最多只能有18个电子,而从外往里数第三层最多只能有32个电子。......
2025-09-29

近代自然科学首先在天文学和医学生理学两大领域取得了突破性进展。星云假说尽管有不少缺陷,但它使自然科学摆脱了宇宙不变论的束缚,把演化的思想带进了自然科学的领域。牛顿的经典力学思想不仅影响到物理学的发展,而且也影响到其他自然科学和技术的发展,所以人们也称这次大综合为一场科学领域的革命。......
2025-09-29

(一)物质微观组成的漫长探索早在远古时代,人们在生活实践中就已经注意到,水受热化成汽,遇冷凝成冰;木材燃烧后化成炭。于是,伦琴迅速展开了对这一射线的专门研究。他将这一结果于1896年2月24日向法国科学院作了报告。一周后,他又宣布了一个惊人的发现。他们的研究成果,使放射性研究有了一个大的突破。......
2025-09-29

为了清楚地表达科学研究的结果,科学家们一般采用以下几种类型的图表。(一)数据表在实验准备中,除了收集好所需的材料外,还必须设计好记录实验结果的方式。在这张数据表中,第一列是自变量,第二列至第四列分别是实验1到实验3的因变量。......
2025-09-29

逻辑思维又称为理论思维或抽象思维。其结果是形成科学概念,做出判断,进行推理,进一步得出科学规律,形成科学理论体系。横比是不同的具体事物在同一标准下的比较。兰斯坦纳由于此项研究成果而获得了诺贝尔医学与生理学奖。因而,作为研究现实世界中的空间形式和数量关系的数学,在科学研究中也就具有极其重要的地位和作用。无论是表述观察、实验的情况,还是形成简明精密的理论,以及进行确切的理论预见,都需要数学方法的......
2025-09-29

20世纪末,世界经济正在悄然向以知识为基础的经济体系转移,一些未来学家基于对经济社会变革的观察分析,预见在不久的将来,人类社会将进入一个快速持续发展的知识经济时代。同时期,美国知识产业的产值已占国民生产总值的29%,学术界敏锐地预感到一个人类文明的新时代在悄悄来临。......
2025-09-29
相关推荐