另外,从维生素E的分子结构可以看到分子中有3个手性中心,最多有8个立体异构体。纯维生素E的原料可以通过测试旋光度来确定是天然的还是合成的。手性柱可能可以分离其中一部分立体异构体,但由于手性柱的柱效没有C18或苯基柱高,所以在具体样品中即使用手性柱也未必能把这些维生素E的立体异构体同其他的化合物或干扰物分开。Waters研究人员曾用二氧化碳高临界色谱仪把维生素E的部分立体异构体分开。......
2023-07-02
水溶性的维生素主要包括维生素B1(硫胺素)、维生素B2、维生素B3(烟酰胺)、维生素B5、维生素B6(吡哆醇)、维生素B12(氰钴胺)、叶酸和生物素。其中叶酸在保健品中主要有两种形式:叶酸和甲基四氢叶酸。甲基四氢叶酸是叶酸的代谢物,能被人体直接吸收。现在很多保健品用甲基四氢叶酸来代替叶酸。维生素B3也有两种,一种是弱酸性的烟酸,还有一种是弱碱性的烟酰胺。维生素B12有4种形式:维生素B12、甲基维生素B12、羟基维生素B12和酶维生素B12。一般的保健品中都以加维生素B12为主,但现在越来越多的保健品中用甲基维生素B12来替代维生素B12。水溶性维生素的分子结构式如下:
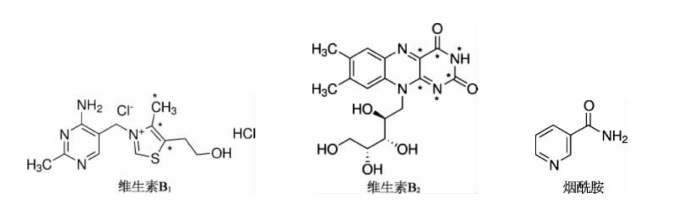
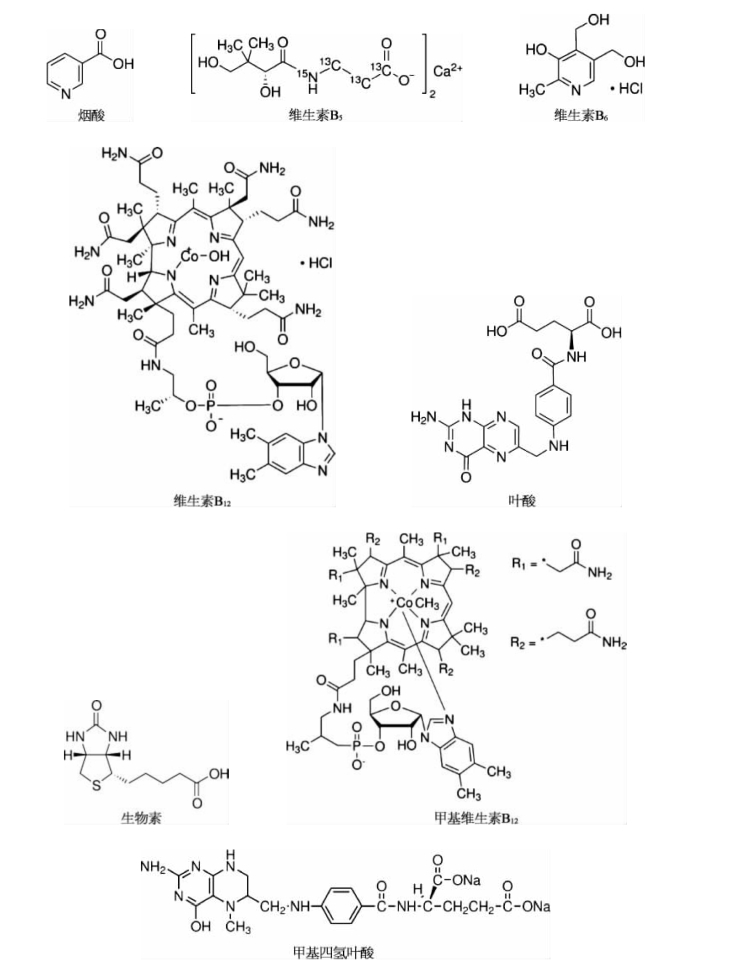
根据分子结构式可以看到大多数B族维生素都呈碱性,除了叶酸、维生素B5和烟酸是酸性外。假如用C18柱来走色谱,所得的色谱图如图2- 1所示:
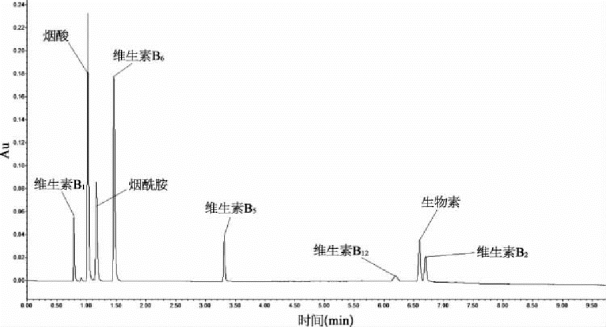
图2-1 水溶性维生素色谱图(C18柱)
图中可以看到除维生素B1几乎没有保留时间外,烟酸、烟酰胺和维生素B6的保留时间也很短,在实际样品中很容易受到干扰。假如在移动相中加入10 mmol己烷基磺酸钠做离子对,保留时间就可以延长,见图2- 2。
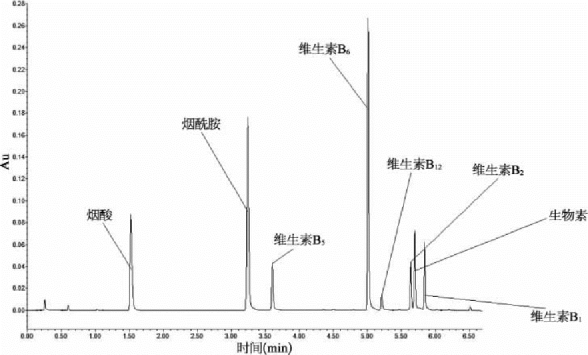
图2-2 水溶性维生素色谱图(C18柱,移动相10 mmol己烷基磺酸)
从图中可以看到加了离子对后碱性的化合物保留时间大大延长了,而且出峰的次序也发生改变。从色谱图来看,保留时间和分辨率都比较理想。这就是目前我们所用的方法,一般情况下不会有严重的干扰。调低p H,烟酸和维生素B5的保留时间会更长,被干扰的概率就更低。作为一种替代方法,在一些特殊情况下可以把C18柱换成苯基柱。如图2-3所示,烟酸和烟酰胺的保留时间都延长了,没有共轭双键的维生素B5与烟酰胺交换了出峰的顺序。当干扰物与被测分子的极性相似时,用C18反相柱分离可能会有问题,这时可考虑换用苯基柱,特别是当干扰物的UV光谱与被测分子的UV 光谱差异很大时。比较图2- 2和2-3可以看到,有些化合物(如维生素B6)的绝对保留时间反而短了,这是因为苯基柱的色散力没有C18的作用力强,所以绝对保留时间短了,但假如一个化合物的极性与维生素B6相似但没有共轭双键,它的保留时间会远远短于维生素B6。
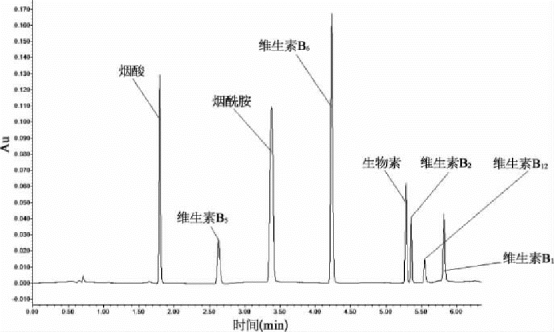
图2-3 水溶性维生素色谱图(苯基柱,移动相10 mmol己烷基磺酸)
(1)测试步骤
①溶液的配制
溶液A(样品和标准样品溶液)的配制:在950 mL去离子水中加入50 mL乙腈,再加入2 mL磷酸摇匀即可。保存期3个月。
流动相A:10 mmol己烷基磺酸盐加1 000 m L去离子水,水浴超声10 min,用磷酸和磷酸二氢钾调节p H 至3.0。通过0.2 mm 过滤纸过滤溶液。贮存在通风阴凉处,保存期1个月。
流动相B:乙腈。
②标准溶液的配制
叶酸只能溶解在碱性溶液中,维生素B2只有在热水中才能溶解,维生素B12和生物素一般在样品中的含量都是微克级的,所以以上这些标准品要先配原始液。
维生素B2原始液的配制:精确称取10 mg标准品,转入50 mL容量瓶中,加入35 mL去离子水,放入80℃的水浴中直至溶液澄清,冷却后加水至刻度。保存期1个月。
叶酸原始液的配制:精确称取10 mg叶酸标准品,转入100 m L容量瓶中,加入60 m L p H 为11的氢氧化钠溶液来溶解叶酸的标准品,溶解后再用同样的溶液稀释至刻度。
维生素B12和生物素原始液的配制:准确称取10 mg维生素B12和20 mg生物素,转入100 mL容量瓶中,加入60 mL溶液A,放入水浴超声器超声5 min。冷却后加入溶液A至刻度,摇匀即可。保存在通风避光处,保存期为2天。
标准溶液的配制:准确称取维生素B1、维生素B6、烟酸及烟酰胺各10 mg,30 mg维生素B5标准品,转入100 m L容量瓶,加入60 mL溶液A,放入水浴超声器超声3 min。加入20 mL维生素B2原始溶液、5 mL叶酸原始溶液及2 mL维生素B12和生物素的原始溶液,用溶液A 定容,摇匀即可。保存在通风避光处。测试当天配制。可根据样品的含量及浓度作适当的稀释。
标准品的建议浓度:维生素B1、维生素B2、维生素B6、维生素B5、烟酸和烟酰胺为10 ppm;叶酸、生物素和维生素B12为1 ppm。
③样品溶液的配制
固体或粉末样品的配制:至少取20 g样品研磨至均匀细小的颗粒,取一定量样品粉末使维生素的含量接近标准液,转入100 mL容量瓶中。先用15 mL温水(大概80℃左右)浸泡15 min,然后加入50 mL溶液A,盖好后摇20 min。假如需要,可水浴超声5~10 min,加入溶液A至刻度,摇匀,过滤后或离心后即可使用。
液体或软胶囊样品的配制:割开软胶囊称得每粒平均质量,吸取或者称取一定量的液体样品使维生素的含量接近标准液,转入100 mL容量瓶中,加入约10 mL甲醇,摇匀或者水浴超声5 min,然后缓缓加入溶液A,边加边摇。最后用溶液A来定容。过滤或离心后即可使用。
若要测试叶酸,可用p H 为11的溶液来单独配制样品溶液。
若测试项目中含有维生素B2,样品溶液要在80℃水溶中配制,冷却后再定溶。
(2)色谱条件
①HPLC条件
色谱柱:Phenomenex Prodigy,5μm,4.6×2 500 mm
注射量:20μL
UV检测波长:维生素B1:245 nm;维生素B2:268 nm;烟酸和烟酰胺:261 nm;维生素B5:211 nm;维生素B6:291 nm;维生素B12:360 nm;叶酸:280 nm;生物素:210 nm
流动相A:10 mmol己烷基磺酸钠,p H 3.0流动相B:1∶1水和乙腈
流速:1.1 m L/min
柱温:室温
梯度:
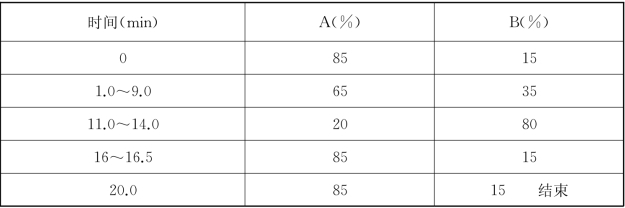
②UPLC条件
色谱柱:Waters Acquity UPLC HSS Ts C18,1.8μm,2.1×150 mm
注射量:1μL
UV检测波长:维生素B1:245 nm;维生素B2:268 nm;烟酸和烟酰胺:261 nm;维生素B5:211 nm;维生素B6:291 nm;维生素B12:360 nm;叶酸:280 nm;生物素:210 nm
流动相A:10 mmol己烷基磺酸钠,p H 3.0
流动相B:乙腈
流速:0.4 m L/min
柱温:45℃
梯度:
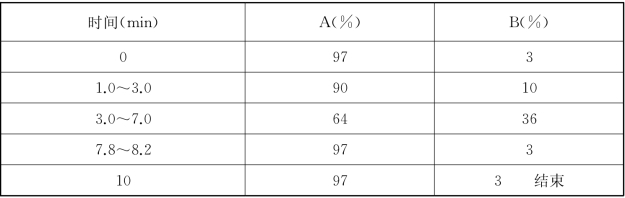
液相色谱条件的调整:
如前所述,由于配方不同、基质不同、辅料和剂型的不同,在测试过程中可能会遇到一些不可预测的干扰。为了排除这些干扰,调节一些液相色谱的条件是必要的。
(3)排除色谱干扰
①排除对酸性维生素的干扰:水溶性维生素中烟酸和泛酸是酸性化合物,降低移动相的p H 可以降低分子的极性,延长保留时间。而干扰物不一定是酸性化合物,这样有可能把干扰分子排除掉。特别是烟酸在p H 小于2时会形成阳离子,这样就可以与移动相中的阴离子(己烷基磺酸离子)作用形成离子对,可以进一步延长保留时间。
②排除对碱性维生素的干扰:水溶性维生素中的维生素B1、维生素B6、维生素B3、维生素B12都是碱性化合物,受到干扰时可作以下调整:
a.调节梯度的程序:梯度变化速率太快时,可能会把不同化合物挤在一起出峰,所以在出峰前降低梯度变化的速率,有时可以把干扰物分离出去。调整梯度时,要注意移动相的变化对峰的影响是滞后的。
b.换用苯基柱:因为以上碱性维生素都含有低能量的π电子。换用苯基柱后就会产生ππ作用力,而干扰分子可能不含有低能量的π电子,所以有可能被分离掉。即使干扰分子含有低能量的π电子,用苯基柱也比较容易分开。
c.调整检测器的波长:从色谱峰的光谱图中挑选最少或根本没有干扰的波长来作定量分析。比如测试维生素B2时,假如266 nm 处有干扰,就可以选373 nm或者446 nm 来作定量分析。定量分析时,标样和样品必须用同一个波长。
d.可以考虑用相对分子质量更大的磺酸盐作离子对试剂,比如在移动相中加入辛烷基磺酸盐或者癸烷基磺酸盐来代替己烷基磺酸盐,以此来延长被测分子的保留时间。
(4)结果计算
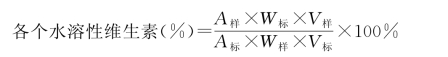
A标:相应标准品的峰面积
A样:相应样品的峰面积
V标:标准液的总体积(m L)
V样:样品液的总体积(m L)
W 样:样品的质量(mg)
W 标:相应标准品的质量(mg)

另外,从维生素E的分子结构可以看到分子中有3个手性中心,最多有8个立体异构体。纯维生素E的原料可以通过测试旋光度来确定是天然的还是合成的。手性柱可能可以分离其中一部分立体异构体,但由于手性柱的柱效没有C18或苯基柱高,所以在具体样品中即使用手性柱也未必能把这些维生素E的立体异构体同其他的化合物或干扰物分开。Waters研究人员曾用二氧化碳高临界色谱仪把维生素E的部分立体异构体分开。......
2023-07-02

而与维生素C不同的是,维生素C棕榈酸酯是脂溶性的,可以加入油脂类产品和食品中,以防止被氧化。②样品液的配制:称取一定量碾碎的含有约10 mg维生素C棕榈酸酯的样品,转入100 mL容量瓶中,加入10 m L水,超声5 min,再加入50 mL乙醇,超声10 min,冷却后再加入甲醇至刻度,摇匀,离心5 min,吸取清液即可注射。......
2023-07-02

在食品中水溶性维生素含量很低的情况下,也可以用LC-MS/MS来测试所有的水溶性维生素。MS/MS对所有水溶性维生素灵敏度都很高。图2-5水溶性维生素的LC-MS/MS的TIC色谱图结果计算结果计算按第1章“LC-MS/MS的定性和定量测试”的步骤来进行。......
2023-07-02

测试步骤维生素A的样品准备可按第1章“1.3样品及标准溶液的配制”操作。为了有效地从样品中萃取脂溶性维生素,建议整个萃取过程在70℃的水浴条件下进行。水的比例不要超过10%。......
2023-07-02

另外,由于过量饮酒造成维生素B1的亚临床缺乏者亦为数不少。生长期青少年、妊娠期妇女、哺乳期妇女、重体力劳动者、高温环境下生活及工作者,或是患慢性腹泻、消耗性疾病时,应注意增加维生素B1的摄入量。单纯的维生素B2缺乏很少见,通常是多种营养素联合缺乏。维生素B2缺乏也可影响其他营养素的摄取和利用。在发展中国家,植物性食物是膳食维生素B2的主要来源。......
2023-07-15

大黄素有消炎抗菌、利尿、提升免疫力等功能。近年来国内外学者对芦荟大黄素的抗肿瘤作用有一定的研究。大黄素的结构如下:测试步骤①标准液的配制:准确称取10 mg大黄素标准品,转入100 mL容量瓶中,加入60 m L甲醇,振荡至标准品全部溶解,再加入甲醇至刻度,摇匀后即可注射。......
2023-07-02

红景天为景天科全瓣红景天的全草,为多年生草本植物。测试步骤①标准液的配制:分别准确称取10 mg红景天苷、络塞维、络塞因和络塞标准品,转移至100 mL容量瓶中,加入约60 m L甲醇,水浴超声2 min,待所有的标准品溶解后,加入甲醇至刻度,摇匀待用。图4-6色谱图在实验时没有加红景天苷的标准品,所以图像中没有红景天苷的峰,实际上红景天苷的保留时间比其他3个化合物短很多。图4-6红景天的UPLC色谱图......
2023-07-02

测试步骤①标准液的配制:准确称取5 mg牡荆素、牡荆素鼠李糖苷和异牡荆素,转移至100 mL容量瓶中,加入60 mL甲醇,超声5 min,冷却后加入甲醇至刻度,摇匀即可注射。UPLC的条件色谱柱:Acquity UPLCBEH C18,1.7μm,2.1×100 mm流速:0.4 mL/min注射量:1μLUV检测波长:340 nm移动相A:0.1%磷酸水溶液移动相B:130 mL甲醇加70 m L乙醇柱温:45℃梯度:图4-15山楂标准品的色谱图结果计算牡荆素鼠李糖苷、异牡荆素的计算公式同上。......
2023-07-02
相关推荐