通常在保健品的配方中维生素B12、生物素和叶酸的含量都是微克级,在样品准备过程中为了有效萃取待测化合物,降低干扰成分,通常最后的浓度是ppb级的,一般用LC/UV 比较难检测,所以建议用LCMS/MS来测试。现代的MS/MS检测极限对以上3个化合物都能达到ppb级。生物素:维生素B12:图2-4为维生素B12和生物素的LC-MS/MS的色谱图。图2-4维生素B12(上)和生物素(下)的TIC色谱图结果计算按第1章“LC-MS/MS的定性及定量测试”步骤来进行。......
2023-07-02
1.定性测试
为了提高测试方法的选择性,避免误读,在HPLC或UPLC后面串联一个质谱仪,用色谱的保留时间与质谱的m/z 值来认证被测分子。但是在复杂的基质中,在色谱系统中可能同时出现被测物的分子离子及其他m/z 值相同的离子的情况,所以LC/MS在定性测试及以此为基础的定量测试中有一定局限性。因此在保健品测试中建议用LCMS/MS,并用MRM 模式来做定性和定量的测试。已知被测物的相对分子质量,输入仪器的软件中,Q1就聚焦在这个设定的相对分子质量上,任何分子的相对分子质量符合设定就会被Q1选择送到碰撞室(collision cell),被轰击后产生相应的碎片,这些碎片进入Q3并被准确地测量出质量及数量。相同相对分子质量的不同分子经过撞击后不会产生完全一样的碎片模式,为了提高选择性,一般选出数量最多的前3个离子对来作定性和定量分析,即母离子>碎片1,母离子>碎片2和母离子>碎片3。
将3个被选出的离子对与标准品相比较时,如果3个离子对产生的碎片的质量和标准品完全一样,并且数量上的比例也一致,那么可确定该母离子就是要测的化合物。再加上HPLC的保留时间进一步提高了确定性。3个离子对的总和或数量最大的第一组离子对可用来进行定量计算。另外,在选择离子对时可以多选一两对,以备被选上的离子对受到干扰时可以替代。
2.定量测试
以上选出的3个离子对的数量总和或数量最多的1个离子对,可用来进行定量计算。MS/MS检测器的灵敏度很高,比较先进的质谱仪对维生素B12和生物素及其他一些化合物的最低检测极限都可以达到ppb水平。
质谱仪的离子化过程很容易被基质干扰(抑制或增强,但绝大多数情况下都是离子化被抑制了)。由于保健品的成分复杂,干扰物浓度又可能大大超过被测物的浓度,在离子化过程中能量可能被干扰物吸收而引起待测分子不能被全部离子化甚至完全没有被离子化。而与此相比,空白的标准液不受基质影响,离子化程度可能会高于样品溶液。所以在实际测试中一定要确定样品溶液的离子化程度与标准溶液的离子化程度有定量的可比性,比如两者的离子化程度有一个固定的常数(如85%)等。
定量分析一般有以下两种方法。
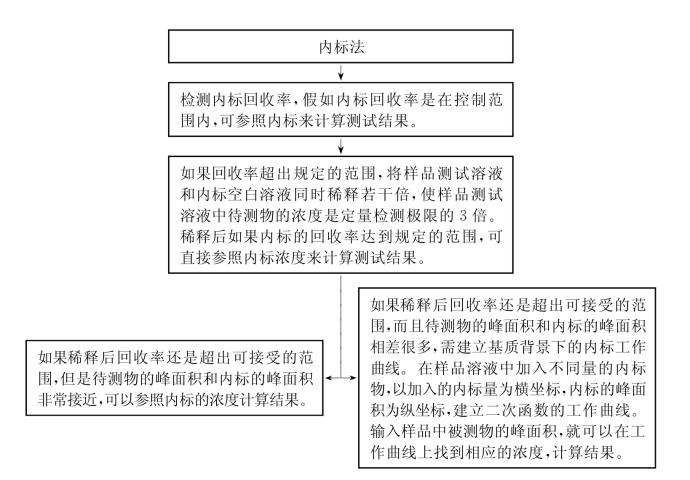
(1)内标法
内标法对内标化合物的要求是在相同色谱的环境下,离子化的程度要与被测化合物相似或有一个固定的比例,内标物的物理化学性质要与被测化合物相似,以达到碎片模型一致性,而且还要求样品中基本不存在该内标化合物。要满足以上条件,只有被测分子的同位素分子才是最理想的选择。
但假如同位素内标在样品基质中回收率很低,那就不能用一般的内标计算法来计算测试结果。比如内标的回收率只有20%,这时内标物和被测分子的浓度与MS/MS检测器的信号强度可能不成正比,所以不能简单地用内标法的计算方法来计算最后的结果。例如,在某基质干扰的条件下,内标的回收率很低,在这种情况下假如内标的峰面积是2 000,而被测物的峰面积只有1 000,就不能想当然地以为被测物的浓度是内标浓度的一半,因为在此环境下离子化的程度与浓度可能不成正比。所以要准确地定量计算测试结果就要走如下程序。
计算内标回收率:
先配制3个不同浓度的空白内标溶液(用水或甲醇等作溶剂),也就是标准液,建立内标的工作曲线,同时可检查仪器的线性。再准备1份样品溶液,加入已知量的内标物,这就是可以直接注射的样品溶液(本方法内标的添加在样品溶液注射前完成)。最后测得样品液中内标的峰面积,计算样品溶液的内标回收率:

这里,样品液中的内标响应因子=样品中内标的峰面积/样品中内标的浓度。
空白液中的内标响应因子=标准液(空白液)中的内标面积/标准液中的内标浓度。
假如内标回收率是好的(如≥80%),那么可以以内标为参照来计算结果。

如果回收率超出规定的范围,比如80%~120%(内标回收率可接受的范围是由测试的方法、样品的基质、所用的仪器等因素来决定的,可以用一些数据加以验证),那么最有效率的做法是将样品的测试溶液和内标空白溶液(如需要)稀释若干倍,使样品测试溶液中待测物的浓度是定量检测极限的3倍,然后分别注射入LCMS/MS。如果内标的回收率达到规定的范围,这时可用稀释后的样品液来计算结果;如果回收率还是超出可接受的范围,那么有以下两个选择:
选择一,假如稀释后的样品溶液中待测物的峰面积和内标的峰面积非常接近,那么可以直接以内标为参照来计算结果。

A待测:待测物的峰面积
A内标:内标的峰面积
C内标:样品液中内标浓度
选择二,建立基质背景下的内标工作曲线,步骤如下:
准备5份不含内标的样品溶液,注射前加入不同量的内标(以样品测试溶液中的内标含量为1作参照,分别加入0.05、0.1、0.5、1.5和2倍的量,连同原始的样品溶液一共6个点)。如图1-27所示,以加入的内标量为横坐标,内标的峰面积为纵坐标,建立二次函数的工作曲线。输入样品液中被测物的峰面积(不是内标峰面积),就可以在工作曲线找到相应的浓度,计算结果。
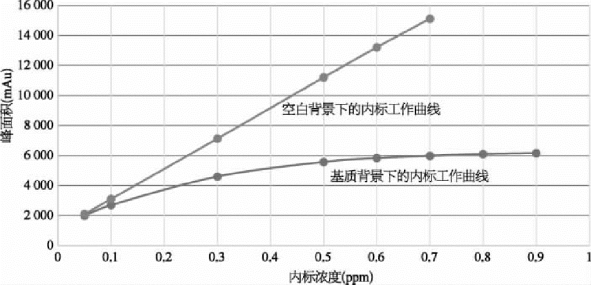
图1-27 内标法的校正
以上的计算都假设被测分子和内标分子的离子化程度是一样的。
另外,氘(2H)同位素内标中,可能含有一定比例的氢(1H)同位素,所以在计算过程中内标的浓度应是除去氢同位素后的实际浓度。最后在计算所得的结果中还应减去待测物中所含的内标中氢(1H)同位素的量。
在极端情况下,假如内标回收率太低或者根本没有内标峰,应该首先调节色谱及质谱的条件,如改换不同功能的色谱柱子、移动相等使干扰物得以从被测物中分离出去,以及调节其他质谱条件,直到以上的程序可以被实行。
如需要在移动相中加入离子对试剂,则必须选择挥发性酸或碱,如三氟乙酸、三乙胺等。移动相中加入离子对试剂后,质谱仪的灵敏度会大幅度地下降,使痕量测试成为不可能。
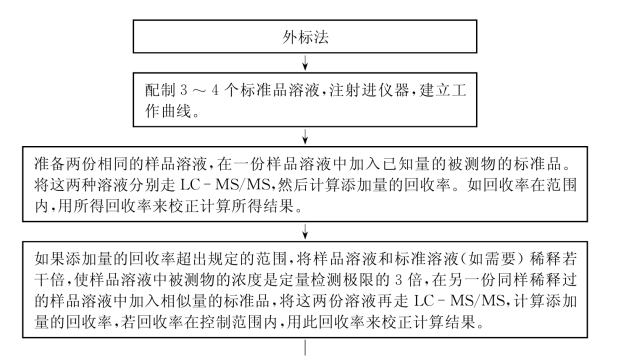
(2)外标法
被测物的同位素内标价格比较昂贵,而且有些被测物没有现成的同位素内标物可用,所以在实际测试中外标法也被广泛使用。
用被测物的标准品来配制不同浓度的外标溶液时,首先将不同浓度的标准液注入LCMS/MS系统中,然后输入不同点的数据(浓度、峰面积),以浓度为横坐标,信号强度(峰面积)为纵坐标,作工作曲线。然后注入样品溶液,得到相应的峰面积,将峰面积输入到工作曲线上就可以得到相对应的浓度。但外标法也同样存在基质干扰的问题。
标准液中没有基质干扰因素,所以被测物的离子化程度可能会高出含有基质的样品溶液,这样计算出的结果是不准确的,要排除基质干扰或校正被干扰的结果,建议走以下程序。
回收率的检测:
准备两份相同的样品溶液,在一份样品溶液中加入已知量的被测物的标准品。将这两种溶液分别走LC-MS/MS,然后计算添加量的回收率,方法如下:

A添:样品添加液的峰面积
A样:样品液的峰面积
添加量的理论面积=添加量(换算成浓度)在标准工作曲线上得到的相对应的峰面积
如果添加量的回收率在规定范围内,那么就用回收率来校正所得到的计算结果。

如果添加量的回收率超出规定范围(比如80%~120%),可将样品溶液和标准溶液(如需要)稀释若干倍,使样品溶液中被测物的浓度是定量检测极限的3倍,在另一份同样稀释后的样品溶液中加入相似量的标准品,将这两份溶液再走LC-MS/MS,计算回收率,如回收率在可接受的范围内,则用此溶液来计算结果,并用所得回收率来校正计算结果。回收率的可接受的范围要根据样品基质、不同的仪器及方法等因素来决定,要有一数据加以验证。
假如样品溶液不能稀释或稀释后回收率仍不理想,那么就要做标准品添加的线性测试。例如,在样品溶液中分别添加5μL、10μL、15μL的10 ppm[2]的标准液,然后测试添加后的线性。如果线性好,还是可以用回收率来校正计算所得的结果,虽然回收率已经超出了控制范围。
但是假如回收率太低或回收率等于零,在这种极端情况下就必须改变测试方法重新测试。
LC-MS/MS定量测试步骤可归纳如下:
在极端情况下,假如内标回收率太低或者根本没有内标峰,应该首先调节色谱及质谱的条件,如改换不同功能的色谱柱子、移动相等使干扰物得以从待测物中分离出去,也可以改用APCI取代ESI,以及调节其他质谱条件,直到以上的程序可以被实行。
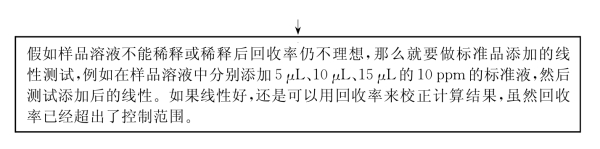
在极端情况下,假如回收率太低或添加液的线性不好,就必须改变测试方法重新测试。
【注释】
[1]ppb:part per billion,表示溶质质量占全部溶液质量的10亿分比。1 ppb=1/1 000 ppm。
[2]ppm:part per million,表示溶质质量占全部溶液质量的百万分比。1 ppm=1 000 ppb

通常在保健品的配方中维生素B12、生物素和叶酸的含量都是微克级,在样品准备过程中为了有效萃取待测化合物,降低干扰成分,通常最后的浓度是ppb级的,一般用LC/UV 比较难检测,所以建议用LCMS/MS来测试。现代的MS/MS检测极限对以上3个化合物都能达到ppb级。生物素:维生素B12:图2-4为维生素B12和生物素的LC-MS/MS的色谱图。图2-4维生素B12(上)和生物素(下)的TIC色谱图结果计算按第1章“LC-MS/MS的定性及定量测试”步骤来进行。......
2023-07-02

创业机会评估方法主要分为定性评估法、定量评估法以及定性与定量评估相结合的评估方法。(一)定性评估法定性评估法主要有史蒂文森法和隆杰内克法。(三)定性与定量相结合的评估方法这类评估的方法主要有蒂蒙斯的创业机会评价框架,[14]创业者在采用该方法时需要对经济因素、竞争优势、致命缺陷问题等8 个方面进行评估,一共有55 个指标,几乎涵盖其他评价方法的全部评价因素。......
2023-08-31

美国FDA把黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1和黄曲霉毒素G2的总量的检测极限设在20 ppb,这是很有挑战性的。这么低的测试极限用LC-MS/MS方法可以实现。所以这4个分子用C18反相柱是可以分开的,尽管MS/MS对分离的要求不是很高。标准溶液的浓度见表3:表3黄曲霉毒素标准溶液浓度②样品溶液的配制:称取2 g样品,转移入50 m L容量瓶中,加入20 m L甲醇,振荡2 min,超声20 min。结果计算参照第1章“LC-MS/MS的定性和定量测试”。......
2023-07-02

LC-MS/MS检测器可满足这方面的测试要求。测试步骤①标准液的配制:分别称取20 mg维生素D2、维生素D3和维生素K1标准品,转移至100 mL容量瓶中,加入约60 mL乙醇,待所有的标准品溶解后,加入乙醇至刻度,摇匀待用。再进一步稀释5倍、25倍和125倍,得到大约200 ppb、40 ppb和8 ppb的维生素D2、维生素D3、维生素K1,以及100 ppb、20 ppb和4 ppb的维生素K2标准溶液。......
2023-07-02

在食品中水溶性维生素含量很低的情况下,也可以用LC-MS/MS来测试所有的水溶性维生素。MS/MS对所有水溶性维生素灵敏度都很高。图2-5水溶性维生素的LC-MS/MS的TIC色谱图结果计算结果计算按第1章“LC-MS/MS的定性和定量测试”的步骤来进行。......
2023-07-02

物质所吸收光的波长和发射的荧光波长与物质分子结构有密切关系。利用这些性质对物质进行定性和定量分析的方法,称为荧光光谱分析法,也称为荧光分光光度法。在分光光度法中,被测物质只有一种特征的吸收光谱,而荧光分析法能测出两种特征光谱,因此,鉴定物质的可靠性较强。荧光分析法的定量测定方法较多,可分为直接测定法和间接测定法两类。......
2023-11-04

图5-2 用图解法确定放大电路的静态工作点4.定量分析法在定性分析的基础上,对电路和元器件的参数进行量化分析,如电路的电压、电流、电阻,元器件的参数、选取型号等。定量分析是一种具体量化的分析方法。......
2023-06-28

受金、基欧汉和维巴的影响,定性和定量研究的论战中涌现了许多论点。本章在研究中同时运用了两种研究方法,因此定性与定量分析论战中的任何一方都无法指责我们偏向于其中一种方法。这类问题包括现代社会的大型革命[117]、公元前3500—2000年人类战争历史的起源[118],以及二战后不同国家如何在和平或战争中进行选择。[119]然而一些问题适合同时采取两种方法进行研究,例如二战后族群战争。相关性通常不是因果关系,更不是深层原因。......
2023-08-16
相关推荐