循环冷却水中的结垢、腐蚀和微生物问题三大危害会导致循环冷却水系统效率和寿命的降低,对工业生产过程产生巨大的危害。因此,为了保证工业循环水安全行运,必须对其进行严格控制,其中微生物的有效控制是循环冷却水处理技术中重要一环,必须控制其生长繁殖。其中控制循环冷却水系统中的微生物的生长当前标准的做法是使用化学杀生物剂。......
2023-06-30
1.金属的不均匀性
由于工业上使用的金属中含有各种杂质,当金属与水溶液接触时,这些杂质则以微电极的形式与金属基体构成了许多短路微电池,若杂质作为微阴极,将加速金属基体的腐蚀,反之,若杂质作为微阳极,则金属基体就会受到保护而减缓腐蚀。另外,在工业上所使用的金属中,例如,钢和铸铁,由于其成分不均匀,存在着第二相碳化物和石墨,在与水溶液相接触时,这些第二相的电位成为无数个微阴极,从而加速了金属基体的腐蚀。此外,还由于金属和合金的晶粒与晶界的电位不完全相同,以晶粒为阴极,以晶界为阳极构成微电池,发生沿晶腐蚀。更重要的是,金属在加工或使用过程中通常产生部分变形或受力不均匀,以及热应力或相变组织的应力等,都会形成微电池。因此,要想使整个金属的物理化学性质、金属各部位所接触的介质的物理化学性质完全相同,从而使金属表面各点的电极电位完全相同是不可能的。
2.金属腐蚀原电池
循环冷却水中金属的腐蚀实际上是一个腐蚀原电路,不论是何种类型的腐蚀,必须包括:阳极、阴极、电解质溶液和电路四个部分,缺一不可。这四个部分构成了腐蚀原电池工作的基本过程。图5-2给出了碳钢在含氧中性水中腐蚀原电池示意图。
图5-2 碳钢在含氧中性水中的腐蚀原电池
碳钢的电化学腐蚀包括以下过程:
(1)在阳极区 金属溶解,碳钢氧化生成亚铁离子进入水溶液中,并在碳钢金属基体上留下两个电子。
(2)电子转移 电子通过碳钢金属基体电路从阳极转移到阴极。
(3)阴极过程 水中的溶解氧在阴极区接受从阳极区流过来的两个电子,还原为OH-。
这两个电极反应可以表示为:
在阳极区:
在阴极区:
两个反应在金属表面同时发生,且速度相同,保持着电荷守恒。这种凡能分成两个或更多氧化还原分反应的腐蚀过程,都可以称为电化学反应。
当亚铁离子和氢氧根离子在水中相遇时,就会生成Fe(OH)2沉淀:
这种反应产物又被称作是次生过程产物。若溶液呈碱性时,Fe(OH)2就会以沉淀的形式析出。若阴极、阳极直接接触,次生物就沉淀在金属表面上形成氢氧化物膜,若这层膜比较致密,则可转化为氧化保护膜覆盖在阳极金属表面上,或者在氢去极化反应中生成的H2均匀而牢固地覆盖在金属表面上,会阻止金属进一步溶解,使金属的腐蚀得以减缓,直至停止,此种作用称为极化。
若水中存在去极化剂,则腐蚀过程可继续进行,例如,水中的溶解氧比较充足,Fe(OH)2会进一步氧化,生成黄色的锈FeOOH或Fe2O3·H2O,而不是Fe(OH)2。如果水中的氧不充足,则Fe(OH)2进一步氧化为绿色的水合四氧化三铁或黑色的无水四氧化三铁。
由以上金属腐蚀机理可知,造成金属腐蚀的是金属的阳极溶解反应。因此,金属的腐蚀破坏仅出现在腐蚀电池中的阳极区,而腐蚀电池的阴极区是不腐蚀的。
综上所述,腐蚀原电池的原理与一般原电池一样,但在金属腐蚀原电池中,电流不对外做功,而是消耗于腐蚀电池内部阴极的还原反应中,其工作的直接结果是加速了金属的腐蚀。
3.极化与去极化
电池形成闭合回路时,电动势减小的现象称为极化,极化能使腐蚀现象减少。一般阳极只有表面状态发生改变,例如,腐蚀产物在金属表面堆积形成保护膜才能造成阳极极化。而在阴极上,假如接受电子的物质不能迅速地扩散,或阴极反应产物不能很快地排走,则由于金属传送电子的速度很快,由阳极传送来的电子就会堆积起来,产生阴极极化。
去极化是指使极化现象减少的现象。去极化会促进腐蚀,去极化的物质称为去极化剂。水中含有的O2、Fe3+、Cu2+、H+、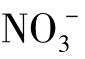 都是去极化剂,会促进腐蚀。还有Cl-可破坏某些合金金属表面保护膜,属阳极去极化剂。
都是去极化剂,会促进腐蚀。还有Cl-可破坏某些合金金属表面保护膜,属阳极去极化剂。
4.共轭反应和共轭体系
孤立的金属腐蚀时,在金属表面上同时以相等速度进行着一个阳极反应和一个阴极反应的现象,称为电极反应的耦合,互相耦合的反应称为共轭反应,而相应的腐蚀体系则称为共轭体系。在共轭体系中,总的阳极反应速度与总的阴极反应速度相等。此时,阳极反应释放出的电子恰好为阴极反应所消耗,金属表面没有电荷的积累,故电极电位也不随时间而变化。
从以上的讨论中可以看到,在腐蚀控制中,只要控制腐蚀过程中的阳极反应和阴极反应两者中的任意一个电极反应的速度,则另一个电极反应的速度也会随之而受到控制,从而使整个腐蚀过程的速度受到控制。
有关工业循环冷却水处理的文章

循环冷却水中的结垢、腐蚀和微生物问题三大危害会导致循环冷却水系统效率和寿命的降低,对工业生产过程产生巨大的危害。因此,为了保证工业循环水安全行运,必须对其进行严格控制,其中微生物的有效控制是循环冷却水处理技术中重要一环,必须控制其生长繁殖。其中控制循环冷却水系统中的微生物的生长当前标准的做法是使用化学杀生物剂。......
2023-06-30

另外,循环水系统环境条件如温度和pH又较适合多数微生物生长,导致冷却水系统中微生物迅速繁殖,水质恶化,加快了金属腐蚀,进而引发微生物结垢和腐蚀等一系列危害。以下介绍几种工业循环冷却水中常出现的微生物。所以异氧菌属于黏液型细菌,所产生的黏液对循环冷却水系统危害很大。在循环冷却水系统中,金属表面和沉积物之间往往缺氧,以硫酸盐还原菌为主的厌氧菌得以繁殖,当温度为25~30℃时,繁殖更快。......
2023-06-30

异养菌分为本身能从水质中摄取无机物或有机物而生活的腐生菌和依赖寄主供给营养的寄生菌两类。通常所说的异养菌指的是存在于水中的腐生菌。在循环冷却水中,异养菌不仅生长繁殖快,而且为数多,基本上代表了水中全部好氧菌的数量,所以一般在测定时,以这类细菌的数量作为细菌总数。循环冷却水中异养菌数的监测频率应为1次/周。对菌落计数用平皿计数法对异养菌的菌落进行计数,然后再计算每毫升水样中的异养菌数。......
2023-06-30

循环冷却水系统中许多细菌在新陈代谢过程中分泌黏液而促进污垢沉积,有些可以促进腐蚀,因此要解决腐蚀和结垢问题,必须同时解决微生物问题。目前随着水处理技术的发展,大多数循环冷却水系统中的化学腐蚀和结垢都能得到较好的解决,但循环冷却水系统中的微生物滋生和黏泥问题仍没有得到较好的解决。微生物在工业循环冷却水系统中的危害,主要体现在两个方面:一是微生物黏泥危害;二是微生物的腐蚀危害。......
2023-06-30

循环冷却水系统在运行过程中,会有各种物质沉积在换热器的换热管表面,主要是由水垢、淤泥、腐蚀产物和生物沉积物构成,通称为污垢。含有少量二氧化硅和氧化铁的碳酸盐水垢呈灰白色或粉红色。因此,在投加有含聚药剂的循环冷却水系统中,必须注意磷酸钙水垢的生成问题。为避免生成硅酸盐垢,通常限制冷却水中SiO2的含量不超过150~175mg/L为宜。......
2023-06-30

地表水、地下水、海水等都可以作为冷却水水源,但作为循环冷却水,不同的工业、不同的生产设备、产品、不同的换热器等,对循环冷却水的水质要求也有所不同,不论哪种水源,都应进行净化处理,达到水质的基本要求。各类水体的水质标准见《地表水环境质量标准》。为避免与城镇供水、渔业用水等争水,循环冷却水的水源应取自Ⅳ类水体。......
2023-06-30

由金属腐蚀的理论可知,随着溶液pH的增加,水中氢离子浓度降低,碱度增大,金属腐蚀过程中氢离子去极化的阴极反应受到抑制,碳钢表面生成氧化性保护膜的倾向增大,故冷却水对碳钢的腐蚀速度随水的pH升高而降低。②与pH坐标垂直的线,代表与电极电位无关而仅与pH有关。③斜线,代表与电极电位和pH都有关的平衡状态。电极电位高于0.8V发生特别强的氧化作用,在此情况下,水可氧化成氧。......
2023-06-30

随着系统的运行,循环冷却水中盐量逐渐提高,引起浓缩作用。循环水在冷却构筑物中是降温过程,水温降低时,水中平衡CO2需氧量也降低,此时水中的CO2具有腐蚀性。循环冷却水处理要解决的主要问题是对腐蚀、沉积物、微生物的控制,由于三者之间存在着相互影响,因此实际中需采用综合方法进行处理。......
2023-08-30
相关推荐