天然水中存在的杂质主要由所接触的大气、土壤等自然环境所引入,同时人类活动产生的各种污染物也会进入天然水体。按不同的原则,可以对天然水体中的杂质进行分类。表1-1水中杂质的尺寸与外观特征悬浮物主要是泥砂类无机物质和动植物生存过程中产生的物质或死亡后的腐败产物等有机物。天然水中所含有的无机杂质主要是溶解性的离子、气体及悬浮性的泥沙。天然水中的有机物与水体环境密切相关。......
2025-09-29
循环冷却水系统在运行过程中,会有各种物质沉积在换热器的换热管表面,主要是由水垢、淤泥、腐蚀产物和生物沉积物构成,通称为污垢。
按照形成的物理化学机制不同,污垢又可划分为析晶污垢、颗粒污垢、化学反应污垢、腐蚀污垢、凝固污垢和生物污垢六类。实际过程中常是几种类型的污垢混杂在一起,在换热器表面多以析晶污垢和颗粒污垢的形式出现。
析晶污垢主要是由CaCO3、Ca2(PO4)3、CaSO4、硅酸钙(镁)等微溶盐组成。这些盐的溶解度很小,如在0℃时,CaCO3的溶解度约为20mg/L,Ca3(PO4)2的溶解度只有0.1mg/L,且它们的溶解度随pH和水温的升高而降低,特别容易在温度高的凝汽器部位达到过饱和状态而结晶析出,当水流速度较小或传热面较粗糙时,这些结晶就会沉积在传热表面上形成水垢。
1.碳酸盐水垢
碳酸盐水垢是受热面与传热表面上最常见的水垢。外观为白色或灰白色,质硬而脆,附着牢固,难以剥离刮除。一般天然水中都含有重碳酸盐,它在水中与CO2存在下述平衡:
在一定温度下,冷却水中重碳酸盐含量不超过溶解极限时,不会发生结垢。但在循环冷却过程中,水与工艺介质进行换热后,水温上升,水分不断蒸发,水质会发生变化。CO2在热循环水中随着上升的空气从冷却塔中逸出,CO2减少,水的pH升高;由于循环水的不断浓缩,水中的Ca2+和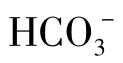 浓度也相应增加,另外,水温上升,CaCO3的溶解度下降。这些都使反应向右进行,使得循环水的结垢趋势增大,当碳酸钙的浓度达到过饱和时,就会结晶析出形成水垢。
浓度也相应增加,另外,水温上升,CaCO3的溶解度下降。这些都使反应向右进行,使得循环水的结垢趋势增大,当碳酸钙的浓度达到过饱和时,就会结晶析出形成水垢。
碳酸盐水垢中含80%以上碳酸钙,如果水中硅酸盐及硫酸盐含量低且设备不存在腐蚀时,碳酸钙的含量可以达到95%左右。碳酸盐水垢中常含有少量镁盐,它以氢氧化镁形式存在。含有少量二氧化硅和氧化铁的碳酸盐水垢呈灰白色或粉红色。氧化铁的含量反映系统腐蚀的程度;二氧化硅的含量反映泥沙悬浮物沉积和水质预处理的情况。
碳酸盐水垢的特征鉴别方法是:碳酸盐水垢是各种水垢中最易溶于稀酸的,常见的无机酸和有机酸均可将其溶解。在用酸溶解碳酸盐水垢时,将产生大量二氧化碳气泡,这是主要特征。在常温下,5%以下稀盐酸中,碳酸盐水垢可全部溶解。
碳酸盐水垢的另一特点是在850~900℃下灼烧时,水垢质量损失近40%,这是由于二氧化碳与化合水分分解的缘故。由于二氧化碳的消失,水垢变得松散,并可溶于水中,使水溶液呈碱性。550℃灼烧失重也反映微生物黏泥在水垢中的大致比例。550~950℃灼烧失重表示碳酸盐垢的含量。
观察水垢溶解后的少量残渣及注意水垢灼烧时的气味可了解垢中所含杂质,溶解之后的少量残渣如果为白色是硅酸盐,如果呈黑褐色是腐蚀产物。灼烧时如果嗅到焦糊气味是有机碳(碳水化合物),如果嗅到腥臭味是微生物污泥。
2.磷酸盐水垢
有些冷却水处理配方中,常投加聚磷酸盐或其他含磷药剂。由于受温度、停留时间、微生物、氧化性物质等影响,这些含磷药剂部分水解成正磷酸盐,水中有 存在,
存在,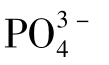 分解率随冷却水的停留时间而异,为10%~40%。当水的pH较高,水中Ca2+浓度较大时,
分解率随冷却水的停留时间而异,为10%~40%。当水的pH较高,水中Ca2+浓度较大时, 与Ca2+可生成溶解度很小的Ca3(PO4)2,附着在传热表面上形成磷酸钙水垢。因此,在投加有含聚药剂的循环冷却水系统中,必须注意磷酸钙水垢的生成问题。
与Ca2+可生成溶解度很小的Ca3(PO4)2,附着在传热表面上形成磷酸钙水垢。因此,在投加有含聚药剂的循环冷却水系统中,必须注意磷酸钙水垢的生成问题。
磷酸盐水垢外观为灰白色,质地较为疏松,水垢附着能力差,容易用刷、刮、磨等方法除去。不受热部分的磷酸盐垢松软,呈堆积状,随着受热面的热流强度和金属温度升高,结垢加重,垢质也变得坚硬难除。
磷酸盐垢与碳酸盐垢外观近似,且常含一定量的碳酸盐垢。两者区别在于磷酸盐垢在常温条件下,不能在5%以下稀酸中全部溶解,需要加热助溶,或者在10%以上稀酸中稍微加热使之全溶。
在用酸溶解磷酸盐垢时,由产生气泡情况可以了解其中碳酸盐垢所占比例。如果基本不冒气泡,则是单纯的磷酸盐垢。(https://www.chuimin.cn)
3.硅酸盐水垢
硅酸盐水垢产生于原水中二氧化硅含量高的锅炉或循环冷却水中,有的水处理配方使用水玻璃作为分散剂和缓蚀剂,SiO2含量很高,如果水的硬度较大时,SiO2很容易与水中的Ca2+或Mg2+生成传热系数很小的硅酸钙或硅酸镁水垢。这类水垢外观呈白色,有杂质时为灰白或粉红色,不能用一般的化学酸洗法除去,要用酸碱交替清洗。如果硅酸钙(或镁)垢中含有Al3+或Fe2+等金属离子时,清洗更困难。为避免生成硅酸盐垢,通常限制冷却水中SiO2的含量不超过150~175mg/L为宜。当镁的含量大于40mg/L,与浓度极高的钙共存时,即使SiO2含量低于150mg/L,仍会生成硅酸镁[Mg3Si4O10(OH)2]水垢。因此,硅酸镁浓度积应限制在以下范围:
硅酸的溶解度随温度和pH升高而增大。当pH>9时,因为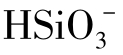 增加,溶解度增大。当所含硅酸在溶解度之上时,硅酸缩聚,以聚合体存在。若聚合体的分子质量增大,析出成为坚硬的硅垢。
增加,溶解度增大。当所含硅酸在溶解度之上时,硅酸缩聚,以聚合体存在。若聚合体的分子质量增大,析出成为坚硬的硅垢。
4.硫酸盐水垢
在天然水的强酸阴离子中,硫酸根的含量最高,通常为100mg/L以上,有的达300mg/L以,在高浓缩倍率下会结成硫酸钙水垢。硫酸钙在 98℃以下是稳定的二水化合物(CaSO4·2H2O),溶解度比碳酸钙大40倍以上。在37℃以下,溶解度随温度升高而增大,在37℃以上则相反,溶解度随温度升高而减小。在98~107℃是稳定的半水化合物,在170℃以上是稳定的无水化合物。无水硫酸钙和半水硫酸钙的溶解度随水温升高迅速减小。一般冷却水系统中不会析出硫酸钙垢,但如水温较高, 和Ca2+离子含量(均以CaCO3计,mg/L)的乘积大于1.5×105时,仍会产生硫酸钙水垢。硫酸钙垢非常硬,难以用化学清洗法除去,也不易采用常规的机械方法清除。
和Ca2+离子含量(均以CaCO3计,mg/L)的乘积大于1.5×105时,仍会产生硫酸钙水垢。硫酸钙垢非常硬,难以用化学清洗法除去,也不易采用常规的机械方法清除。
5.镁垢
镁在水中的含量比钙少。在镁的化合物中,Mg(OH)2的溶解度最小。碳酸镁只能在CO2含量高的水中存在,如果将碳酸镁放进暴露在空气中的水中,它也分解放出CO2,产生Mg(OH)2,所以,冷却水中只能析出Mg(OH)2。
结晶态Mg(OH)2的溶解度最小。刚从水中析出的粉末状的Mg(OH)2的溶解度稍大。表4-1列出了晶体Mg(OH)2的溶解度以及由此换算出的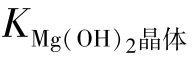 、
、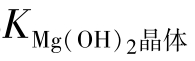 和刚从水中析出的粉末Mg(OH)2的溶解度。
和刚从水中析出的粉末Mg(OH)2的溶解度。
表4-1 Mg(OH)2的溶解度
由表4-1可见,Mg(OH)2的溶解度不大。当水中镁含量较高,pH也较高时,有可能析出镁垢。仅析出Mg(OH)2垢时,大多为粉末状。在冷却水系统,镁和钙的化合物以及硅酸盐等以混合垢的形式析出。
我国大部分地区的地下水和地表水多以硫酸盐——碳酸盐型水质为主。形成水中硬度的主要离子是Ca2+、Mg2+离子,多为中硬水和硬水,当水被加热时,Ca2+、Mg2+同 起作用,生成CaCO3和Mg(OH)2等难溶化合物,沉积在加热壁上生成水垢:
起作用,生成CaCO3和Mg(OH)2等难溶化合物,沉积在加热壁上生成水垢:
其中,CaCO3水垢是沉积在受热面上的主要污垢,坚硬、致密、附着力强、热阻大,每年因此而报废的换热器达万台左右,造成不可估量的经济损失。
大多数情况下,换热器表面所形成的是碳酸钙水垢,这是由于地表天然水质大部分为碳酸盐型水质,水垢中含80%以上碳酸钙,而硫酸钙等其他水垢的含量较少,且硫酸钙的溶解度又比碳酸钙大许多,例如,在0℃时,硫酸钙的溶解度是1800mg/L,比碳酸钙约大90倍,所以碳酸钙比硫酸钙更容易析出,同时天然水中溶解的磷酸盐较少。因此,除非向水中投加过量的磷酸盐,否则磷酸钙水垢也出现的较少。所以各种阻垢处理方法的重点是解决碳酸钙结垢问题。
相关文章

天然水中存在的杂质主要由所接触的大气、土壤等自然环境所引入,同时人类活动产生的各种污染物也会进入天然水体。按不同的原则,可以对天然水体中的杂质进行分类。表1-1水中杂质的尺寸与外观特征悬浮物主要是泥砂类无机物质和动植物生存过程中产生的物质或死亡后的腐败产物等有机物。天然水中所含有的无机杂质主要是溶解性的离子、气体及悬浮性的泥沙。天然水中的有机物与水体环境密切相关。......
2025-09-29

2)粘结焊剂:又称陶质焊剂或低温烧结焊剂。与粘结焊剂相比,烧结焊剂颗粒的强度提高,吸潮性大大降低。通常焊剂由MnO、SiO2、CaF2三种组分的不同含量组合而成,如焊剂“431”为高硅高锰低氟焊剂,焊剂“350”为中硅中锰中氟焊剂,焊剂“250”为中硅低锰中氟焊剂。表1-4-3 部分国产熔炼焊剂的碱度值3.焊剂的牌号表示和含义焊剂的牌号表示按熔炼......
2025-09-29

常见的脂类药物有不饱和脂肪酸类、磷脂类、胆酸类、固醇类和色素类等。(二)脂类药物的结构1.脂肪和脂肪酸脂肪的化学组成是甘油与三分子高级脂肪酸,故又称为甘油三酯,天然脂肪大多数是混合甘油酯,具有不对称结构而存在异构体。脂肪酸链长及饱和度的差异直接影响其组成物的理化性质,从而引起生理功能的变化。不饱和脂肪酸组分主要为十八碳烯酸,其中有1个双键的称为油酸,有两个双键的称为亚油酸,有3个双键的称为亚麻酸。......
2025-09-29

由于冷却水在敞开式循环系统中长时间反复使用,使水质具有以下特点。循环水温达500℃以上,则无CO2存在。在火力发电厂的循环冷却水系统中,循环水处理的主要目的是防止腐蚀、结垢产生,其次是控制微生物生长。为了防止循环冷却水系统的结垢、腐蚀和微生物生长,对于补充水来讲,需要有针对性的进行处理,以满足循环冷却水系统对水质的要求。中水作为循环冷却系统补充水的水质应符合表2-9的标准。......
2025-09-29

图5-13 焊接变形的种类(一)纵向收缩变形工件沿焊缝长度方向的收缩叫纵向收缩变形。这种变形是由于坡口不对称,厚度方向上的热输入不同,金属填充量不同,使横向收缩变形在厚度方向上分布不均造成的。在对接、搭接、堆焊、T形接头的焊接时往往会产生角变形。弯曲变形可由焊缝的纵向收缩和横向收缩共同作用引起或单一作用引起。......
2025-09-29

本次调查共鉴定浮游植物20属40种,属于硅藻门和甲藻门,其中硅藻门的种类和数量最多,有17属37种,占总种数的91.11%,甲藻门3属3种占总种数的8.89%(表1)。硅藻门以角毛藻属、圆筛藻属和根管藻属的种类最多,分别为12种、7种和4种;甲藻门以角藻属为主,共2种,占甲藻总种数的50%。表1调查海域的物种组成及其出现频率续表V:61%~100%;A:41%~60%;C:16%~40%;R:1%~15%;X:偶尔出现。......
2025-09-29

如图所示,电阻器大体上可分为固定电阻器、可变电阻器以及半固定电阻器三种类型。可以看出,固定电阻器主要分为四种类型。图2-13示出了具有代表性的三端子可变电阻器的外观及其电特性。图2-13所示是可变电阻器心轴转角的变化率与电阻值变化率之间的关系。半固定电阻器与微调型可变电阻器的外观基本相同。接线端子的序号也与可变电阻器相同,即端子2是可调端。表2-4可变电阻器的分类与特点......
2025-09-29

蒸发传热带走的热量占冷却塔中传热量的75%~80%。常见的一种玻璃钢冷却塔如图2-6所示。玻璃钢冷却塔目前已有系列化产品,其处理的冷却水量可为8~500m3/h,水温降幅为5~25℃。表2-1为通常选用的玻璃钢冷却塔的规格型号。表2-1 部分玻璃钢冷却塔的规格型号由于玻璃钢冷却塔生产已系列化,规格齐全,而且体积轻,占地面积小,排列灵活,可以拆迁,运输方便,造价相对来说也较低,因此常为一些中小型化工厂、化肥厂等选用。......
2025-09-29
相关推荐