冷却水中微溶物质的结垢过程可用图4-1说明。当微溶物质的浓度低于饱和浓度,处于A和a时,溶质呈离子、络离子和单分子状态存在,不会结晶。相反,水中的固态水垢还会溶解进入水中。溶液开始过饱和到晶体能自动析出之间的区域称为介稳区,表示在图中为虚线和溶解度线之间的区域。其中硫酸钙的溶解度最大,介稳区浓度为5~10倍;碳酸钙次之,为35~170倍;磷酸钙的溶解度最小,为1000倍以上。水中杂质越多,介稳区越窄。......
2023-06-30
碳酸钙的溶解或沉淀,腐蚀倾向或结垢倾向与碳酸钙的溶解平衡规律有关。为了从理论上判断循环水的结垢腐蚀属性,需要了解水中碳酸钙的溶解平衡。碳酸钙在水中溶解时:
水中离子浓度直接受水的pH和碳酸平衡状态的影响。碳酸平衡各级反应式为:
碳酸钙在水中的溶解平衡受以下平衡式的综合影响:
式中KS——碳酸钙的溶解平衡常数或碳酸钙的溶度积
碳酸平衡及碳酸钙溶解平衡反应可综合为:
当水中[Ca2+]为某一固定浓度值时,根据碳酸钙溶解平衡,CaCO3达饱和时[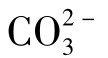 ]B浓度值为:
]B浓度值为:
如果再把水的碱度看做固定数值,根据碳酸平衡,可求出相应饱和时[ ]B的[H2CO3]B值:
]B的[H2CO3]B值:
也可求出达到此饱和平衡的[H+]B及饱和pHB:
[H2CO3]B称为平衡碳酸,pHB称为平衡pH。由于水中碳酸钙不总是处于饱和平衡状态,常处于不饱和或过饱和状态,所以[H2CO3]B和pHB并不是水中实际值,而是在[Ca2+]和[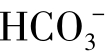 ]不变的条件下,达到碳酸钙饱和状态时应有的数值。
]不变的条件下,达到碳酸钙饱和状态时应有的数值。
将实有的[H2CO3]和pH与[H2CO3]B和pHB相比较,就可以判断出实际[ ]和[
]和[ ]B的相对大小,从而可以判断碳酸钙溶解或沉淀的趋势。
]B的相对大小,从而可以判断碳酸钙溶解或沉淀的趋势。
如水中游离碳酸含量大于[H2CO3]B,则水的pH小于pHB,水中实有[ ]必小于[
]必小于[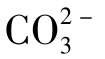 ]B浓度。此时,水中碳酸钙处于不饱和状态,这种水如与固体碳酸钙相遇,就会发生溶解作用,则以下反应向右进行:
]B浓度。此时,水中碳酸钙处于不饱和状态,这种水如与固体碳酸钙相遇,就会发生溶解作用,则以下反应向右进行:
直到建立起碳酸钙的饱和平衡为止。由于这种不饱和水能够溶解循环水系统中换热器上的碳酸钙保护膜,所以水的性质倾向于腐蚀。
反之,如果水中游离碳酸量小于[H2CO3]B值,则pH高于pHB,而其[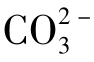 ]含量必大于[
]含量必大于[ ]B浓度。此时,水中碳酸钙为过饱和状态。在适宜条件下,固体碳酸钙会从水中沉淀出来,使以上反应向左进行,直到达到碳酸钙饱和溶解平衡为止。这种过饱和水能在换热器上结水垢,所以水的性质倾向于结垢。
]B浓度。此时,水中碳酸钙为过饱和状态。在适宜条件下,固体碳酸钙会从水中沉淀出来,使以上反应向左进行,直到达到碳酸钙饱和溶解平衡为止。这种过饱和水能在换热器上结水垢,所以水的性质倾向于结垢。
如果[H2CO3]等于[H2CO3]B,pH等于pHB,则水恰处于碳酸钙溶解饱和状态,没有发生碳酸钙再溶解或沉淀的趋势。
有关工业循环冷却水处理的文章

冷却水中微溶物质的结垢过程可用图4-1说明。当微溶物质的浓度低于饱和浓度,处于A和a时,溶质呈离子、络离子和单分子状态存在,不会结晶。相反,水中的固态水垢还会溶解进入水中。溶液开始过饱和到晶体能自动析出之间的区域称为介稳区,表示在图中为虚线和溶解度线之间的区域。其中硫酸钙的溶解度最大,介稳区浓度为5~10倍;碳酸钙次之,为35~170倍;磷酸钙的溶解度最小,为1000倍以上。水中杂质越多,介稳区越窄。......
2023-06-30

其他碳酸盐在水中的溶解度表1-16列出了一些其他碳酸盐在水中的溶解度,供参考。表1-16 其他碳酸盐在水中的溶解度注:当CO2压强为101.3kPa和253.0kPa时,其溶解度分别为0.27g/100g和0.59g/100g饱和溶液。......
2023-06-30

焦化、造气、选矿、造纸、印染、制革等工业废水中亦含有硫化物。通常所测定的硫化物系指溶解性的及酸溶性的硫化物。测定水中硫化物的主要方法有对氨基二甲基苯胺分光光度法、直接吸收分光光度法、碘量法、气相分子吸收光谱法、间接火焰原子吸收光谱法、离子选择电极法等。水样有色、含悬浮物、含有某些还原性物质及溶解性的有机化合物均对碘量法和分光光度法测定有干扰,需进行预处理。本法适用于各种水样的硫化物测定。......
2023-11-23

另外,循环水系统环境条件如温度和pH又较适合多数微生物生长,导致冷却水系统中微生物迅速繁殖,水质恶化,加快了金属腐蚀,进而引发微生物结垢和腐蚀等一系列危害。以下介绍几种工业循环冷却水中常出现的微生物。所以异氧菌属于黏液型细菌,所产生的黏液对循环冷却水系统危害很大。在循环冷却水系统中,金属表面和沉积物之间往往缺氧,以硫酸盐还原菌为主的厌氧菌得以繁殖,当温度为25~30℃时,繁殖更快。......
2023-06-30

循环冷却水中的结垢、腐蚀和微生物问题三大危害会导致循环冷却水系统效率和寿命的降低,对工业生产过程产生巨大的危害。因此,为了保证工业循环水安全行运,必须对其进行严格控制,其中微生物的有效控制是循环冷却水处理技术中重要一环,必须控制其生长繁殖。其中控制循环冷却水系统中的微生物的生长当前标准的做法是使用化学杀生物剂。......
2023-06-30

图14.1流域水循环示意图由图14.1可建立陆地或流域水平衡方程。流域水量平衡方程式中:R为时段河川径流量,由地表径流量、壤中径流量和地下径流量组成;ΔS为时段内流域蓄水量变化。即流域内多年平均水汽净输送量为多年平均径流量。长江流域边界上空水汽输送计算选用5个代表年:1964年(丰水)、1961年(偏丰)、1974年(平水)、1976年(偏枯)、1979年(枯水)。关于长江流域降水、蒸发和径流之间的关系参见本书第13章。......
2023-08-23

异养菌分为本身能从水质中摄取无机物或有机物而生活的腐生菌和依赖寄主供给营养的寄生菌两类。通常所说的异养菌指的是存在于水中的腐生菌。在循环冷却水中,异养菌不仅生长繁殖快,而且为数多,基本上代表了水中全部好氧菌的数量,所以一般在测定时,以这类细菌的数量作为细菌总数。循环冷却水中异养菌数的监测频率应为1次/周。对菌落计数用平皿计数法对异养菌的菌落进行计数,然后再计算每毫升水样中的异养菌数。......
2023-06-30
相关推荐