根据以上的建筑全生命周期循环系统图,对建筑全生命周期的每个生产过程进行物质平衡分析,从而了解整个系统对外的物质输入和输出情况。表4.2物质流分析结果......
2023-06-20
天然水中的碳酸化合物主要是溶解空气中的二氧化碳和岩石、土壤中的碳酸氢盐及碳酸盐,同时水中动植物的新陈代谢和有机物的生物氧化也会产生相当数量的二氧化碳。碳酸是二元弱酸,在水中可进行二级电离。如第一章所述,碳酸化合物有以下三种化合形态存在:
(1)分子状态的碳酸,即水中的游离碳酸,包括溶解的气体CO2和未离解的H2CO3分子。
(2)半化合性碳酸,即重碳酸盐碳酸、重碳酸根离子(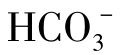 )。
)。
(3)化合性碳酸,即碳酸盐碳酸、碳酸根离子(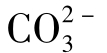 )。
)。
分子状态的两种碳酸(CO2与H2CO3)在平衡时,CO2形态占主要成分,而H2CO3形态还不到分子状态游离碳酸的1%。因此,常以溶解性二氧化碳量作为游离碳酸总量。即:
[CO2]≈[CO2]+[H2CO3]
或
[H2CO3]≈[CO2]+[H2CO3]
如果水中的碳酸化合物总量以ct表示,则:
从碳酸各级平衡反应式来看,如ct值固定,在达到平衡时,三种类型的碳酸量应有一定的比例,而此比例决定于溶液的氢离子浓度。按碳酸各级平衡反应式:
H+增多,即pH降低时,平衡左移,游离碳酸增加。H+减少,即pH升高时,平衡右移,碳酸氢盐及碳酸盐依次增多。
天然水的pH常在中性左右,一般<8.34,可以只考虑一级碳酸平衡,忽略二级碳酸平衡。可用式(2-34)计算pH。
循环冷却水的pH一般在6~9,碳酸的形态主要是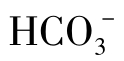 ,在此情况下
,在此情况下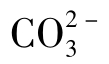 和游离CO2均可忽略不计。
和游离CO2均可忽略不计。
碱度是指水中所含能与强酸发生中和作用的全部物质,即能接受质子H+(氢离子)的物质总量。如第一章所述,组成水中碱度的物质可归纳为三类:
(1)强碱 如NaOH、Ca(OH)2等,在水溶液中全部电离成OH-离子。
(2)弱碱 如NH3、C6H5NH2等,在水溶液中部分反应生成OH-离子。
(3)强碱弱酸盐 如各种碳酸盐、碳酸氢盐、硅酸盐、磷酸盐、硫化物、腐殖酸盐等,在水中可水解生成OH-离子,或者直接接受质子H+。
除一些含有特殊碱类的工业废水之外,大多数天然水、处理后的清水、生活用水和工业废水的碱度是由氢氧化物、碳酸盐和碳酸氢盐组成的。即总碱度包括氢氧化物碱度、碳酸盐碱度及碳酸氢盐碱度,即总碱度M:
当pH>7.0时,[H+]极微;[OH-]一般在pH>10时才能测到;在循环水的pH范围内,[OH-]-[H+]可忽略不计,则可认为:
即总碱度为碳酸氢盐和碳酸盐形态的碳酸之和,但不包括游离碳酸。
(四)M碱度与P碱度的关系
水中的碱度是用盐酸中和的方法来测定的。测定时可用两种指示剂来指示滴定的终点。
用甲基橙作指示剂时,终点为pH=4.3~4.5,此时水中全部的氢氧化物、碳酸盐和碳酸氢盐均被中和,所测得的是水中各种弱酸盐类的总和,故称为总碱度、甲基橙碱度或M碱度。
用酚酞作指示剂时,终点为pH=8.2~8.4,称为酚酞碱度或P碱度。此时,水中的氢氧化物全部被中和,碳酸盐全部被转化为碳酸氢盐,即碳酸盐被中和了一半,而全部碳酸氢盐均未被中和。
M(M碱度):[OH-]+[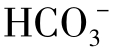 ]+2[
]+2[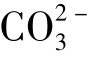 ]
]
P(P碱度):[OH-]+[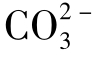 ]
]
碱度的单位为[H+]mol/L。因为OH-与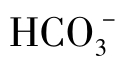 为一价,
为一价,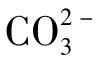 为二价,1molOH-或
为二价,1molOH-或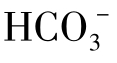 等于1[H+]molOH-或
等于1[H+]molOH-或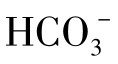 ,而1mo
,而1mo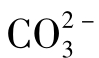 等于2[H+]mo
等于2[H+]mo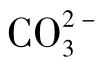 。
。
M碱度包括P碱度。这两种碱度的数量关系可以判断水中碱度的形式和数量,见表2-10。
表2-10 根据M、P碱度判断碱度存在的形式及其数量
天然水的pH大多<8.3,即P=0,只含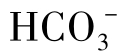 ,不含
,不含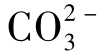 及OH-。也有一些天然水的pH>8.3,P>0,除含
及OH-。也有一些天然水的pH>8.3,P>0,除含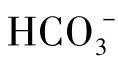 之外,尚含少量
之外,尚含少量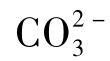 ,但不含OH-。石灰软化水的pH一般为9.5~11.0,即2P≥M,主要含
,但不含OH-。石灰软化水的pH一般为9.5~11.0,即2P≥M,主要含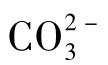 ,有的含少量
,有的含少量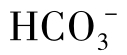 或OH-,但
或OH-,但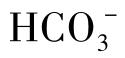 与OH-不共存。石灰软化水的碳酸盐碱度较低,用这种水作补充水的循环水中碱度通常不高。循环水的pH一般为6~9,主要含
与OH-不共存。石灰软化水的碳酸盐碱度较低,用这种水作补充水的循环水中碱度通常不高。循环水的pH一般为6~9,主要含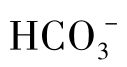 ,有的也含少量
,有的也含少量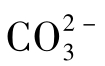 ,但不含OH-。
,但不含OH-。
有关工业循环冷却水处理的文章

根据以上的建筑全生命周期循环系统图,对建筑全生命周期的每个生产过程进行物质平衡分析,从而了解整个系统对外的物质输入和输出情况。表4.2物质流分析结果......
2023-06-20

碳酸钙的溶解或沉淀,腐蚀倾向或结垢倾向与碳酸钙的溶解平衡规律有关。为了从理论上判断循环水的结垢腐蚀属性,需要了解水中碳酸钙的溶解平衡。碳酸钙在水中溶解时:水中离子浓度直接受水的pH和碳酸平衡状态的影响。由于这种不饱和水能够溶解循环水系统中换热器上的碳酸钙保护膜,所以水的性质倾向于腐蚀。在适宜条件下,固体碳酸钙会从水中沉淀出来,使以上反应向左进行,直到达到碳酸钙饱和溶解平衡为止。......
2023-06-30

平面汇交力系合成的几何法设一刚体受到平面汇交力系F1、F2、F3、F4 的作用,各力的作用线汇交于一点A。若平面汇交力系有n 个力,用FR 表示合力矢,则有合力矢对刚体的作用与原力系对该刚体的作用是等效的。图3-17几何法求约束力根据平面汇交力系平衡的几何条件,此3 个力可以组成一个封闭的三角形。......
2023-06-26

循环水系统中主要的水垢是碳酸钙,因而钙离子含量及碳酸盐碱度都是影响结垢的重要因素。虽然循环水中钙含量是受补充水水质和浓缩倍数决定的,但pH可以改变碳酸盐碱度的形式和数量,因而水的结垢倾向是可以由pH调整的。如果浓缩的循环水的pH不进行人为调节,而任其自然变化,则称为自然pH。原因是水中碱度因浓缩而增加,碱度升高使pH升高。......
2023-06-30

测定阳极极化曲线的目的在于判断应用阳极保护的可能性和确定阳极保护的三个主要参数。测定金属的阳极极化曲线时,可按以下步骤进行:1)先测定金属在给定介质中的自然腐蚀电位,这一电位表示金属在活化状态时的表面特性。2)用暂态法测绘出金属的阳极极化曲线,扫描速度为1V/h。3)用稳态测量法,在工作电位范围内测绘出阳极极化曲线。图4-11所示的是430不锈钢在0.5mol/L硫酸溶液中的阳极极化曲线,并由此得到阳极保护的三个主要参数。......
2023-06-23

焦炭主要是由二氧化硅、三氧化二铝、氧化钙、氧化镁等组成。方法二1)将灰皿放入箱式高温炉内在815℃±10℃灼烧至质量恒定。2)干燥试样灰分按式(7-4)计算。2)每次测定灰分时,先进行水分的测定,水分样与灰分测定试样应同时采取。......
2023-06-24

5-磷酸吡哆醛是维生素B6体现生物活性的一种形式。5-磷酸吡哆醛是极性分子,等电点大约在2.9。③样品液的配制:称取一定量碾碎的含有约10 mg 5-磷酸吡哆醛的样品,转入100 mL容量瓶中,加入60 mL 0.1 mol/L盐酸,振荡2 min,超声10 min,冷却后再加入0.1 mol/L盐酸至刻度,摇匀,离心5 min,吸取清液即可注射。......
2023-07-02
相关推荐