在纯铝中加铜或硅后都会使氢的溶解度降低,在其中加入铜后,氢的溶解度急剧减低;在铝及铝合金中加镁后,氢的溶解度反而急剧增大。其他气体在铝中的溶解度一般都不明显,危害性不如氢那么严重,氢是铝及铝合金中危害性最严重的气体。在铜中加镍,氢的溶解度随镍添加量的增加而增大。......
2023-06-26
CaCO3属于难溶盐,溶度积Ksp=2.9×10-9,下面根据溶解的定义推导CaCO3溶解度与溶液pH之间的关系式。
当忽略CaCO3的固有溶解度S,且溶液离子强度较小(γ=1)时,设CaCO3水溶液的溶解度为S。根据溶解度的定义,则有:
从而:
其中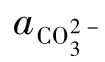 为
为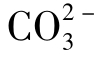 的分布分数,由
的分布分数,由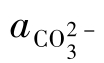 的定义得:
的定义得:
其中Ka1、Ka2为H2CO3在水溶液中的离解常数。将式(1-96)代入式(1-95)并两边同时取常用对数,整理得:
这样,我们得到了CaCO3的溶解度S与[H+]之间的关系式,由于S与[H+]两者均是未知的,还不能得出溶解度S与[H+](即溶液pH)的值。
另一方面,CaCO3溶解在水中时,离解产生的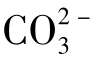 会发生下列两级水解:
会发生下列两级水解:
一级水解:
二级水解:
由于H2CO3的Ka2≪Ka1(Ka1=10-6.38,Ka2=10-10.25),故可认为相对于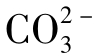 的一级水解,其二级水解可忽略不计。在
的一级水解,其二级水解可忽略不计。在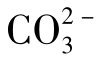 的一级水解中有:
的一级水解中有:
故有
从而
将式(1-98)整理得:
此即CaCO3电离的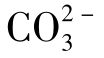 水解pH表达式。将上式变为:
水解pH表达式。将上式变为:
以pH为横坐标,以lgS为纵坐标,由式(1-100)可得到一条曲线,即为CaCO3水溶液的溶解度(S)曲线。由式(1-100)还可以得到CaCO3溶液电离的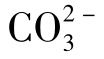 水解曲线。
水解曲线。
(1)碳酸钙水溶液的溶解度曲线由函数关系式(1-100),可分下面几种情况讨论:
①当pH>11时,式(1-100)右边第二项中的[H+]2和Ka1[H+]两项均可忽略,则式(1-100)变为:
此时,CaCO3溶液的溶解度S与pH无关,在lgS-pH关系曲线上为一条平行于横坐标的直线。
②当7<pH<10时,式(1-100)右边第二项中[H+]2和Ka1Ka2两相对于Ka1[H+]项可忽略,则式(1-100)变为:
此时CaCO3溶液的溶解度在lgS-pH关系曲线上是截距为1/2lg(Ksp/Ka2),斜率为-1/2的直线。
③当pH<6时,式(1-100)右边第二项中Ka1[H+]和Ka1Ka2两项相对于[H+]2项可忽略,则式(1-100)为:
此时,CaCO3的溶解度在lgS-pH曲线上是截距为1/2lg(Ksp/Ka1Ka2),斜率为-1的直线。
④在10≤pH≤11和6≤pH≤7时,式(1-100)右边第二项中Ka1[H+]、Ka1Ka2和[H+]2三项相近,故均应保留,在lgS-pH曲线上是光滑的曲线。
综上所述,我们可得到CaCO3水溶液的溶解度对数值lgS与pH的关系是由三段斜率不同的直线和两段光滑的曲线组成,如图1-25中a线所示。
图1-25 CaCO3水溶液的溶解度与pH关系
a—CaCO3水溶液的溶解曲线b—CaCO3电离的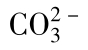 水解曲线
水解曲线
(2)碳酸钙电离的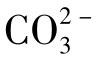 水解曲线将式(1-100)变为:
水解曲线将式(1-100)变为:
由式(1-104),分下面几种情况来讨论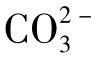 水解曲线的绘制。
水解曲线的绘制。
①当pH>12时,式(1-104)右边第二项中Ka2/[H+]≫1,则Ka2/[H+]+1≈Ka2/[H+],因此式(1-104)变为:
此时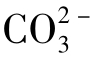 水解曲线是截距为lg(Ka2Kw)、斜率为2的直线。
水解曲线是截距为lg(Ka2Kw)、斜率为2的直线。
②当pH<8时,式(1-104)中右边第二项中Ka2/[H+]≪1,则Ka2/[H+]+1≈1,式(1-104)为:
此时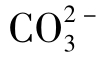 水解曲线为截距为lgKw,斜率为1的直线。
水解曲线为截距为lgKw,斜率为1的直线。
③在8≤pH≤12时,式(1-104)中第二项中不能忽略任何一个数,根据式(1-104)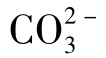 的水解曲线为一段光滑曲线。
的水解曲线为一段光滑曲线。
综上所述可知,CaCO3电离出的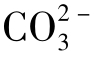 水解曲线在不同pH时,由两段斜率不同的直线和一段光滑的曲线所组成,如图1-25中b线所示。
水解曲线在不同pH时,由两段斜率不同的直线和一段光滑的曲线所组成,如图1-25中b线所示。
由图1-25可知,CaCO3水溶液的溶解度曲线a与CaCO3电离的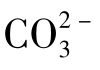 的水解曲线b相交。因此,两者交点所对应的pH及lgS值即为CaCO3水溶液的pH及相应的溶解度。从图1-25中可得CaCO3水溶液的pH=9.84,S=9.3×10-5mol/L。
的水解曲线b相交。因此,两者交点所对应的pH及lgS值即为CaCO3水溶液的pH及相应的溶解度。从图1-25中可得CaCO3水溶液的pH=9.84,S=9.3×10-5mol/L。
(3)其他碳酸盐在水中的溶解度表1-16列出了一些其他碳酸盐在水中的溶解度,供参考。
表1-16 其他碳酸盐在水中的溶解度
注:当CO2压强为101.3kPa和253.0kPa时,其溶解度分别为0.27g/100g和0.59g/100g饱和溶液。
有关工业循环冷却水处理的文章

在纯铝中加铜或硅后都会使氢的溶解度降低,在其中加入铜后,氢的溶解度急剧减低;在铝及铝合金中加镁后,氢的溶解度反而急剧增大。其他气体在铝中的溶解度一般都不明显,危害性不如氢那么严重,氢是铝及铝合金中危害性最严重的气体。在铜中加镍,氢的溶解度随镍添加量的增加而增大。......
2023-06-26

影响气体在金属中平衡溶解度的因素有温度、压力、金属蒸气压、气体与金属的作用性质、化合物气体。它们在金属中的溶解度服从上述规律,即与压力的平方根成正比,并随温度的升高而增大。类金属氧化物则随温度升高而分解,从而使气体在金属中的溶解度降低。......
2023-06-26

参考阵列可以创建依附于其他已有阵列特征的阵列。创建参考阵列的具体操作步骤如下:打开源文件第7章│7-2-6.prt,该实例是含有方向阵列和轴阵列的复合阵列图形。图7-42 阵列图7-43 阵列图7-44 阵列注:只有在原始阵列特征即父项上创建新特征后,才可以使用参考阵列的方法在各个子特征上创建同类特征,而在子项特征上创建新特征后并不能使用参考阵列。......
2023-06-19

刀具几何角度是确定刀具切削部分几何形状和切削性能的重要参数,是由刀面、切削刃及假定参考坐标平面间的夹角所构成的。建立刀具标注角度参考系时不考虑进给运动的影响,且假定车刀刀尖与工件中心等高,车刀刀杆中心线垂直于工件轴线安装。下面以普通外圆车刀为例说明刀具标准角度参考系及刀具标注角度的定义。图2-9基面3.假定工作平面参考系假定工作平面参考系由基面pr、假定工作平面pf和背平面pp组成。......
2023-07-01

电路分析的任务是已知电路中的元件参数和 “激励” (电源),去寻求电路中的 “响应”,从而得到不同电路激励所对应的不同 “响应”的规律。在电路图上标出电压、电流的参考方向,就是为电路方程式中的各电量提供正、负依据,有了参考方向后方可列写出相应的电路方程,进而求得“响应”的结果。......
2023-06-24

正如全球其他离岸国际金融中心一样,人民币离岸中心的建立也会触及国家制度建设以及离岸国经济、金融监管等诸多方面。除了遵守巴塞尔协定,发挥离岸中心所在地政府监管职能也是很好的管控方式。良性的离岸市场应当允许投机套利的发生。例如规定离岸政府当局要实行有关强硬政策,保证人民币离岸业务合理有序地开展,并且不能做出有损中国金融改革和稳定的措施,要配合中国相关的货币政策实施,等等。......
2023-07-19

附录二参考文献(一)基础资料类1.《左宗棠全集》,岳麓书社,1996年。18.刘锦藻:《清朝续文献通考》,浙江古籍出版社,2000年。19.《清实录》之《文宗实录》《穆宗实录》《德宗实录》,中华书局,1987年影印本。26.《刘襄勤公奏稿》,中国图书馆文献微缩复制中心影印1986年。8.光绪《合水县志》,中国公共图书馆古籍文献珍本汇刊,《中国西北稀见方志》(八),中华全国图书馆文献缩微复制中心,1994年。......
2023-07-20

钢管包覆机头 钢管包覆机头结构如图8-7所示。此机头可以对已成型的标准钢管进行包覆生产。图8-7 钢管包覆机头结构1—芯模 2—机头体 3—缩接 4—并紧帽 5—口模 6—包覆层 7—颈接 8—钢管图8-8 涂覆消防管机头结构1—纱管 2—锥头 3—轴承 4—支承辊 5—螺母 6—紧定螺钉 7—内、外涂层 8—口模 9—芯模 10—隔套 11—拉杆此机头在芯模接装一根拉杆,拉杆另一端与锥头相连,纱管从锥头导入由牵引机拉动前行。......
2023-06-15
相关推荐