由金属腐蚀的理论可知,随着溶液pH的增加,水中氢离子浓度降低,碱度增大,金属腐蚀过程中氢离子去极化的阴极反应受到抑制,碳钢表面生成氧化性保护膜的倾向增大,故冷却水对碳钢的腐蚀速度随水的pH升高而降低。②与pH坐标垂直的线,代表与电极电位无关而仅与pH有关。③斜线,代表与电极电位和pH都有关的平衡状态。电极电位高于0.8V发生特别强的氧化作用,在此情况下,水可氧化成氧。......
2023-06-30
水分子的另一个重要特性是两性电解质,即水分子具有酸(提供质子H+)和碱(夺取质子H+)的双重性质。因而水具有电离作用,即:
在水溶液中,带正电荷的质子H+和极性水分子的带负电荷的一端结合在一起,成为水合氢离子(水合质子)H3O+,因此式(1-52)可以写为:
因而在水分子之间存在着质子的传递作用,这种作用的平衡常数称为水的离解常数,用K表示:
水合质子H3O+常简写为H+,因而式(1-54)可以简写为K=[H+]·[OH-]。常数K也就是水的离子积,在25℃时,等于10-14,因而:
K只与温度有关,而与溶液中H+及OH-的浓度无关。水溶液中H+及OH-的浓度反映了溶液的酸碱性。
我们知道,溶液中H+的有效浓度(活度)用负对数表示,即:
水电离时所产生的H+和OH-数量相等,在不含任何杂质的纯水中:
用负对数形式表示时,则:
pH=pOH=7
pH+pOH=14
当pH=7时,表示水呈中性。
当pH>7时,水中[OH-]>[H+],水呈碱性,pH越大,水的碱性越强。
当pH<7时,水中[H+]>[OH-],水呈酸性,pH越小,水的酸性越强。
由于水的电离,在纯水中也存在着氢离子,纯水中的pH=7,但作为复杂溶液的天然水中,氢离子的浓度并不决定于水分子的离解,而主要决定于CO2与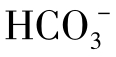 及
及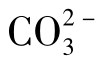 离子间的对比关系。
离子间的对比关系。
分子状态的两种碳酸之间存在着平衡:
平衡时,CO2形态占最主要地位,一般用[CO2]或者[H2CO3]来代表游离碳总量,即:
[H2CO3]=[CO2]=[CO2+H2CO3]
碳酸为二元弱酸,可进行分级电离,其中第一级电离为:
这就是说,水中[H+]与CO2含量成正比,与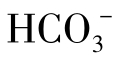 含量成反比。因此,当水中溶有CO2时,pH一般较低。而当CO2自水中逸出时,pH增大。
含量成反比。因此,当水中溶有CO2时,pH一般较低。而当CO2自水中逸出时,pH增大。
在蒸馏水中,由于溶解了CO2,所以水呈酸性反应。如在16℃的蒸馏水中,当与空气中的CO2相平衡时,其中溶解的CO2为6×10-4g/L,即1.36×10-5mmol/L。
将水置于CO2气体可以得到pH的最低值,约为2.8。
事实上,当温度为0℃,CO2分压为一个大气压时,CO2在水中的溶解度等于3.35g/L(或0.076mmol/L),因此,可以得到与上面相近的pH:
在一般情况下,CO2分压不能达到上述数值,同时,由于天然水中有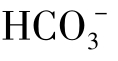 ,因此水的pH总是大于2.8。
,因此水的pH总是大于2.8。
对大多数天然水来说,其pH在6.5~8.5变化。
有关工业循环冷却水处理的文章

由金属腐蚀的理论可知,随着溶液pH的增加,水中氢离子浓度降低,碱度增大,金属腐蚀过程中氢离子去极化的阴极反应受到抑制,碳钢表面生成氧化性保护膜的倾向增大,故冷却水对碳钢的腐蚀速度随水的pH升高而降低。②与pH坐标垂直的线,代表与电极电位无关而仅与pH有关。③斜线,代表与电极电位和pH都有关的平衡状态。电极电位高于0.8V发生特别强的氧化作用,在此情况下,水可氧化成氧。......
2023-06-30

当水的实际pH大于pHL时就会结垢,小于pHL时,就不发生结垢。因此,临界pHL相当于饱和指数中的pHB,不同的是pHB是计算值,而pHL是实验测定值,各种影响因素都包括进去了,其数值显然要比pHB高。临界pHL结垢指数完全是用实验测定值代替热力学平衡推导式来预测水中的碳酸钙是否会沉淀出来,其实用意义比IB指数、IW指数和IP指数为好,以此方法研制成的测垢仪已经投入实际应用。......
2023-06-30

成品中蛋白质含量不低于1%称乳饮料,蛋白质含量不低于0.7%称乳酸饮料。果汁乳饮料是指在牛乳或脱脂乳中添加果汁、砂糖、有机酸和稳定剂等,混合调制而成的含乳饮料。3)白砂糖果汁乳饮料中加入一定量的蔗糖,不仅能改善风味,而且在一定程度上有助于防止沉淀。当pH值降至6.0以下,则饮料成分分离的危险性就很大。......
2023-12-05

首先计算w5这一路径,这里需要一个方法来计算w5对总误差的影响,刚好导数的意义是描述参数变化对函数造成影响的变化率,或者叫斜率。本例中我们把学习率η设定为50%,也就是0.5,于是w5的权值将被调整为我们用类似的方法把所有的权值都调整一遍:得到如下计算结果:w5值变化: 0.3 =〉 0.257 722 924 637 365 85。w6值变化: 0.35 =〉 0.307 509 195 210 186 9。w7值变化: 0.4 =〉 0.413 242 963 882 813。w8值变化: 0.45 =〉 0.463 309 912 957 708 74。w3值变化:0.15 =〉 0.14970092750954914。......
2023-10-21

随着土体中有机质的增加,土体的p H值随之降低。图2.14所示为某石灰加固土无侧限抗压强度与水泥土p H值之间的关系。可见,当p H值<7以后,固化土的无侧限抗压强度明显降低。图2.16所示为3种龄期下水泥土强度与土中硫酸根离子浓度的关系。试验中,图2.17所示为不同铅含量时水泥固化土无侧限抗压强度随龄期的变化。......
2023-06-26

任何物质的抗氧化能力都可以通过与Trolox的抗氧化能力相比较而测得。在本方法中定量的单位被定义为“1 g样品中含有1μmol Trolox的抗氧化能力”,用符号TEμmol/g来表示。ABTS*+最大UV 吸收在734 nm 处,吸收强度将因抗氧化剂的存在而下降。用磷酸和0.1 mol/L氢氧化钠溶液调节p H 至7.4,加水至刻度,摇匀。②ABTS 溶液的配制:称取384 mg ABTS 和66.5 mg过二硫酸,转入100 m L容量瓶中,加水溶解并定容,摇匀。......
2023-07-02

今天,我们俩就是“鱼塘主”。我带上我的G-shock手表来彰显本“鱼塘主”的霸气。我发现鱼儿们聚集在增氧泵的一旁,小嘴露出水面,大概是缺氧了。pH值过高或过低,可能会造成鱼类的死亡。pH值低于6.5容易使鱼患生理缺氧症,塘鱼会经常浮头。而pH值过高的水则可能腐蚀鱼的鳃部组织,使鱼失去呼吸能力而大批死亡。没几分钟我就累趴了,这鱼塘主真的不好当呀。称完重量,就要将鱼放入蓝色的带有原塘水的鱼桶里,运往菜市场、餐馆销售。......
2023-11-21

确定链霉素生产工艺流程,如图1-2-10所示。链霉素是一种高极性并有很强亲水性的有机碱,整个分子成为一个三价盐基强碱。链霉素易溶于水,难溶于有机溶剂。适合于菌丝生长的pH为6.5~7.0,适合于链霉素合成的pH为6.8~7.3,pH低于6.0或高于7.5,都对链霉素的生物合成不利。......
2023-06-24
相关推荐