钛和钛合金的线膨胀系数与光学玻璃的线膨胀系数相近,是人造卫星相机镜头框架和其他光学仪器框架的理想结构材料。......
2025-09-29
在自然界不存在化学概念上的纯水。因为天然水在循环过程中不断地与环境中的各种物质相接触,并且或多或少地溶解它们,所以天然水实际上是一种溶液,并且是成分极其复杂的溶液。例如,作为天然水主体的海水是含有3.3%~3.7%盐类的浓稠的电解质水溶液,在这种溶液中不仅含有像NaCl那样的一价对一价的电解质,而且含有大量的Ca2+与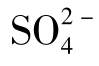 等二价离子,这些离子在海水中多以络离子的形式存在。天然水的物理化学性质在许多方面与纯水存在不同,例如,天然水的电导率是纯水的数百倍。另外,由于溶质与水结合,在一定程度上也可改变水的结构。
等二价离子,这些离子在海水中多以络离子的形式存在。天然水的物理化学性质在许多方面与纯水存在不同,例如,天然水的电导率是纯水的数百倍。另外,由于溶质与水结合,在一定程度上也可改变水的结构。
1.冰点
纯水的冰点为0℃。作为溶液的天然水,随着溶质含量的增高,冰点相应地降低。溶液的冰点与溶质的摩尔数之间构成关系式(1-2):
式中 T0、T——分别为纯溶剂及溶液的冰点
ΔHv——溶解热
N——溶质的摩尔数,若溶质的摩尔数很小,则T=T0
R——气体常数8.314J/(mol·K)
如不用溶质的摩尔数而用质量摩尔浓度m,则:
式中 M1——溶质的分子质量
λb——摩尔冰点降低常数,对溶剂来说是特定的常数
水的摩尔冰点降低常数为1.855℃/mol。天然淡水溶质含量低,冰点降低不明显。海水的大多数物理化学性质与0.5mol/kg的食盐水溶液极为相似,假若采用式(1-4)求0.5mol/kg的食盐水的冰点降低,则为-0.93℃。但是实际上测出的0.5mol/kg的食盐水冰点降低,大约为计算值的2倍,这是因为在式(1-4)中把食盐设想为一个不解离的分子。实际上食盐在水溶液中完全解离成离子,由于每个离子均具有与分子相同的作用,所以必须把质量摩尔浓度加倍。这一事实正是盐类在水溶液中解离成离子的一个证据。通过实验查明,海水的冰点(T)与海水的含盐量(S)之间存在如下关系:
图1-5所示为天然水的冰点与含盐量的关系。
图1-5 天然水的冰点与含盐量的关系
2.蒸汽压
纯水的蒸汽压是温度的函数。此外,由于电解质的溶解,溶液的蒸汽压下降。在稀溶液中,根据拉乌尔定律:
式中 P、P0——分别为溶液及纯水的蒸汽压
N1——溶剂水的摩尔分数
在计算溶液的蒸汽压时,如果不把各个离子当作分子来计算,就不能得到正确的计算结果,这与计算冰点时的情况是一致的。
对天然水而言,其蒸汽压(P)与含盐量(S)之间存在下列关系:
根据式(1-7),对含盐量为35‰的海水,P=1098P0,即蒸汽压约较少2%,但是蒸汽压随含盐量的变化要比蒸汽压随温度的变化小许多。
3.渗透压
天然水有比纯水高的渗透压。渗透压P(0°)与冰点(t°)之间有下列关系:
此外,渗透压随温度变化可用下式计算:
再者,渗透压P与温度t、氯离子浓度c(%)之间存在着下述关系:
图1-6所示为天然水的渗透压与含盐量的关系。
4.扩散
天然水中的水分子及离子的运动大致可区分为两大类:
(1)由于水流而引起的水的整体运动。
(2)由于分子和离子的运动所引起的扩散。
图1-6 天然水的渗透压与含盐量的关系
天然水的混合主要是由前者引起的。但在界面层上物质的移动与天然水中的化学反应过程大多数是由扩散所控制的。
扩散系数D可由菲克定律得出:
式中 J——由于扩散在单位时间通过单位面积物质的量[mol/(cm2·s)]
∂c/∂x——溶质移动方向上的浓度梯度
D——溶质在某种介质中的扩散系数,m2/s
根据实验事实所设想的扩散机理认为,不是一个水分子的氢原子变成氢离子后相继向相邻的水分子移动,而是一个水分子与相邻的水分子或溶质交换位置。
在液体水中处于正四面体中心的水分子,有4个水分子在顶点的方向上与之配位。其中,两个水分子的方向是与氢核构成共价键的方向,其他两个水分子的方向是具有孤对电子的方向。因此,两个分子以偶极距的正极朝向中心分子,而另两个水分子的负极朝向中心分子。
电解质对水的扩散系数影响较大,在这里可以设想,如果将该中心的水分子用正离子置换,一价的离子在0.6nm的距离上具有106V/cm的强大场强,可以引起周围的水分子以其偶极子负的方向朝着正离子的方向定向。这样定向的水分子由于受到正离子很强的约束力,所以称作电缚水分子,位于中心的离子称为水合离子。与此相反,处于距离很远位置上的水分子,由于不受离子电场的影响,具有液体水本来的构造。在上述两者之间的区域内,受到离子和水分子两方面的影响,形成了液体水结构遭到破坏的区域。如图1-7所示。
图1-7中的A、B、C分别表示水分子在离子附近定向的区域、水结构达到破坏的区域和水保持原有结构的区域。离子半径越小,离子电荷越高,A区域就越厚。而B区域反而有变小的倾向。
A区变大,B区变小,从整体上看,离子周围的结构是明确的,所以这样的离子称为促成结构离子。
与此相反,离子半径大的,由于A区小,B区大,即破坏了水的结构,称为破坏结构离子。例如,K+和Cl-对结构稍有破坏性,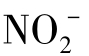 和
和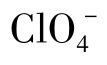 这样的大离子是强的破坏结构离子,而Mg2+、Na+、
这样的大离子是强的破坏结构离子,而Mg2+、Na+、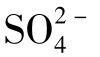 属于促成结构离子。
属于促成结构离子。
在水的扩散中,由于使水结构加强的离子存在,妨碍了水分子相互位置的交换,所以水的扩散系数减小。相反,由于破坏结构离子的存在可使水的扩散系数增加。在KCl、NaCl和MgSO4存在下,水的扩散系数的实测值(D)与纯水的扩散系数(D0)之比如图1-8所示。
图1-7 正离子周围水的结构
图1-8 D/D0与电解质浓度
从图1-8中可以明显看出,含有KCl的溶液水的扩散系数稍有增加,含有MgSO4的溶液水的扩散系数显著减少。
5.盐类离子的水化作用
由于水是极性分子,水分子中的正极(H)被水中阴离子所吸引,负极(O)则被水中阳离子所吸引。由于水中离子与水分子偶极间的相互吸引作用,使水中正、负离子周围为水分子所包围,这种作用称为盐类离子的水化作用,这也是多数盐类离子溶于水的主要原因。
离子水化后生成水合离子,如水合铁离子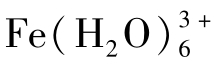 、水合亚铁离子
、水合亚铁离子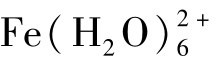 、水合铝离子
、水合铝离子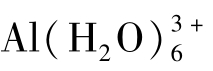 和水合氢离子H3O+等。
和水合氢离子H3O+等。
6.水的密度
水与普通物质不同,当冻结时其体积不是收缩而是膨胀的。在0~4℃温度内,随着温度的升高,水的体积反而缩小,至4℃(严格讲为3.98℃)时体积最小,而密度最大,达到1.0000g/cm3,超过或低于此温度体积都会膨胀。0℃时,水的密度为0.9999g/cm3,而0℃时的冰体积增大,密度降为0.9168g/cm3。
另外,当压力加大时,一般物质的凝固点均有所升高,而水的冰点却略为下降。一般物质在压力升高时热膨胀系数均减小,而水在0~45℃,热膨胀系数随压力升高而增大。这些都是水在温度或压力变化时体积效应的异常现象。
7.水的表面张力
液体自由表面的分子,由于液体内部分子对它们的吸引,会受到向内部吸引的力,这就是表面张力,从而使液面具有缩小的趋势,即表面张力就是作用于液体表面边界单位长度上的力。在常温下的所有液体中,除汞之外,水具有最大的表面张力,达72.75×10-5 N/cm,而其他液体只有(20~50)×10-5N/cm,故水具有明显的毛细管现象,并有润湿作用。水的表面张力随温度升高而减小,见表1-3。
表1-3 水温与表面张力的关系
自然界中大多液体的表面张力在(20~50)×10-5N/cm,而水的表面张力在(70~80)×10-5N/cm,水与其他液体表面张力对比如图1-9所示。
图1-9 水与其他液体的表面张力对比
水依靠较大的表面张力产生毛细现象,而且在很大程度上也影响水溶液中的吸附现象,如水在18℃(291K)时,表面张力为73×10-5N/cm,可使直径为0.1mm的毛细管中的水位上升15cm。
水中加入溶解的盐类可增加表面张力;水中加入表面活性剂可减小表面张力。(https://www.chuimin.cn)
8.水的比热容最大
在所有液体和固体物质中,水具有最大的比热容,即1g水每升高或降低1℃时所吸收或放出的热量比任何1g其他物质都多,达到75.3J/(mol·℃)。因此天然水体可以调节环境气温,使其变幅不至于过分剧烈,起到调节自然界温度的作用,使得地球上的气候适合于人类居住及动植物的生长。
水的溶解热和蒸发热也是异常的,由冰溶解为水时,其比热容要增大2倍以上,而一般固体熔化时比热容的变化很微小。由于这一特性,冰在溶化时可使冰水混合液的温度保持在冰点。而当水沸腾时,水温保持在沸点,在101325Pa的压力下水的沸点为100℃,水在达到沸点以前有着很长的液态阶段,这一特殊性是因为水分子偶极间的引力大大超过一般液体,是水分子间强烈氢键缔合作用造成的,这些都是水在比热容方面的特有现象。
9.水具有相对高的熔点和沸点
水具有很高的沸点。在元素周期表中,与氧同族的元素是硫、硒、碲,它们的氢化物分别是H2O、H2S、H2Se、H2Te。与氧同族的这几种化合物的熔点、沸点等参数见表1-4。
表1-4 水与类似化合物特性的比较
从表1-4中可见,按元素周期表规律,这几种化合物的特性应呈单一倾向变化,对于H2Te、H2Se、H2S来说确实是这样变化。按此规律推算,水应具有如表中(H2O)一行所列的数值,在液体状态时,水的温度范围应该在-100℃至-80℃,也就是说,在地表温度条件下水应该完全以气态存在,而事实上,水主要呈液态存在。因此,自然界中的水表现出了异常高的熔点和沸点,有别于同族元素的其他化合物。水的这些异常特性是水能在环境系统中发挥巨大作用的原因之一。
水与氧同族元素的氢化物的沸点(T)与熔点(M)如图1-10所示。
图1-10 与氧同族元素的氢化物的沸点与熔点
10.溶解及反应能力极强
许多物质在水中不仅有很大的溶解度,而且有最大的电离度。水作为一种溶剂,其溶解能力极强,而且由于其介电常数很大,使溶质电离的能力很强。
水中溶解的各种物质可以进行各种化学反应,与许多金属氧化物、非金属氧化物以及活泼金属都可以产生化合作用,其生成的物质再进一步参加不同性质的各种反应,而且也可以与溶剂水发生各种反应,所有这些都使水在环境中起着巨大的地球化学营力的作用。
11.水的黏度与流动性
液体的黏度与流动性是一对矛盾体。水具有较小的黏度和较大的流动性,由于在液体中产生流动,每个分子必定要偏离平衡位置,所以黏度与分子的相对位置(即结构)有密切的关系。在任何情况下,黏度均随温度升高而急剧降低,图1-11给出了纯水的黏度(η0)以及40‰海水与纯水黏度比(η/η0)随温度的变化关系。
图1-11 水的黏度及海水/纯水黏度比随温度的变化
当温度增高时,水的黏度减小;另一方面,当水中溶解盐的含量增高时,黏度增大,所以海水比淡水黏度高。这是由于黏度与水的结构密切相关,所以,当存在对水的结构有明显影响的电解质时,必然使水的黏度发生较大的变化。
水溶液的黏度η与电解质的摩尔浓度c之间有下述关系:
式中 A·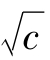 ——离子间的静电场决定的
——离子间的静电场决定的
B·c——水溶液所特有项,和离子与水分子的相互作用有关
c——电解质的摩尔浓度
图1-12表示当水中有电解质存在时,水溶液的黏度(η)与纯水黏度(η0)的比值随电解质浓度c的变化。
从图1-12中可知,像MgSO4等具有二价离子的盐类,可使水溶液的黏度显著增加。
水溶液黏度随电解质浓度的增加的现象是由于当电解质浓度低的时候,每个离子在各自的范围内相互独立,而随着电解质浓度的增加,相邻离子就变成互相重叠了,如图1-13所示。A区域是水分子受到静电场的作用而定向的区域,具有明确的构造,从而妨碍水溶液的流动,使黏度增大。
图1-12 各种电解质浓度与黏度的关系
图1-13 正离子周围水的结构
另外,压力对水的黏度也具有影响,当水处于中等压力时,黏度较小;当压力继续增加时,水的黏度将会随压力的增加而增大。
12.水的介电常数
介电常数(ε)是指在某种介质中两电荷间引力或斥力比在真空或空气里减少的量。介电常数越大,两电荷质点间的引力越小,反之,则越大。水具有很高的介电效应,因此纯水的介电常数很大。天然水中由于含有电解质,在电解质静电场的影响下,对周围的水分子有某种束缚,因此天然水的介电常数有所降低。
设纯水的介电常数为ε0、天然水溶液的介电常数为ε,有如下关系:
式中 ni——离子数
δi——各个离子的特定值,称介电常数降低系数,该值表示电解质束缚水的能力
c——电解质的摩尔浓度
几种常见离子的介电常数降低系数δi见表1-5。
表1-5 介电常数降低系数δi
在常温下,纯水的介电常数为81,表示正负电荷在水中的相互吸引力比在真空或空气中减少1/81,在0℃时,纯水的介电常数为88,100℃时为56。
13.水的导电性能
一般使用“电导”或“电导率”κ来描述水的导电性能。水的电导主要是由溶质控制的,采用电导率仪器可以非常准确地测定出电导率。目前在水化学研究中,对天然水的离子总量的测定多采用电导法,而不采用化学滴定法。
图1-14给出了各种含盐量下海水的电导率随温度的变化。电导率受压力的影响比较小,在一般深海所受到的压力范围内,电导率的增值在12%以下,如图1-15所示。
图1-14 海水的电导率与温度的关系
图1-15 海水(35‰)电导率随压力的变化纵轴是压力为P时电导率相对1个大气压增加率%
水本身为弱电解质,只有极少的分子离解成H+和OH-。极纯的水几乎不导电,电阻率很大。理论上的纯水在25℃时的电导率为0.054μS/cm,电阻率为18.248MΩ·cm。在水中溶有电解质时,导电能力增加。
海水的电导率与含盐量成比例增加,在相同含盐量的情况下,0℃附近,温度每增加1℃电导率增加3%;在20℃附近,温度每增加1℃电导率增加2%。
14.水的光学性质
水的透明度与通过它的光线的波长有关,紫外线能完全透过水,而红外线则很难透过。水可吸收大部分可见光中的橙色和红色,故蓝色光可透过较厚的水层。
物质之所以呈现不同的颜色,是由于其对不同波长的光有不同程度的透射与反射。对于透明的物质呈现的是透过光的颜色,对于不透明的物质呈现的是反射光的颜色。
溶液的颜色是因它选择性地吸收某波长的光而呈现吸收光互补色的颜色。水中细小的悬浮物与胶体粒子会降低水的透明度,并产生光的散射,使水浑浊。
15.吸光度和透射比
溶液的吸光度是在特定波长下溶液中成分吸收光的量的度量指标。根据比尔-朗伯(Beer-Lambert)定律,溶液吸收光的量与吸光分子浓度和光在溶液中穿过的长度成比例,而与入射光的强度无关。由于即使是纯水也会吸收入射光,所以用空白样(通常是蒸馏水)作为参比。吸光度可以通过下面的式子得到:
式中 I——特定波长λ下穿过已知长度的溶液后的光强度,mW/cm2
I0——特定波长λ下穿过已知长度(通常为1.0cm)的空白样(如蒸馏水)后的透射光强度,mW/cm2
λ——波长,nm
ε(λ)——波长λ下吸光物质的摩尔吸收系数,L/(mol·cm)
c——吸光物质的浓度,mol/L
x——光路的长度,cm
kA(λ)——波长为λ时的吸收系数,cm-1
A(λ)——波长为λ时的吸光度,量纲为1
相关文章

肉的食用品质及物理性状主要是指肉的色泽、气味、嫩度、肉的保水性以及肉的 pH、容重、比热、肉的冰点等。这些性质在肉的加工贮藏中直接影响肉品的质量。这些肉的味质是通过人的高度灵敏的嗅觉和味觉器官反映出来的。例如,把牛肉中的风味前体物质用水提取后,剩下溶于水的肌纤维部分几乎不存在香味物质。(三)肉的嫩度肉的嫩度是消费者最重视的食用品质之一,它决定了肉在食用时的口感,是反映肉的质地的指标。......
2025-09-29

而交流耐压试验时会发生介质损耗,致使绝缘发热,有可能给发电机造成不可逆的损害。交流耐压试验时,因发电机对地电容很大,所以需要较大容量的试验设备。3)直流耐压试验容易发现发电机端部的绝缘缺陷,而交流耐压试验容易发现槽部和槽口绝缘的缺陷。表8-1 交、直流耐压试验电压的对应关系......
2025-09-29

天然水中存在的杂质主要由所接触的大气、土壤等自然环境所引入,同时人类活动产生的各种污染物也会进入天然水体。按不同的原则,可以对天然水体中的杂质进行分类。表1-1水中杂质的尺寸与外观特征悬浮物主要是泥砂类无机物质和动植物生存过程中产生的物质或死亡后的腐败产物等有机物。天然水中所含有的无机杂质主要是溶解性的离子、气体及悬浮性的泥沙。天然水中的有机物与水体环境密切相关。......
2025-09-29

若测量电流,选择电流表;若测量电压,选择电压表。⑥测量完毕,将转换开关置于最高挡。在结构上,指针式万用表由表盘、测量电路和转换开关3部分组成,可测量电流、电压、电阻及晶体三极管的“hFE”等。测量值从表盘刻度尺上读取,其中,“Ω”为电阻刻度值;“”为交直流电流、电压刻度值;“10”为交流10 V刻度值;“hFE”为三极管电流放大系数刻度值。图1.2.9思考与练习1.2.3的图图1.2.10思考与练习1.2.4的图......
2025-09-29

这种情况下的奇点称为稳定节点。图7-34中心点以上二阶非线性系统的相轨迹结论列于表7-3,供分析时参考。表7-3二阶非线性系统的相轨迹2.奇线奇线是特殊的相轨迹,表示系统的平衡位置不是一点,而是一个区域,究竟在该区域的哪一点平衡,则由初始条件决定。系统的运动最终会趋向于极限环内的奇点,或远离极限环。......
2025-09-29

CPS对智能制造系统具有非常重要的意义。总而言之,CPS可以促使虚拟网络与实体物理系统相整合。在制造业中,它促使企业建立全球网络,把产品设计、制造、仓储、生产设备融入CPS中。CPS能够引领制造业不断向着设备、数据、服务无缝连接的方向发展,起着推动制造业智能化的重要作用。......
2025-09-29

图2-18CPS结构体系图2-18CPS结构体系图2-19CPS反馈环CPS是运行在不同时间和空间范围的闭环(多闭环)系统,且感知、决策和控制执行子系统大多不在同一位置。逻辑上紧密耦合的基本功能单元依存于拥有强大计算资源和数据库的网络基础设施,如Internet、数据库、知识库服务器及其他类型数据传输网络等,能够实现本地或者远程监测,并影响物理环境。......
2025-09-29
相关推荐