它并没有消失,世界上的任何事物都不会消失。燃尽的煤也绝没有消失。这个伴随着热量释放的分解过程,被称为燃烧。因此,只有保持空气畅通,才能使炉中的火持续燃烧。火炉中这种释放大量热量的猛烈燃烧并不是煤或碳唯一的消耗方式。腐烂引起的燃烧也会释放热量,但一般不易察觉,这很好解释。无论是一截腐烂的老树干,一个发热的稻草堆,还是一块熊熊燃烧的木柴,无一不反映了不同速度的燃烧。......
2023-10-21
燃烧化学反应最重要的应用是,燃烧气体平衡构成和绝热火焰温度的计算。
1.基本反应
燃料的主要成分——碳和氢气的反应式为
C+O2=CO2
H2+1/2O2=H2O
上述反应式仅表现了反应开始和结束时的形态等式,称为综合反应式或化学计量式。在实际燃烧反应中,几乎没有燃料与氧化剂直接反应生成燃烧生成物的情况。如,氢气与氧气的燃烧反应,首先通过这些分子的热分解反应生成氢原子(H)、氧原子(O)、羟基(OH)自由基等,它们相互发生一系列反应,结果生成在化学性质上稳定的水蒸气。如此比较单纯的反应称为基本反应(元反应、链反应)。基本反应虽是单纯物质反应,但超过100多种反应,这些大体可以分类为5种。
(Ⅰ)H2+M→H+H+M
O2+M→O+O+M
(Ⅱ)H+O2→OH+O
O+H2→OH+H
O+H2O→OH+OH
(Ⅲ)OH+H2→H2O+H
H+H2O→OH+H2
(Ⅳ)H+O2+M→HO2+M
OH+H2O2→H2O+HO2
(Ⅴ)H+OH+M→H2O+M
O+OH+M→H2O+M
上述反应式不仅向箭头方向进行(正反应),通过分解也会逆向进行(逆反应)。因此,燃烧反应任何时候也不会结束,在燃烧气体中包含反应生成的中间物质。
①链引发(创造)反应:上述反应式(Ⅰ)是为了引发燃烧反应,把燃料和氧化剂从稳定分子创造为活性基(还称为链载体,自由基)。活性基是电子没有成双的分子或原子,很容易发生反应。
②支链反应:上述反应式(Ⅱ)为易发生反应的活性基数量增加的反应。
③链转移(传播)反应:上述反应式(Ⅲ)为仅活性基发生交替,但其数量不变的反应。
④气相停止反应:上述反应式(Ⅳ)为活性基减少,或转换为活性度较低的超氧化氢(HO2)等稳定分子的反应。在此反应式中,M称为第3体(或第3分子),是从活性基获得能量,即为了满足化学式上的能量守恒,仅进行能量交换而自身不发生变化的分子。与第3体的碰撞反应在高压状态下更要加重,因此燃烧反应随压力的变化而会发生改变。
⑤表面停止反应:氢原子(H)、氧原子(O)、羟基(OH)自由基等活性基向壁面扩散,与壁面接触时发生反应,由此其自由基状态被破坏,转换为稳定分子的反应。
2.反应速度
(1)基本反应速度 现在分析一下基本反应的反应速度。下面对单分子反应、2分子反应和3分子反应速度进行说明。
单分子反应是燃料与氧化剂进行分解的解离反应(H2→H+H,O2→O+O)为具有代表性的单分子反应。2分子反应是2个分子的反应,3分子反应是3个分子的反应。燃烧反应中2分子反应占大部分,反应速度公式的推导方法均类似。
对化学物种A和B反应生成化学物种C和D的2分子反应进行分析,反应式为
A+B→C+D (4.3)
此反应的反应速度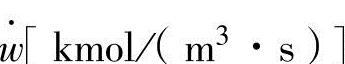 以物质的量浓度的时间变化进行计算。
以物质的量浓度的时间变化进行计算。

式中,[C]为化学物种C的物质的量浓度[kmol/m3];t为时间;k为通过试验获得的系数,称为反应速度系数,是温度的函数,表达为
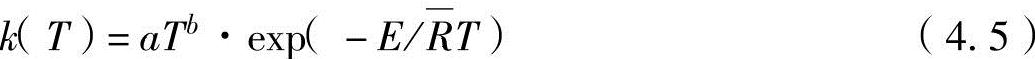
式中,a为频率因数;b为试验因数;E为活化能量;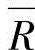 为通用气体常数(=8.314kJ/kmol·K)。每个反应的因数和活化能量都不同,均通过试验获得。
为通用气体常数(=8.314kJ/kmol·K)。每个反应的因数和活化能量都不同,均通过试验获得。
式(4.3)反应仅表示了正反应,可能还存在逆反应。正反应与逆反应的速度系数分别为kf、kr,反应速度分别为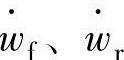 时,正反应的净化反应速度
时,正反应的净化反应速度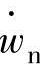 以下式可以表达。
以下式可以表达。
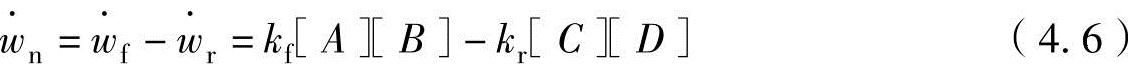
反应速度用式(4.4)进行分析,温度和反应物质的浓度越大越增加。尤其是,从式(4.5)可以看出,反应速度以温度的指数函数增加。
(2)平衡系数 如果反应的时间很充分,温度和压力保持一定值,反应物质和生成物质的浓度也保持一定的值。这不表示化学反应停止,而是正反应速度与逆反应速度趋于相等的状态,即净反应速度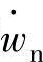 处于0的状态。这称为化学平衡。
处于0的状态。这称为化学平衡。
根据式(4.6),因化学平衡状态为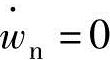 ,以此推导出下述关系式:
,以此推导出下述关系式:

式中,[A]、[B]、[C]、[D]为化学物种的浓度;Kc为浓度平衡系数。此公式说明正反应速度系数与逆反应速度系数之比等于浓度平衡系数。因反应速度系数K仅为温度的函数,因而浓度平衡系数Kc也仅为温度的函数。
通常,考虑反应式aA+bB→cC+dD,摩尔浓度平衡系数也可以表达为

物质的量浓度[A][kmol/m3]在状态方程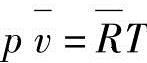 中为摩尔比容
中为摩尔比容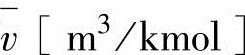 的倒数,表达为
的倒数,表达为
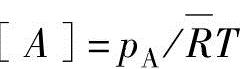
把上式和化学物种B、C、D相关的参数代入到式(4.7b)中并进行整理,可以获得以成分分压表示的平衡系数(或压力平衡系数)Kp。

在上式中的各成分分压pA、pB、pC、pD随系统压力p由下式进行定义。

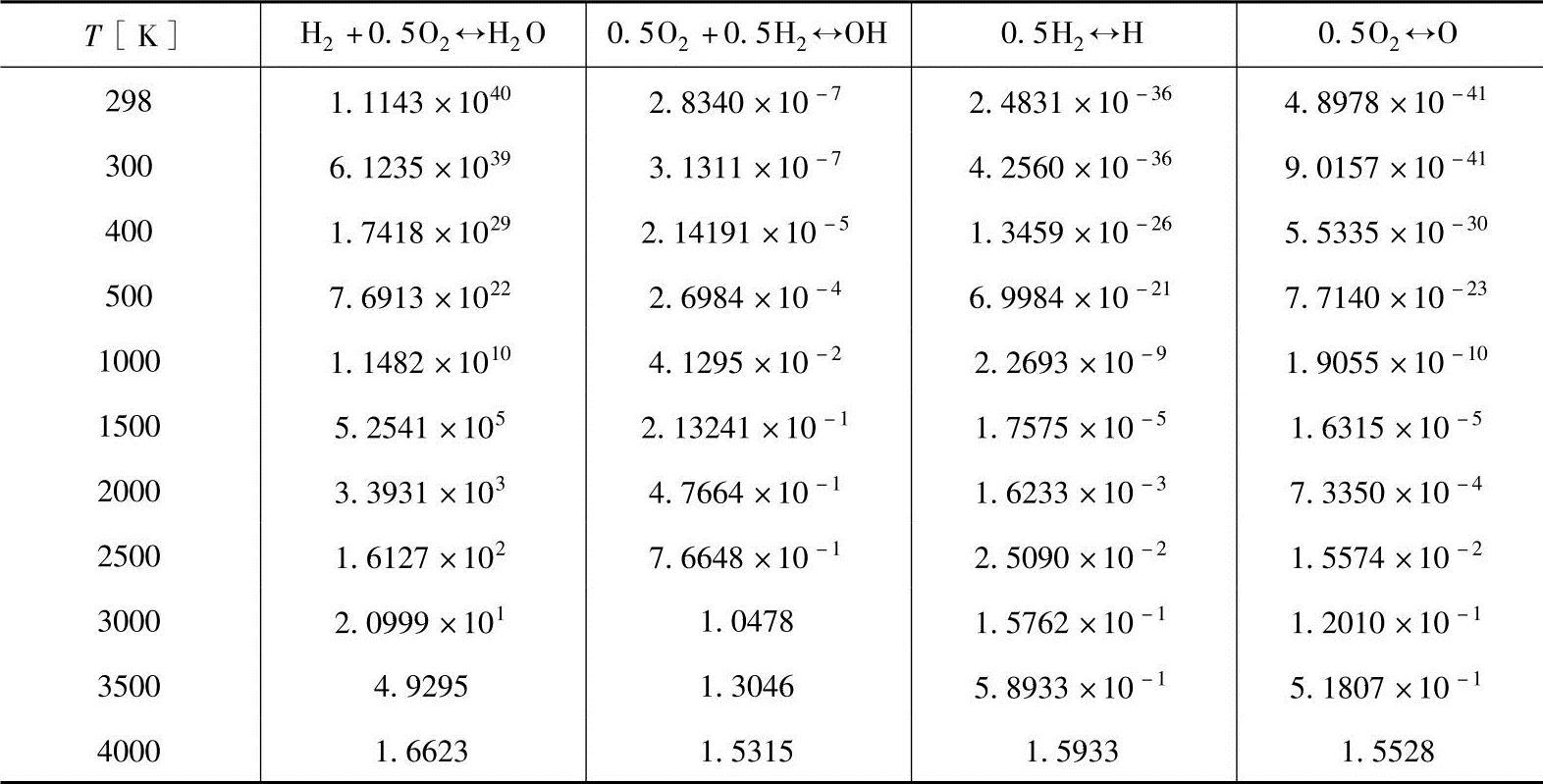
求化学平衡时,使用平衡系数(压力平衡系数)的情况较多。表4-9显示了几种反应的平衡系数Kp。平衡系数随温度的变化会发生大的改变。平衡系数值为如同1040、10-41的较大的指数函数,因此也用lg(Kp)值进行表示。
表4-9 平衡系数
3.热解与绝热火焰温度
在理论上能达到的燃烧气体的最高温度称为绝热火焰温度。但是,在实际燃烧中能获得的最高温度通常比绝热火焰温度小。这是因为,在高温作用下始终存在着燃烧生成物获得热量返回到原来反应物质的过程,即热解过程会始终发生,以及如生成氮氧化物(NOx)等的吸热反应也时刻存在。
(1)热解 碳氢化合物燃料与氧气发生反应,会生成二氧化碳(CO2)和水(H2O),在1700K以上的高温下,生成的部分二氧化碳(CO2)和水(H2O)吸热发生逆反应重新分解成原来的氧气(O2)、氢气(H2)、一氧化碳(CO)。把这种在热量的作用下分子被分解的现象称为热解(分解、热分解),反应式为
CO2→CO+1/2O2-283.12[MJ/kmol] (4.9)
H2O→H2+1/2O2-241.94[MJ/kmol] (4.10)
即,二氧化碳(CO2)吸取283.12MJ的热量,1kmol(44kg)二氧化碳(CO2)被分解为一氧化碳(CO)和氧气(O2)。同样,1kmol水(H2O)吸收241.94kJ的热量被分解为氧气(O2)和氢气(H2)。此外,燃料的氧化剂在温度高于2000K时,与空气中的氮气(N2)和氧气(O2)发生吸热反应生成一氧化氮(NO)。
N2+O2→2NO-180.38[MJ/kmol] (4.11)
因此,在高温条件下,发生热解、一氧化氮(NO)生成等吸热反应,绝热火焰温度(燃烧最高温度)会降低。
通过一氧化碳与氧气之间的反应分析热解过程:
CO+1/2O2↔CO2
通过热解,如果在1mol生成的二氧化碳(CO2)中,α摩尔吸热还原为一氧化碳(CO)和氧气(O2),逆反应式为
αCO2→αCO+α/2O2
在上述反应式中0≤α≤1。因此一氧化碳(CO)与氧气(O2)的反应式为
CO+1/2O2→(1-α)CO2+αCO+α/2O2 (4.12)
在实际反应中,1mol一氧化碳(CO)与1/2mol氧气(O2)发生反应,生成(1-α)mol二氧化碳(CO2),αmol一氧化碳(CO),α/2mol氧气(O2)。把这样的燃烧称为不完全燃烧。
把反应式(4.12)中的系数α称为电离度。当电离度为α时,因生成物质的总摩尔数为(1+α/2)摩尔,因此各成分摩尔数为
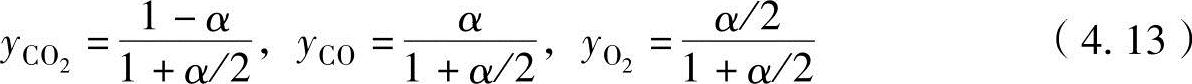
各成分的摩尔数与成分分压成正比,可以表示为
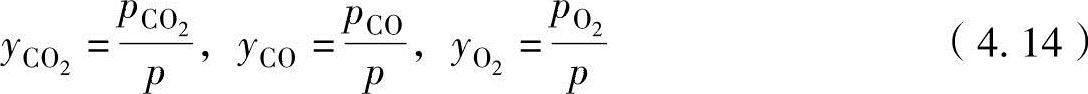
式中,p为燃烧生成物质的压力(总压力)。
燃烧因燃烧生成物质在某种温度以上发生逆反应,并有些物质发生吸热反应,燃烧生成物质的平衡浓度构成可以利用各温度下的平衡系数Kp求得,与此同时,可以利用试错法求出电离度α,进而求出燃烧温度。
(2)平衡浓度构成计算法 举例对氢气和氧气的燃烧反应计算平衡浓度,总反应式为
H2+1/2O2→H2O
理想的燃烧生成物质应为全部水(H2O),但水(H2O)被分解成氢气(H2)、氢原子(H)、羟基(OH)、氧原子(O)、氧气(O2)、超氧化氢(HO2)、氢气(H2)、过氧化氢(H2O2)等。其中,超氧化氢(HO2)、过氧化氢(H2O2)等化学物种量较少,可以忽略不计,因此可以用下述反应式表示氢气和氧气的燃烧反应。
H2+βO2→n1H2O+n2H2+n3H+n4OH+n5O+n6O2 (4.15)
式中,β=1/2,但在这里要分析包括稀薄或浓混合气燃烧的一般状态。求平衡浓度构成实际是求得上述反应式右边的n1~n6摩尔(浓度、分压)数的过程。因未知数为6个,故需要6个公式。
反应物质(未燃混合气)的各原子数构成比m(=氧原子数/氢原子数)为已知数。生成物质的氢气与氧气的原子数如下式,此外摩尔数与成分分压成正比,因此可以表达为
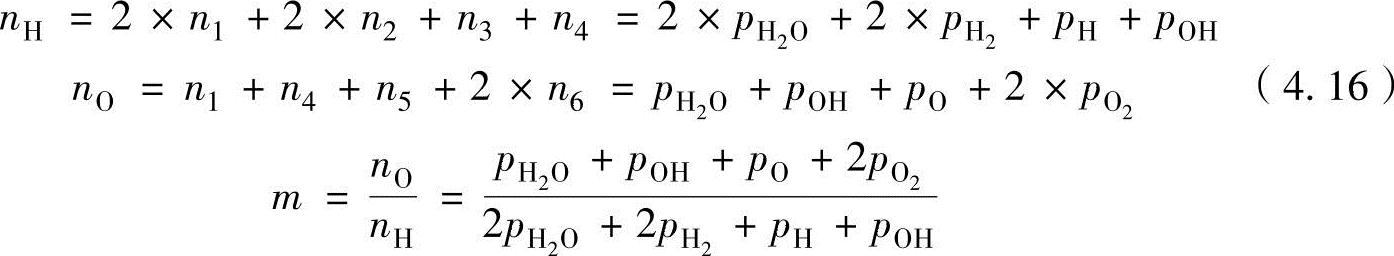
燃烧气体的压力p为成分气体分压之和,可以通过试验获得:

下面对燃烧生成物质水(H2O)、氢气(H2)、氢原子(H)、羟基(OH)、氧原子(O)、氧气(O2)等相关反应式进行分析。在上面已经获取了两个反应物质的原子数构成比m与燃烧气体压力p相关反应式,还需要获取最少4个反应式。
与反应生成物质相关化学反应考虑如下4种化学反应:
①H2+1/2O2↔H2O
②1/2O2+1/2H2↔OH
③1/2H2↔H
④1/2O2↔O
对于各反应的平衡系数Kp,利用平衡系数的定义,以如下公式计算获得。
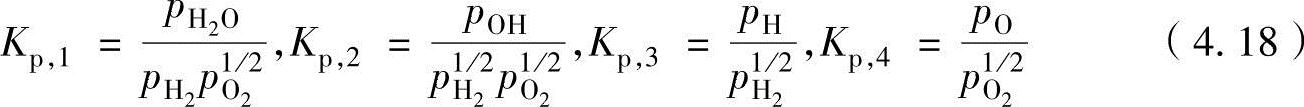
表4-9显示了随温度的4个平衡系数值。如表中所示,在298K(室温)温度下,反应式①的平衡系数Kp,1值为1.1143×1040,其他3个值为小于1。这表示,在室温状态下,仅进行第①种反应。随着温度的上升,其他值也逐步增大。这表示随温度的变化,其平衡状态也发生改变。因此,对于6个未知的各化学物种的摩尔数(分压),可以获取6个反应式并求出。
(3)绝热火焰温度 现在分析不考虑热分解状态的静态燃烧和定压燃烧的绝热火焰温度。燃烧温度的计算,假设如果空气过胜率λ≥1表示完全燃烧,如果λ<1表示燃烧进行直到消耗全部氧气。此外,还假设燃烧效率为1,并没有能量损失。
①不考虑热分解时。静态燃烧:假设气缸内残留废气量mr、燃料供给量mf、实际空气量ma混合压缩后,静态进行燃烧。燃烧前后的状态分别表示为1、2,可以描述能量的平衡为
燃料的化学能+燃料的显热+空气的显热+残留废气的显热=燃烧废气的显热
mfHl+mfuf,1+maua,1+mrur,1=(mf+ma+mr)um,2
在上述平衡式中,uf,1、ua,1、ur,1分别为燃烧前的燃料、空气、残留废气的内部能量(显热);um,2为燃烧后燃烧气体的内部能量,分别以cv,fT1、cv,aT1、cv,rT1、ev,mT2进行计算。由此,上述平衡式可以表示为
mfHl+mfcv,fT1+macv,aT1+mrcv,rT1=(mf+ma+mr)c′c,mT2
mfHl+(mf+ma+mr)cv,mT1=(mf+ma+mr)c′v,mT2
cv,m是燃烧前混合气的平均静态质量热容,为
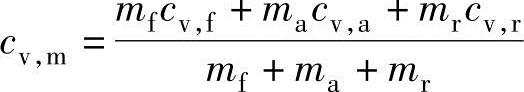
把上式以燃烧温度T2进行整理,可以获得如下公式:
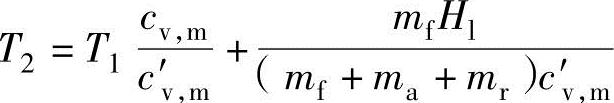
式中,cv,m为燃烧前混合气的静态质量热容;c′v,m为燃烧气体的平均静态质量热容。残留废气量mr定义为残留废气的质量比fr=mr/(mf+ma+mr),在上式的实际空气量ma中代入λmf(A/F)s和mr=fmf[λ(A/F)S+1]/(1-fr)可以获得下式:
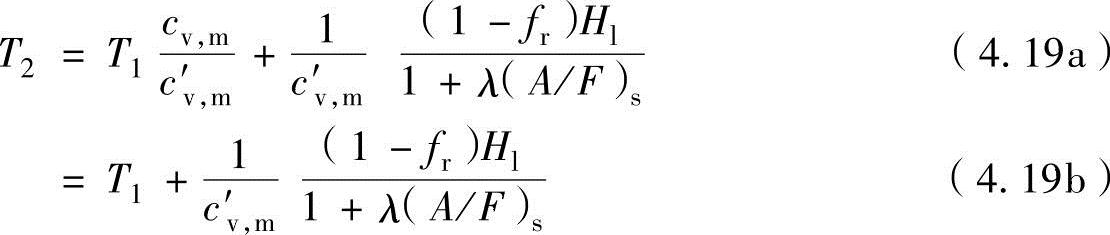
式中,(A/F)s为理论空燃比。另外,可以考虑燃烧前的燃料-空气-残留废气混合气的静态质量热容cv,m与燃烧废气的平均静态质量热容c′v,m几乎相同。因此,在静态燃烧中,燃烧温度T2与空气过量系数λ和残留废气质量分率fr有关。图4-15所示为随当量比变化的燃烧温度。燃烧温度在假设不发生热分解的理论混合比(φ=1)时为最大。
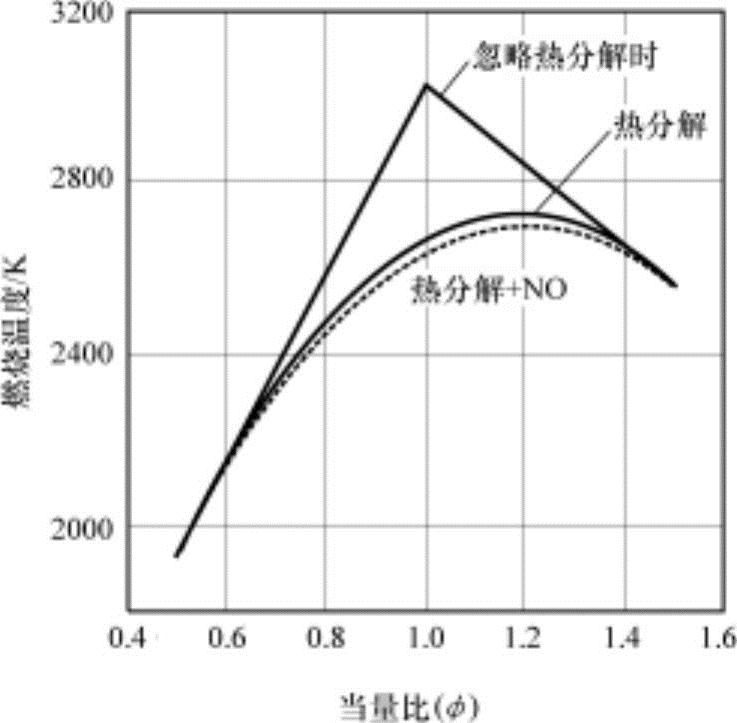
图4-15 随当量比的燃烧温度
燃烧最高压力为当燃烧前后的气体常数分别为R、R′时,从理想气体状态式可以推导出
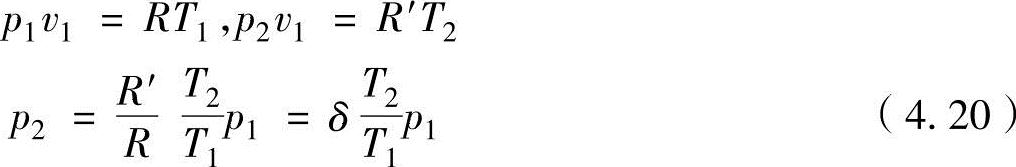
式中,δ=R′/R=M/M′,是燃烧前后的容积比或分子数(摩尔数)比。
定压燃烧:定压燃烧时的燃烧温度是以燃烧气体的平均定压质量热容c′v,m代替平均静态质量热容c′v,m进行计算,与式(4.19b)类似地如下进行表示。
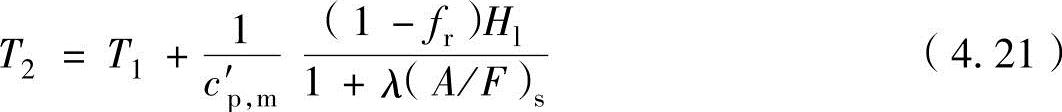
把此公式与静态燃烧式(4.19b)进行比较,可以看出仅燃烧气体的平均静态质量热容c′v,m和平均定压质量热容c′p,m不同。通常,静态质量热容c′v,m小于定压质量热容c′p,m,所以静态燃烧温度高于定压燃烧温度。
柴油机的燃烧为定压燃烧。如果柴油机在压缩行程末期喷射燃料,则可知容积比φ为
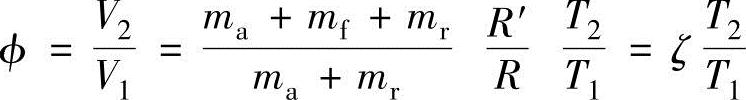
由此可以推导出下述关系式:

式中,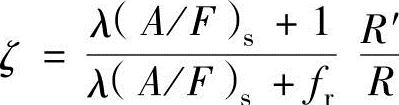 。
。
②考虑热分解时。以空气过量系数λ对碳氢化合物燃料(CxHy)与空气发生燃烧反应,并通过热分解生成一氧化碳(CO)和氢气(H2)的过程进行分析。假设不生成氮氧化物(NO),可以获得下述反应式:
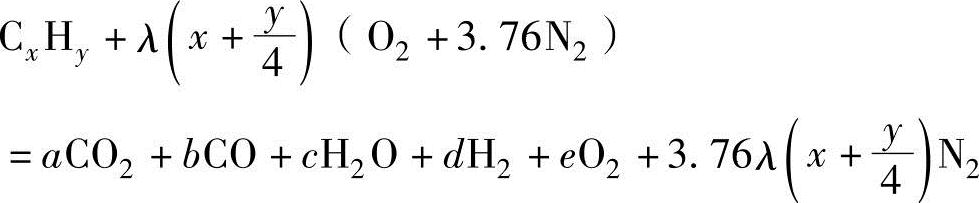
设定空气过量系数λ=1,并以苯(C6H6)为燃料时,可获得下述反应式:
C6H6+7.5(O2+3.76N2) (4.23)
=aCO2+bCO+cH2O+dH2+eO2+28.2N2
等式两边的各原子数相等,因此在生成物质摩尔数a、b、c、d、e之间有下述关系:
C原子数:a+b=6
O原子数:2a+b+c+2e=15 (R1)
H原子数:2c+2d=6
在燃烧生成物质中,氩气(O2)和氮气(N2)为没有参与反应的过剩氧气和氮气,因此对剩余的燃烧生成物质二氧化碳(CO2)、一氧化碳(CO)、水(H2O)和氢气(H2)相关的化学反应式进行分析。在这里对下述两个反应式进行分析:
2CO2→2CO+O2
CO2+H2↔CO+H2O
上述反应式中的平衡系数和平衡系数试验公式为
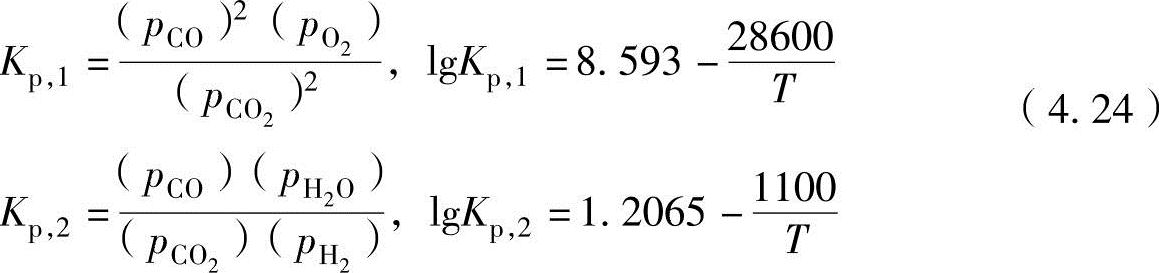
因各成分分压与摩尔数成比例,上式的平衡系数可以表示为
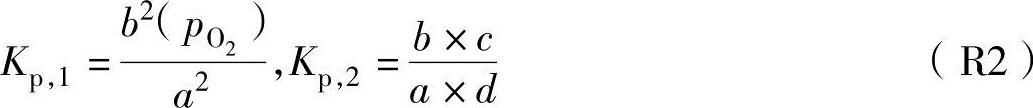
如果燃烧气体压力为p,总摩尔数为X,则氧气分压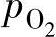 的计算公式为
的计算公式为
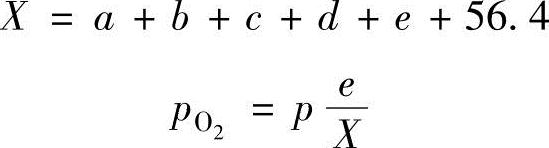
式中,假设汽油机的压缩比为5,燃烧前的混合气温度为100℃,压力为1×105Pa,燃烧后的燃烧气体温度为T,燃烧前的总摩尔数根据式(4.23)的左边得出为36.7,如果燃烧气体的摩尔数增加到X,则燃烧压力p根据式(4.20)可以计算:
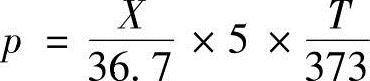
式中,假设燃烧最高温度为T=2500+273=2773K,根据式(4.24)可以计算出:
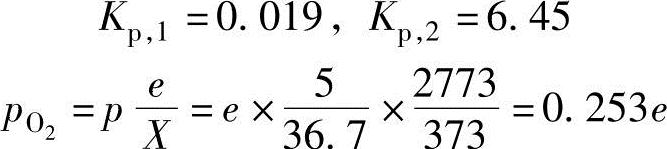
通过Kp,1,Kp,2和 ,可以获得燃烧生成物质的摩尔数关系式为
,可以获得燃烧生成物质的摩尔数关系式为
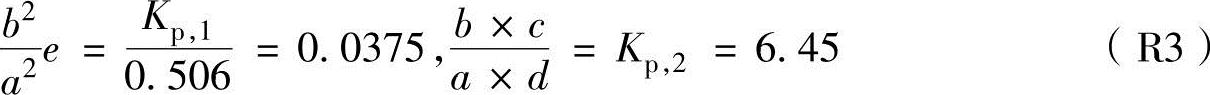
通过解式(R1)和(R3)的联立方程式,可以计算出燃烧生成物质的摩尔数为
a=10.09,b=1.91,c=5.83,d=0.17,e=1.04
如果生成如上成分燃烧气体时,其发热量为1kmol苯蒸气完全燃烧时的发热量减去1.91kmol一氧化碳(CO)和0.17kmol氢气(H2)发热量的值,此热量是每1kmol混合气的热量18786kcal。另外,在绝热压缩过程中可以获得1590kcal/kmol的热量。如上成分构成的燃烧气体温度100~2500℃的平均质量热容为7.346kcal/kmol,则燃烧气体的上升温度ΔT为
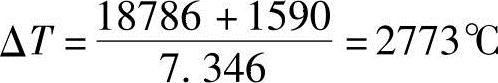
因此,压缩初期温度100℃加上上升的温度值ΔT,最终燃烧气体温度为2873℃(3148K)。因此,最初的燃烧最高温度2500℃(2773K)的设定值有些不够。在此,以最高温度2705℃的假设值重新进行计算,可以获得能满足2705℃的结果。此时燃烧气体的构成如下。
9.01CO2+2.99CO+5.72H2O+0.28H2+1.635O2+56.4N2
在图4-15显示了把上述计算式用多种空气过量系数(或当量比)计算的燃烧温度结果及没有考虑热分解时的状态。如果考虑热分解,最高温度在大于理论混合比的浓混合气状态下获得。以此混合比为基准,混合气稀薄或浓时,燃烧温度会降低,使热分解反应减少,因此在此时不考虑热分解也对燃烧温度没有大的影响。另外,柴油机因在过剩空气下进行燃烧,因此热分解的影响小。图4-15中点线为考虑热分解和氮氧化物(NO)生成时的燃烧温度。
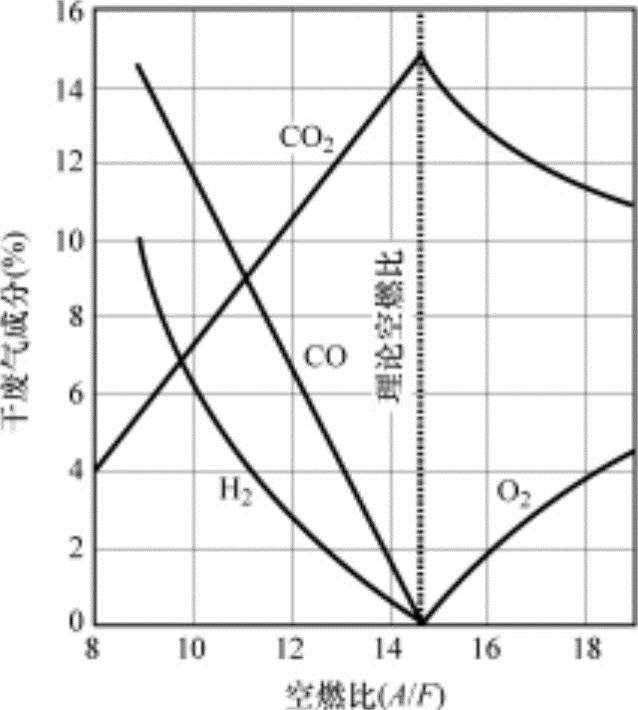
图4-16 随空燃比的干排气中各成分气体构成
如上所述,燃烧气体各成分的摩尔数的计算,一旦决定了反应温度,利用此温度的平衡系数Kp的试验式就可以求出。虽然实际气缸内的燃烧气体温度会时刻发生变化,因反应时间较短,在膨胀过程中的浓度变化可以假设为基本不变,因此设定反应温度为1700K左右,可以获得与实际测量值相似的结果。图4-16显示的是在这样的条件下与空燃比相关燃烧气体构成的计算结果。空燃比比理论混合比浓时,二氧化碳(CO2)的生成量减少,一氧化碳(CO)的生成量增加。在燃烧气体中一氧化碳(CO)越多,总分子数会增加。如果比最高温度混合比浓,一氧化碳(CO)的生成量会增加,因此应补充温度的降低影响,并使其在这两者相平衡的点上达到最高压力。
(4)燃烧温度和压力 燃烧压力在考虑热分解的状态下,温度和分子数增加时,可以通过式(4.20)进行计算。其结果随混合气浓度和压缩比的曲线如图4-17所示。最高压力在比最高温度更为浓的混合比上获得。在一定容积下,混合比相同时,压力和温度随压缩比(或分子数)的增大而增加。
如果压缩比降低,燃烧温度也会降低,因此热分解会减少,如图4-17所示出现最大压力、最高温度的点接近理论混合比。另外,在做功过程中随着温度的降低,热分解会减少,做功过程末期的温度和压力在理论混合比上达到最大。燃烧最高温度是随着压缩比的增加而增大,但做功过程末期的温度与此相反,这一点应该需要关注。另外,做功过程末期的压力不受压缩比的影响。平均有效压力主要是依赖做功过程中的平均压力,最大平均有效压力出现在最高燃烧压力的过浓混合比与理论混合比的中间。这与最大转矩出现在比理论混合比浓10%~20%的混合比处的事实相吻合。
上述说明均为理论计算结果。实际上,因存在不完全燃烧、热损失等,因此最高温度会小于理论值。燃烧最高温度会出现在很短的时间内,要正确进行测量难度很大,通过光谱线反转法、光电管、白金线电阻、音速等可以进行相似测量。汽油机的最高温度为2000~2500℃。
有关内燃机学的文章

它并没有消失,世界上的任何事物都不会消失。燃尽的煤也绝没有消失。这个伴随着热量释放的分解过程,被称为燃烧。因此,只有保持空气畅通,才能使炉中的火持续燃烧。火炉中这种释放大量热量的猛烈燃烧并不是煤或碳唯一的消耗方式。腐烂引起的燃烧也会释放热量,但一般不易察觉,这很好解释。无论是一截腐烂的老树干,一个发热的稻草堆,还是一块熊熊燃烧的木柴,无一不反映了不同速度的燃烧。......
2023-10-21

燃烧过程初期,如图6.40所示,电热塞点火后,偏心轴转角转过5°后电热塞附近的火焰核心都已经形成且形成多个火核。而随着燃烧过程的进行,在上止点前20°偏心轴转角时,电热塞附近的火焰已开始大面积传播且NO浓度急剧增加,如图6.41所示。缸内的平均压力变化过程如图6.45所示,缸内压力与表征燃烧剧烈程度的中间产物的变化相关,因为燃烧反应的剧烈程度在上止点后达到最大值,所以缸内压力的峰值在上止点后出现最大值。......
2023-06-23

位于葡萄糖环2、3、6位置上的三个碳原子都与羟基相连,与碳2、碳3相连的是仲羟基,与碳6相连的则是伯羟基。伯、仲羟基具有不同的化学反应能力。黏胶纤维的中间体、醋酯纤维、硝化纤维都是纤维素通过特定的化学反应获得的纤维素的衍生物,而Lyocell纤维的抗原纤化处理则是交联剂与纤维素上的羟基发生化学反应的结果。......
2023-06-25

阴燃是在燃烧条件不充分的情况下发生的缓慢燃烧,是固体物质特有的燃烧形式。扩散燃烧的特点是扩散火焰不运动,也不发生回火现象,可燃气体与气体助燃物(如氧气)的混合在可燃气体喷口进行。许多火灾爆炸事故都是由预混燃烧引起的,如制气系统检修前不进行置换就烧焊,燃气系统开车前不进行吹扫就点火,用气系统产生负压“回火”或漏气未被发现而动火等,往往形成预混燃烧,极易造成设备损坏和人员伤亡事故。......
2023-10-01

开放式为在1个燃烧室内直接喷射燃油,因此称为直接喷射式。分离式是分别设计有主燃烧室和副燃烧室,主副燃烧室通过小孔连接的形状,把燃油喷射在副燃烧室内,因此称为间接喷射式,分为预燃烧室类型和涡流室类型等。这仅适用于分离式燃烧室发动机上。预热塞设置在预燃烧室内。燃油以相对较低的压力通过轴针式喷油器向设置在预燃烧室中央的挡板喷射。......
2023-06-28

这些燃烧室的压力损失系数分别为18、25、35左右。燃烧室内火焰温度超过2000K,因此提高燃烧室火焰筒的耐久性和同时尽可能做到涡轮进口燃气温度的分布,以防止涡轮的早期恶化。火焰筒的寿命主要受到因高温氧化造成的板厚减小和因反复加热造成的低频疲劳损坏的影响。火焰筒的所有部分设计温度基本上不会超过许可温度1100K。......
2023-06-28

固体燃料受热后,首先是所含水分的气化,约110℃时物理水全部逸出,当燃料达到一定温度时便开始分解,放出挥发分,剩下焦炭,这一过程称为干馏。其中雾化阶段是整个燃烧过程的关键。(三)气体燃料燃烧过程1.气体燃料燃烧的基本知识着火浓度范围气体燃料与空气的比例,必须在一定的范围内才能进行燃烧,这一范围叫着火浓度范围,或叫着火浓度极限。......
2023-10-11

从图6.46可看出,点火位置布置方案1和2的电热塞处于燃烧室前部的单向流区,方案3的电热塞处于燃烧室前部的滚流区。图6.46不同电热塞布置方案的流场图6.47和图6.48给出了方案2和方案3燃烧过程中的温度场变化过程,方案1的温度场已经在图6.41和图6.43中给出。三种火花塞布置方案的燃烧传播已有明显的不同,随着燃烧过程的进行,火焰从燃烧室前侧向后侧迅速发展。......
2023-06-23
相关推荐