【摘要】:已知H2SO4的质量分数为96%(ω),1L该H2SO4中含纯H2SO4的量为:答:该H2SO4换算为物质的量浓度:3.欲配制(2+3)硝酸溶液1000mL,应取试剂浓硝酸和水各多少毫升?根据上式,计算滴定管在10.10mL处的实际容量:V20=10.10mL=10.12mL校正值:V校=mL=0.02mL其他各点计算方法同上。称取草酸钠6.700克,溶解后定容至1L,则为多少mol/L?
1.某硫酸溶液的质量浓度为0.00523g/mL换算为物质的量浓度: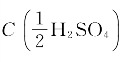 等于多少摩尔每升(mol/L)?
等于多少摩尔每升(mol/L)?
解:H2SO4的质量浓度为0.00523g/mL,即5.23g/L。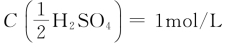 时每升含H2SO4 49.04g,现在H2SO4为5.23g/L,其浓度应为:
时每升含H2SO4 49.04g,现在H2SO4为5.23g/L,其浓度应为:
答:换算为物质的量浓度:
2.已知H2SO4的密度为1.84g/mL,质量分数为96%(ω),求其物质的量浓度:(1)C(H2SO4)等于多少摩尔每升(mol/L)?(2)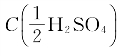 等于多少摩尔每升(mol/L)?
等于多少摩尔每升(mol/L)?
解:H2SO4的相对分子质量为98.07。
已知H2SO4的质量分数为96%(ω),1L该H2SO4中含纯H2SO4的量为:
答:该H2SO4换算为物质的量浓度:
3.欲配制(2+3)硝酸溶液1000mL,应取试剂浓硝酸和水各多少毫升?
解:(2+3)硝酸溶液表示将2份体积的试剂硝酸加至3份体积的水中,总份数为5,配制硝酸溶液的总体积为1000mL,每份的体积为:
则硝酸的加入量为:2×200mL=400mL
水的加入量为:3×200mL=600mL
答:应取试剂浓硝酸400mL,加入600mL水。
4.将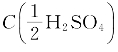 =0.2mol/L溶液换算为质量浓度(g/mL)。
=0.2mol/L溶液换算为质量浓度(g/mL)。
解: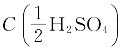 =0.2mol/L的溶液中每升含H2SO4;
=0.2mol/L的溶液中每升含H2SO4;
0.2×49.04=9.808g/L=0.009808g/mL
答:该硫酸的质量浓度为0.009808g/mL。
5.今有6mol/L(以其化学式为基本单位,下同)和0.5mol/L HCl溶液,利用这两种溶液配成550mL 2mol/L HCl溶液,问上述两种溶液各取多少毫升?
解:利用C1V1+C2V2=C3V3计算
设取6mol/L HCl体积为V1 mL,0.5mol/L HCl的体积即为(550-V1)mL
6V1+0.5×(550-V1)=2×550
6V1+550×0.5-0.5V1=1100
5.5V1=1100-275=825
V1=150mL
V2=550-150=400mL
答:6mol/L HCl取150mL,0.5mol/L HCl取400mL。
6.天平梁右臂长75.94mm,左臂长76.00mm,将坩埚放在左盘称量时质量为8.3124g,求坩埚的真实质量。
解:坩埚放在左盘称量时,反应出的质量实际上是右盘中砝码的质量,故坩埚的真实质量应为:
答:坩埚的真实质量为8.3058g。
7.用零点为0的天平称量坩埚,在天平左盘上放置坩埚,在天平右盘上加砝码5.37g显得过重,而加5.35g显得太轻,当砝码重为5.37g并将游码放在距分度尺零点左方8.4mg处时恰好达到平衡,问坩埚质量是多少?
解:游码放在零点左方时,相当于增加了坩埚的质量,故坩埚的质量应为从右盘砝码的质量中减去平衡时游码处相当的质量:
5.37-0.0084=5.3616g
答:坩埚的质量为5.3616g。
8.将pH=13的强碱溶液与pH=1的强酸溶液等体积混合,计算混合后溶液的pH值。
解:pH=13的碱溶液:pOH=14-13=1
[OH-]=10-1
pH=1的强酸溶液:[H+]=10-1
由于[H+]和[OH-]相等,混合后正好中和生成H2O,故混合后溶液的pH应为7。
答:混合后溶液的pH值为7。
9.在25℃时检定一支滴定管,数据列于下表,请计算各点校正至20℃时的校正值。
已知当空气密度为0.0012g/cm3,玻璃的体积膨胀系数为25×10-6/℃及25℃时,1mL水的质量为0.99611g。
25℃时纯水的密度:ρw=0.997041g/cm3。
解:按《常用玻璃量器检定规程》JJG196—2006的规定,用称量法检定量器时的计算公式为:
式中 V20——量器在标准温度20℃时的实际容积,mL;
V0——量器的标称容量,mL;
m0——称得纯水的质量,g;
m——从表中查得的质量值,g;
ρw——t℃时的纯水的密度值(在一般要求情况下,ρw可视为1g/cm3)。
根据上式,计算滴定管在10.10mL处的实际容量:V20=10.10mL
=10.12mL
校正值:V校=(10.12-10.10)mL=0.02mL
其他各点计算方法同上。
10.已知某盐水溶液中含氯化钠80g/L,问该溶液中氯化钠的物质的量浓度为多少?
解:氯化钠(NaCl)的相对分子质量为58.44,即该氯化钠溶液1L中含58.44g为1mol。现每升含NaCl 80g,应为:
答:该溶液中氯化钠的物质的量浓度:
C(NaCl)=1.3689mol/L
11.称取K2CO31.0000g溶于水,用0.4000mol/L HCl滴定用去35.00mL,问试样中纯K2CO3含量及百分含量。已知M(K2CO3)=138。
解:∵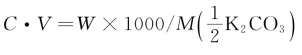
百分含量=(0.966/1.0000)×100%=96.6%
答:试样中纯K2CO3含量为0.966g,百分含量为96.6%。
12.取出在10℃时饱和的硝酸钠溶液50g,把它蒸干,得到硝酸钠晶体22.3g,问10℃时NaNO3在水中的溶解度。
解:设50g溶液中含H2O为Xg
X+22.3=50
X=50-22.3=27.7
设溶解度为Y
则 27.7∶22.3=100∶Y
Y=100×22.3/27.7=80.5g
答:溶解度为80.5g。
13.某水样中C(Ca2+)、C(Mg2+)的浓度分别为2.50mg/L和1.60mg/L,计算该水样的硬度(以碳酸钙计,原子量Ca=40,Mg=24,O=16,C=12)。
解:C(Ca2+)=2.50/40=0.0625mmol/L
C(Mg2+)=1.6/24=0.0667mmol/L
C(Ca2+)+C(Mg2+)=0.0625+0.0667
=0.129mmol/L
0.129mmol/L×100mg/mmol(CaCO3)
=12.9mg/L(CaCO3)
答:该水样的硬度为12.9mg/L(CaCO3)。
14.(1)欲配制 =0.1000mol/L的标准溶液500mL,应称取KMnO4多少克?
=0.1000mol/L的标准溶液500mL,应称取KMnO4多少克?
(2)称取草酸钠6.700克,溶解后定容至1L,则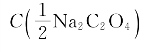 为多少mol/L?
为多少mol/L?
(3)用此草酸钠溶液25.00mL标定(1)中的高锰酸钾溶液,标定时消耗高锰酸钾25.10mL,求此高锰酸钾标准溶液的浓度?
解:(1)已知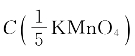 =0.1mol/L V=500mL
=0.1mol/L V=500mL 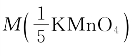 =31.61g/mol
=31.61g/mol
(2)已知m(Na2C2O4)=6.700g V(Na2C2O4)=1L 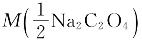 =67.00g/mol
=67.00g/mol
则 =m/V·M=0.1000mol/L
=m/V·M=0.1000mol/L
(3)已知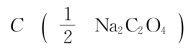 =0.1000mol/L V(Na2C2O4)=25.00mL
=0.1000mol/L V(Na2C2O4)=25.00mL
V(KMnO4)=25.10mL
则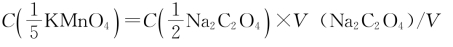 (KMnO4)=0.0996mol/L
(KMnO4)=0.0996mol/L
答:(1)应称取KMnO4 1.6g
(2) 为0.1000mol/L
为0.1000mol/L
(3)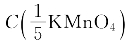 为0.0996mol/L
为0.0996mol/L
15.用市售的36%(m/m %)的浓HCl,配制C(HCl)=1.0mol/L盐酸标准溶液1000mL,如何配制及标定?(写出具体过程)
解:已知X%=36,ρHCl=1.18g/mL,MHCl=36.50g/mol,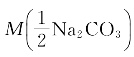 =53.00g/mol
=53.00g/mol
C(HCl)=1.0mol/L
则m(HCl)=1.0×36.50×1000/1000=36.50g
V(HCl)=36.50/(1.18×36%)=85.8≈86mL
加水量=1000-86=914mL
配制:量取86mL盐酸(ρHCl=1.18g/mL)加入914mL蒸馏水中,混合均匀。
标定:精确称取经180℃烘干2h,并于干燥器内冷却的基准无水Na2CO3(0.1~0.15g)4份,分别放入250mL三角瓶中,各加入100mL无CO2蒸馏水,加入2~4滴甲基橙指示剂。用配制好的1.0mol/L的盐酸滴定至出现淡橘红色为止。记录用量。同时做空白实验。用下列公式计算出盐酸标准溶液准确浓度:
CB=CA·VA/VB
16.欲配制0.5000mol/L的盐酸,现有0.4920mol/L的盐酸1000mL,问需要加入1.0210mol/L的盐酸多少毫升?
解:设需要加入1.0210mol/L的盐酸XmL
0.4920×1000+1.0210X=0.5000×(1000+X)
X=15.36mL
答:需要加入15.36mL。

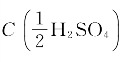 等于多少摩尔每升(mol/L)?
等于多少摩尔每升(mol/L)?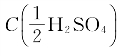 等于多少摩尔每升(mol/L)?
等于多少摩尔每升(mol/L)?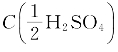 =0.2mol/L溶液换算为质量浓度(g/mL)。
=0.2mol/L溶液换算为质量浓度(g/mL)。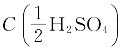 =0.2mol/L的溶液中每升含H
=0.2mol/L的溶液中每升含H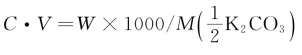
 =0.1000mol/L的
=0.1000mol/L的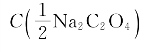 为多少mol/L?
为多少mol/L?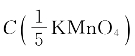 =0.1mol/L V=500mL
=0.1mol/L V=500mL 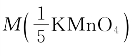 =31.61g/mol
=31.61g/mol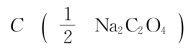 =0.1000mol/L V(Na
=0.1000mol/L V(Na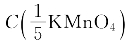 为0.0996mol/L
为0.0996mol/L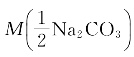 =53.00g/mol
=53.00g/mol






相关推荐