实验一基因工程菌的发酵工艺1.实验目的了解基因工程菌发酵的一般工艺以及发酵过程的参数控制。应用基因工程技术改造的工程菌在发酵表达时,诱导起始菌浓度、诱导物浓度、诱导时间等对其也会产生影响。在火焰保护下拔下瓶塞,将菌种液小心迅速倒入发酵罐,盖上接种盖并拧紧、灭火焰,用酒精棉擦洗接种口周围。......
2023-12-07
(一)干扰素发酵工艺过程
干扰素α2b发酵工艺流程如图2-4-1所示。
(1)菌种制备 取-70℃下保存的甘油管菌种(工作种子批),于室温下融化。然后接入摇瓶,30℃、pH7.0、250 r/min活化培养(18±2)h后,进行吸光度测定和发酵液杂菌检查。
(2)种子罐培养 将已活化的菌种接入装有30 L培养基的种子罐中,接种量为10%,培养温度为30℃,pH为7.0。级联调节通气量和搅拌转速,控制溶氧为30%,培养3~4 h,当吸光度值达到4.0以上时,转入发酵罐中,进行二级放大培养,同时将发酵液取样鉴定。
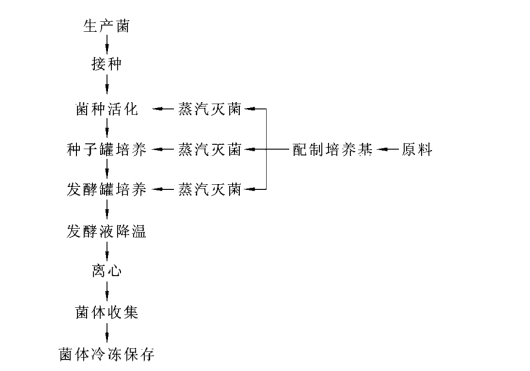
图2-4-1 干扰素α2b发酵工艺流程
(3)发酵罐培养 将种子液通入装有300 L培养基的发酵罐中,接种量为10%,培养温度为30℃,pH为7.0。级联调节通气量和搅拌转速,控制溶氧为30%,培养4h。然后控制培养温度为20℃,pH为6.0,溶氧为60%,继续培养5~6.5 h。同时进行发酵液杂菌检查,当吸光度值达8.0~10.0后,用5℃冷却水快速降温至15℃以下,以延缓细胞衰老。或者将发酵液转入收集罐中,加入冰块使温度迅速降至10℃以下。
(4)菌体收集 将已降温的发酵液转入连续流离心机,16000 r/min离心收集。进行干扰素含量、菌体蛋白含量、菌体干燥失重、质粒结构一致性、质粒稳定性等项目的检测。菌体于-20℃冰柜中保存时,不得超过12个月。每保存3个月,检查一次活性。
(二)干扰素发酵工艺过程控制要点
在发酵生产工艺中,工程菌的生长和干扰素基因的表达时间不完全同步,可采用两段培养的策略进行过程控制。发酵工艺过程控制要点如下。
(1)培养基 使用不同的碳源和氮源对菌体生长和外源基因表达有较大影响。常用的碳源有葡萄糖、甘油、乳糖、甘露糖、果糖等。常用的氮源有酵母提取物、蛋白胨、酪蛋白水解物、玉米浆和氨水、硫酸铵、硝酸铵、氯化铵等。
发酵培养基配料(参考):1%蛋白胨、0.5%酵母提取物、0.01%氯化铵、0.05%氯化钠、0.6%磷酸氢二钠、0.001%氯化钙、0.3%磷酸二氢钾、0.01%硫酸镁、0.4%葡萄糖、50 mg/mL氨苄青霉素、少量消泡剂。
(2)溶氧控制 分别在生长阶段和生产阶段采用各自最佳溶氧浓度,以提高干扰素的发酵水平。通过级联调节通气量和搅拌转速得以实现。
(3)温度控制 工程菌生长最适温度与产物形成最适温度是不同的。产物合成温度控制在20℃可以有效防止α-干扰素的降解,而其最佳生长温度则为30℃。质粒的稳定性随温度的升高而迅速下降,因此在培养后期降温可以减少目标产物的降解量,增加质粒的稳定性。
(4)pH 发酵过程中,pH的变化由工程菌的代谢、培养基的组成和发酵条件所决定。α-干扰素的等电点在6.0附近,在弱酸性条件下稳定,能耐受pH为2.5的酸性环境。因此可在发酵后期降低pH,从而造成大量蛋白酶失活,减少α-干扰素的水解,提高干扰素的积累量。
1.根据所选工程菌株,配制培养基。
2.确定详细的发酵工艺,包括通气量、二阶段发酵温度、最适生长温度和pH、最适生产温度和pH、发酵时间、补料及消泡剂等,并进行操作。
有关生物制药工艺(第2版)的文章

实验一基因工程菌的发酵工艺1.实验目的了解基因工程菌发酵的一般工艺以及发酵过程的参数控制。应用基因工程技术改造的工程菌在发酵表达时,诱导起始菌浓度、诱导物浓度、诱导时间等对其也会产生影响。在火焰保护下拔下瓶塞,将菌种液小心迅速倒入发酵罐,盖上接种盖并拧紧、灭火焰,用酒精棉擦洗接种口周围。......
2023-12-07

为了便于使所有引脚在0.5 min内形成连接,引线框架表面要包覆一层锡铅共晶焊料。考虑环境方面的因素,这层包覆材料已经由共晶锡铜合金或纯锡代替。然而,这些无铅的锡基涂层会引起锡须的自发生长。这些锡须可能会造成引脚间的短路,引起目前的一个可靠性问题。图1.4硅芯片和引线框架之间的引线键合示意图1.5引脚和基板之间的焊料接头示意......
2023-06-20

与普通TIG焊相比,由于热丝TIG焊显著提高了热输入,适于焊接中等厚度的焊接结构,又保持了TIG焊具有高质量焊缝的特点。热丝TIG焊的熔敷速度可比普通TIG焊提高两倍,从而使焊接速度增加3~5倍,提高生产率。图7-50 钢的钨极氩弧焊熔敷速度比较3.TOPTIG焊TOPTIG焊原理 TOPTIG是TIG焊接工艺的一种。......
2023-07-02

子任务三酱油发酵与提取酱油的发酵是利用曲中米曲霉分泌的多种酶将蛋白质和淀粉等高分子物质分解成氨基酸和糖,形成酱油的色、香、味、体。加强发酵管理,定期抽样检验酱醪质量直至酱醪成熟。发酵周期为3个月。一贯型酱醅发酵温度始终保持于42℃左右。低温型酱醅发酵温度在15℃维持30天。目的是抑制乳酸菌的生长繁殖,同时保持酱醅pH=7左右,使碱性蛋白酶能充分发挥作用,有利于谷氨酸生成和提高蛋白质利用率。......
2023-12-07

燃烧技术的改善以燃烧控制方式为主体,此方法主要是平衡发动机的输出功率、燃油消耗量、其他废气排放性能。均质压燃 在均质预混合压缩着火技术方面,为了提高柴油机的燃油效率,同时降低炭烟颗粒与NOx的生成量,正在积极研究利用汽油机预混合燃烧方式的应用技术。为此,需要能提高燃烧室内空气流动状态和燃油喷射率,以及精密控制喷雾状态的高压燃油喷射技术。......
2023-06-28

基于 GPS 技术的 PMU在电力系统中主要用于数据测量,以提高电力系统状态估计的精度及进行相关的保护、监测和控制研究。在实际监测活动中,经PMU测得的电压幅值和相角精确系数大大提高。图8-17电力系统同步相量测量系统体系结构PMU 的基本功能:通过 GPS 信号同步测量和分析电流、电压数据,提供相位、幅值和频率信息。· 典型装置举例NSR-3710 同步相量测量装置为标准 19 英寸宽、4U 高机箱,其前面板如图8-18 所示。......
2023-06-28

子任务三葡萄酒的发酵葡萄酒的酿造是利用有益酵母菌将葡萄汁中的糖类经酒精发酵生成酒精,同时产生乙醛、甘油、醋酸、乳酸和高级醇等副产物,再在陈酿澄清过程中经酯化、氧化、沉淀等作用,赋予葡萄酒特有风味,形成酒液澄清、色泽鲜美、醇和芳香的产品的过程。......
2023-12-07

大焊丝伸出长度意味着提高电阻热,采用高电弧电压、大电流的结果是提高其熔敷效率和保持焊缝宽度不会因提速而变窄,并在大电流的MAG焊禁区开创了新的应用领域。......
2023-06-26
相关推荐