胆红素存在于人及多种动物胆汁中,是胆结石的主要成分之一,乳牛及狗胆汁中含量最高,猪及人胆汁次之,牛胆汁更次之。根据胆红素的性质,以动物胆汁为原料,采用生物化学制药技术制备胆红素。图1-7-7胆红素的生产工艺流程三、实训器材和试剂1.原料猪胆汁。评价所提取的胆红素的质量。......
2023-06-24
一、实训目标
(1)了解胃蛋白酶的物理化学性质及其与胃蛋白酶生产之间的关系。
(2)掌握从猪胃黏膜中分离提取胃蛋白酶的工艺和方法。
二、实训原理
胃蛋白酶(pepsin)是脊椎动物胃液中最主要的蛋白酶,由胃部中的胃黏膜主细胞所分泌。胃蛋白酶的结晶于1930年获得,是第二种结晶酶。其结晶呈针状或板状,经电泳可分出四个组分。其组成元素除N、C、H、O、S外,还有P、Cl。相对分子质量为34500。猪胃蛋白酶的一级结构已被阐明。
胃蛋白酶于1864年最早载入英国药典,随后世界多个国家相继将之载入药典,作为优良的消化药广泛使用。主要剂型有含葡萄糖胃蛋白酶散剂、胃蛋白酶片、与胰酶和淀粉酶配伍制成的多酶片。其消化力以含0.2%~0.4%盐酸时最强,故常与稀盐酸合用。临床上常用于治疗缺乏胃蛋白酶或因消化机能减退而引起的消化不良、食欲缺乏等。
干燥胃蛋白酶较稳定,100℃加热10 min无明显失活。在水中,于70℃以上或pH6.2以上开始失活,pH8.0以上则呈不可逆性失活。在酸性溶液中较稳定,但在2 mol/L以上的盐酸中也会慢慢失活。
胃蛋白酶能水解大多数天然蛋白质,能水解的肽键的范围相当广,尤其容易水解芳香族氨基酸残基或具有大侧链的疏水性氨基酸残基形成的肽键,对羧基末端或氨基末端的肽键也容易水解。胃蛋白酶对蛋白质的水解不彻底,其产物有胨、肽和氨基酸。
胃蛋白酶的最适温度为37~40℃。生产上用作催化剂时常选用45℃,我国药典规定在(37±0.5)℃测定其活力。胃蛋白酶的抑制剂有胃蛋白酶抑制素、蛔虫胃蛋白酶抑制剂及胃黏膜的硫酸化糖蛋白等。
药用胃蛋白酶是胃液中多种蛋白水解酶的混合物,含有胃蛋白酶、组织蛋白酶和胶原酶等。药用胃蛋白酶为粗酶制剂,外观为淡黄色粉末,具有肉类特殊气味及微酸味,吸湿性强,易溶于水,水溶液呈酸性。可溶于70%乙醇和pH为4的20%乙醇,难溶于氯仿、乙醚等有机溶剂,在冷的磺基水杨酸中不沉淀,加热后可产生沉淀。最适pH为1.5~2.0,等电点为1.0。
胃蛋白酶多用生物化学提取技术从猪胃黏膜中分离提取。其工艺路线如下:
三、实训器材和试剂
1.器材
真空干燥箱、夹层蒸汽锅、电炉、搅拌器、浓缩罐、球磨机、80~100目筛子、纱布、猪胃黏膜、722型可见分光光度计。
2.试剂
盐酸、丙酮、氯仿或乙醚。
四、实训方法和步骤
1.胃蛋白酶的分离提取
(1)原材料的选取 选取直径10 cm、深2~3 mm的胃基底部黏膜20 kg(每个猪胃平均剥取黏膜100 g左右)。
(2)激活、提取 在夹层蒸汽锅内预先加水10 L及化学纯盐酸360~400 mL,搅匀,加热至50℃时,在搅拌下加入猪胃黏膜20 kg,快速搅拌使酸度均匀,保持45~48℃消化3~4h,得自溶液。过滤除去未消化的组织蛋白,收集滤液。
(3)脱脂、去杂 将所得滤液降温至30℃以下,加入15%~20%氯仿或乙醚,搅匀后静置24~48h(氯仿在室温,乙醚在30℃以下)使杂质沉淀。过滤弃杂质,得脱脂清酶液。
(4)浓缩、干燥 取脱脂清酶液,在40℃以下减压浓缩至原体积的1/4左右后,真空干燥。干品球磨过80~100目筛,即得胃蛋白酶粉。
2.质量检测
(1)质量标准《中国药典》规定:本品系自猪、羊或牛的胃黏膜中提取的胃蛋白酶;1 g胃蛋白酶活力不得少于3800单位;在100℃干燥4 h,失重不得过5.0%。
(2)酶活力测定
①对照品溶液的制备 精密称取酪氨酸对照品适量,加盐酸(取1 mol/L盐酸65 mL,加水至1000 mL)溶解并定量稀释成0.5 mg/mL的溶液。
②供试品溶液的制备 取本品适量,精密称定,加上述盐酸溶解并定量稀释成0.2~0.4 U/mL的溶液。
测定方法:取试管6支,其中3支各精密加入对照品溶液1 mL,另3支各精密加入供试品溶液1 mL,置(37±0.5)℃水浴中,保温5 min,精密加入预热至(37±0.5)℃的血红蛋白试液5 mL,摇匀,并准确计时,在(37±0.5)℃水浴中反应10 min。立即精密加入5%三氯乙酸溶液5 mL,摇匀,过滤,取滤液备用。另取试管2支,各精密加入血红蛋白试液5 mL,置(37±0.5)℃水浴中,保温10 min,再精密加入5%三氯乙酸5 mL,其中1支加供试品溶液1 mL,另1支加0.065 mol/L盐酸1 mL,摇匀,过滤,取续滤液,分别作为供试品和对照品的空白对照。照紫外分光光度法(《中国药典》2010年版二部附录ⅣA),在275 nm波长处测吸收度,算出平均值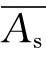 和
和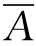 ,按下式计算:
,按下式计算:
测定方法:取试管6支,其中3支各精密加入对照品溶液1 mL,另3支各精密加入供试品溶液1 mL,置(37±0.5)℃水浴中,保温5 min,精密加入预热至(37±0.5)℃的血红蛋白试液5 mL,摇匀,并准确计时,在(37±0.5)℃水浴中反应10 min。立即精密加入5%三氯乙酸溶液5 mL,摇匀,过滤,取滤液备用。另取试管2支,各精密加入血红蛋白试液5 mL,置(37±0.5)℃水浴中,保温10 min,再精密加入5%三氯乙酸5 mL,其中1支加供试品溶液1 mL,另1支加0.065 mol/L盐酸1 mL,摇匀,过滤,取续滤液,分别作为供试品和对照品的空白对照。照紫外分光光度法(《中国药典》2010年版二部附录ⅣA),在275 nm波长处测吸收度,算出平均值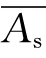 和
和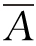 ,按下式计算:
,按下式计算:
式中: 为对照品的平均吸光度;
为对照品的平均吸光度;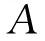 为供试品的平均吸光度;ms为对照品溶液1 mL中含酪氨酸的量,μg;m为供试品取样量,g;n为供试品稀释倍数。
为供试品的平均吸光度;ms为对照品溶液1 mL中含酪氨酸的量,μg;m为供试品取样量,g;n为供试品稀释倍数。
在上述条件下,每分钟能催化水解血红蛋白生成1μmol酪氨酸的量,为1个蛋白酶活力单位(U)。
五、实训报告
写出实训报告,要求内容真实、完整。
式中: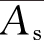 为对照品的平均吸光度;
为对照品的平均吸光度; 为供试品的平均吸光度;ms为对照品溶液1 mL中含酪氨酸的量,μg;m为供试品取样量,g;n为供试品稀释倍数。
为供试品的平均吸光度;ms为对照品溶液1 mL中含酪氨酸的量,μg;m为供试品取样量,g;n为供试品稀释倍数。
在上述条件下,每分钟能催化水解血红蛋白生成1μmol酪氨酸的量,为1个蛋白酶活力单位(U)。
五、实训报告
写出实训报告,要求内容真实、完整。
有关生物制药工艺(第2版)的文章

胆红素存在于人及多种动物胆汁中,是胆结石的主要成分之一,乳牛及狗胆汁中含量最高,猪及人胆汁次之,牛胆汁更次之。根据胆红素的性质,以动物胆汁为原料,采用生物化学制药技术制备胆红素。图1-7-7胆红素的生产工艺流程三、实训器材和试剂1.原料猪胆汁。评价所提取的胆红素的质量。......
2023-06-24

掌握头孢霉素发酵生产的一般工艺流程、提取和精制方法。头孢霉素发酵生产工艺路线如图1-2-12所示。发酵过程中,及时测定菌丝浓度、还原糖浓度、头孢霉素C浓度。表1-2-4荧光分光光度法在头孢霉素类药物含量测定上的应用图1-2-12头孢霉素发酵生产工艺路线三、实训器材和试剂1.菌种顶头孢霉。......
2023-06-24

图1-4-6胃膜素的生产工艺流程三、实训器材和试剂1.原料猪胃黏膜。含量测定胃膜素目前还没有统一的含量测定标准,一般通过测定样品黏度、总氮量及还原性物质来控制其质量。黏度反映了胃膜素分子的完整性。胃膜素的奥氏黏度不低于1.3。......
2023-06-24

国内外大批量生产L-缬氨酸主要采用微生物发酵技术。L-缬氨酸的离子交换提取一般用732树脂,该种强酸性阳离子交换树脂可选择性地从发酵液中吸附L-缬氨酸,从而将L-缬氨酸和其他氨基酸分离。L-缬氨酸发酵生产工艺如图1-3-7所示。......
2023-06-24

本项目的任务目标是在Word中运用武昌工学院本科生毕业论文(设计)撰写规范,对一篇本科毕业论文进行排版,排版后的论文第一章如图2.1所示。根据武昌工学院本科毕业论文基本规范,具体排版格式要求如下。页眉靠左对齐,显示内容为“本科毕业论文(设计)专用”,字体为宋体、小五号。要求自动生成目录。......
2023-10-31

最初,用棒状杆菌发酵制得肌苷酸,再以化学法加压脱掉磷酸得到肌苷,其工艺复杂,产量低,成本高。图1-8-5直接发酵法生产肌苷的工艺路线三、实训器材和试剂1.器材冰箱、恒温培养箱、摇床、发酵罐、灭菌锅等。灭菌前pH为7,用200 mL三角瓶装50 mL培养基,115℃灭菌15 min。......
2023-06-24

甘露醇在海藻、海带中含量较高。海藻洗涤液和海带洗涤液中甘露醇的含量分别为2%与1.5%,是提取甘露醇的重要资源。干燥、包装结晶甘露醇于105~110℃烘干。20%甘露醇注射液是饱和溶液,为防止温度过低时结晶,配制时需保温45℃左右趁热过滤。......
2023-06-24

项目5基础会计实训认知任务一了解基础会计实训的目的与内容任务描述通过本任务的学习,了解基础会计实训的目的与内容。任务实施一、基础会计实训的目的基础会计实训是以培养学生实践技能为目的的一门必修课程。为此目的,通过基础会计实训,使学生在真实环境中进行训练,为缩小会计专业在校学生与实际会计岗位的距离、使学生成为离校即能独立上岗的应用型会计人才奠定坚实的基础。......
2023-12-01
相关推荐