灭菌乳达到商业无菌,无须冷藏,可以在常温下保存。牛乳经预热及均质后,进入板式或管式热交换器的加热段,被加压热水系统加热至 137°C。离开保温管后,灭菌乳进入无菌冷却段,被水冷却。灭菌乳在无菌条件下被连续地从管道内送往包装机。......
2023-06-15
一、生产前准备
(一)查找资料,了解红霉素生产基本知识
1.红霉素的化学结构和理化性质
红霉素是由红霉内酯、红霉糖和脱氧氨基己糖三个亚单位构成的十四元大环内酯类抗生素,也是最早使用于临床的大环内酯类抗生素(macrolide antibiotics),其化学结构如图1-2-5所示,其中根据R1和R2基团的不同,红霉素又可分为红霉素A(R1=OH,R2=OCH3)、红霉素B(R1=R2=OH)、红霉素C(R1=OH,R2=OCH3)和红霉素D(R1=H,R2=OH)四种。
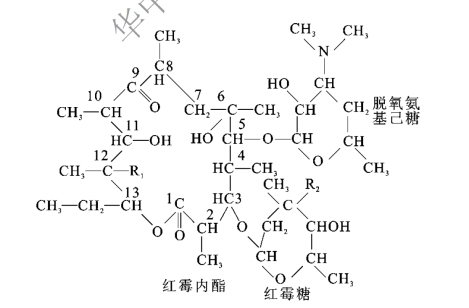
图1-2-5 红霉素分子结构图
红霉素微溶于水,易溶于有机溶剂。在碱性溶液中抗菌性能较强,在酸性溶液中易被破坏,pH<4时几乎完全失效。
2.红霉素的药用价值与作用机理
红霉素是广谱抗生素,对革兰氏阳性菌作用强,如对金黄色葡萄球菌(包括耐青霉素菌株)、溶血性链球菌、肺炎球菌、白喉杆菌、炭疽杆菌和梭菌属等有较强抗菌作用,对部分革兰氏阴性菌(如淋球菌、脑膜炎双球菌等)也较有效。临床上主要用于治疗呼吸道感染、皮肤与软组织感染、胃肠道感染等。其副作用较少,尤其适用于青霉素过敏者。
红霉素作用于50S核糖体亚单位,通过影响转肽作用和(或)阻断信使核糖核酸位移而抑制敏感细菌的蛋白质合成。红霉素对革兰氏阳性菌的作用比对革兰氏阴性菌的作用强,是因为它进入前者的量比进入后者的量大100倍左右。
口服红霉素由肠道吸收。红霉素在血中部分以游离形式存在,约有18%(也有报告42%~84%)与血清蛋白结合,相对分子质量变大,不易透过细胞膜及毛细血管而在血中储存,失去抗菌活性。红霉素血浓度下降一半所需的时间(药物在人体内的生物半衰期)为1.4~1.5h。红霉素在体内分布广泛,主要经胆汁排泄,并进行肝肠循环。仅有口服给药量的2.5%和静脉给药量的12%~15%以活性形式从尿中排出。肾功能衰退时,红霉素的血浆半衰期仅稍有延长,故其剂量可不改变,或在重度肾功能衰退时剂量略减。
(二)确定生产技术、生产菌种和工艺路线
(1)确定生产技术:微生物发酵制药技术。
(2)确定生产菌种:红色链霉菌(Streptomyces erythreus)。
(3)确定红霉素生产工艺流程。
红霉素的提取方法有溶剂萃取法、离子交换法及大孔树脂吸附法三种,目前国内外主要采用溶剂萃取法和大孔树脂吸附法,而其中溶剂萃取法所得成品生物效价不高,需通过丙酮结晶后才能达到国家药典标准,因此,可利用与中间盐沉淀相结合的工艺来进行。其发酵工艺和提取工艺流程分别如图1-2-6、图1-2-7、图1-2-8所示。

图1-2-6 红霉素发酵工艺
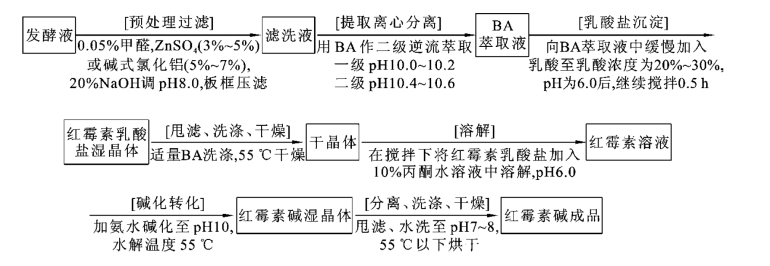
图1-2-7 溶剂萃取结合红霉素乳酸盐沉淀法的工艺流程
BA—乙酸丁酯
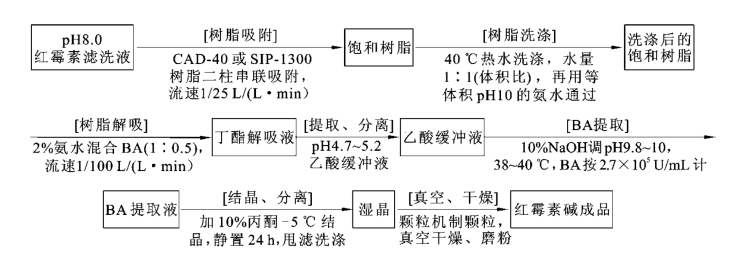
图1-2-8 大孔树脂吸附法的工艺流程
二、菌种培养
(一)红霉素生产菌的生物学特性
红霉素的生产菌是红色链霉菌,红霉素是1952年从红色链霉菌培养液中分离出来的碱性抗生素,是多组分的,其中红霉素A为有效组分,红霉素B、红霉素C为杂质。现用的红霉素生产菌在其生物合成过程中不产生红霉素B,故红霉素C为国产红霉素的主要杂质。
(二)生产孢子的制备
红霉素斜面孢子培养基组成为淀粉1.0%、硫酸铵0.3%、氯化钠0.3%、玉米浆1.0%、碳酸钙0.25%、琼脂2.2%,pH为7.0~7.2,斜面培养温度为37℃,湿度为50%左右,避光培养,因为光会抑制孢子的形成。培养7~10 d斜面上长成白色至深米色孢子,色泽新鲜、均匀、无黑色,背面产生红色色素,后转红棕色。在母瓶斜面孢子中挑选优良孢子区域或单菌落接入子瓶,37℃培养7~9 d,每批子瓶斜面孢子数应不少于1亿个。
(三)种子罐和发酵罐培养工艺
将子瓶斜面孢子制成孢子菌悬液,用微孔接种的方式接入种子罐。种子罐及繁殖罐的培养基由花生饼粉、蛋白胨、硫酸铵、淀粉、葡萄糖等组成。种子罐的培养温度为35℃,培养时间为65 h左右;繁殖罐培养温度为33℃,培养时间为40 h左右。均按移种标准检查,符合要求后才能进行移种。
发酵培养基由黄豆饼粉、玉米浆、淀粉、葡萄糖、碳酸钙、硫酸铵、磷酸二氢钾等组成。其中葡萄糖是主要的碳源(80%~85%),其次是淀粉(15%~20%),为了降低成本和节约粮食,生产上常用母液糖代替固体葡萄糖;氮源是以黄豆饼粉为主,其次是玉米浆和硫酸铵。
三、发酵过程控制
红霉素生产中需要供给溶氧,发酵罐的通气量一般为0.833~1.250 L/(L·min),增大通气量、适当提高搅拌转速会提高发酵单位,但必须加强补料,防止菌丝早衰自溶,并且搅拌转速不宜太高。
红色链霉菌对温度敏感,发酵过程温度控制在31℃,若前期33℃培养,则菌丝生长繁殖速度加快,40 h黏度即达最高峰,但衰老自溶也快,影响产量。发酵过程中维持pH6.6~7.2,菌丝生长良好,不自溶,发酵单位稳定。pH低于6.5对生物合成不利;pH高于7.2时菌丝易自溶,且会导致红霉素C比例增加,红霉素A的含量降低,影响成品质量。
为了提高红霉素的发酵单位,还需要中间补料。发酵过程中还原糖控制在1.2%~1.6%范围内,每隔6 h加入一次葡萄糖,直至放罐前12~18 h停止加糖。有机氮源一般每日补3~4次,根据发酵液黏度的大小决定补料量,若黏度低可增加补料量,黏度高则减少补料量,黏度过高还可适量补水,放罐前24 h停止补加氮源。根据红霉素生物合成途径,红霉素C转为红霉素A需要甲基供体,生产上一般以丙酸或丙醇作为前体以提高红霉素A的产量。一般在发酵开始后24~39 h,当发酵液较浓,pH高于6.5时开始补入,每隔24 h加一次,共加4~5次,总量为0.7%~0.8%。发酵后期,滴加氨水也可以提高发酵单位和成品质量。
发酵过程中,发酵液的黏度对红霉素A、红霉素C的比例有直接影响,在一定黏度范围内,红霉素C的含量与发酵液黏度呈负相关关系,因此,适当提高发酵液黏度能降低红霉素C的比例,从而保证成品质量。通过降低搅拌转速、降低罐温、增加有机氮源补给、滴加氨水等均能提高发酵液的黏度,但黏度过高又会影响溶氧浓度,导致发酵单位下降,所以须因地制宜进行发酵工艺控制。
发酵培养基中黄豆饼粉的存在会导致较多的泡沫产生,可用植物油(豆油或菜油)作消泡剂。
四、红霉素的提取工艺过程
目前一般采用0.05%甲醛和3%~5%硫酸锌溶液来沉淀蛋白质,既可以防止其在溶剂萃取时产生乳化现象,又可促使菌丝结团加快滤速。但是,硫酸锌呈酸性,而红霉素在酸性条件下会被破坏,所以要用NaOH调pH至7.2~7.8,也可用5%~7%碱式氯化铝溶液来代替硫酸锌溶液。至于乳化的防止和去除一般可利用十二烷基磺酸钠,它在碱性条件下留在水相中,不影响成品的色泽。
红霉素分子中碱性糖的二甲氨基可与乳酸成盐,从BA中析出红霉素乳酸盐,分离掉溶剂,将此盐溶解于丙酮水中,加氨水碱化转化为红霉素碱,洗涤干燥后的成品纯度可达930~960 U/mg,与单纯溶剂法相比,省去了丙酮重结晶等处理环节。
用大孔吸附树脂CAD-40或SIP-1300等作为吸附剂,从溶液中吸附红霉素,收率接近100%,可以代替一次BA萃取来提取红霉素,以后的工序可采用二次BA萃取工艺,也可采用红霉素乳酸中间盐转红霉素结晶的工艺路线,提取总收率相当或高于溶剂法,成品效价(一次结晶)在935 U/mg以上。
五、红霉素含量测定
(一)紫外分光光度计测定
(1)标准曲线的制备 精密称取红霉素对照品适量,加甲醇溶液溶解,移入50 mL容量瓶中并稀释至刻度。分别精密吸取(精密吸取是指量取体积的准确度应符合国家标准中对该体积移液管的精度要求)0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL、3.5 mL、4.0 mL、4.5 mL、5.0 mL,置于10 mL容量瓶中,加龙胆紫溶液25 mL并用硼酸盐缓冲液(pH8.5)稀释至刻度。同法以试剂做空白对照,在633.2 nm波长处测定吸光度,求出回归方程。
(2)含量测定 精密称取红霉素样品适量,加甲醇溶液溶解并稀释至刻度,摇匀,移取2.0 mL,置于25 mL容量瓶中,其余同上。将测得吸收度值代入回归方程,求出含量。
(二)HPLC方法测定
(1)色谱条件 色谱柱为Sinochrom ODS-BP C18(4.6 mm×250 mm,5 μm);流动相为0.1 mol/L磷酸二氢铵溶液(三乙胺调节pH6.5)-乙腈(70∶30);流速为1.0 mL/min;检测波长为215 nm;进样量为20μL。在上述条件下,测得红霉素标准品溶液色谱图,红霉素的保留时间为6.5 min,与杂质峰的分离度均大于1.5。
(2)对照品溶液制备 精密称取红霉素标准品325 mg,置于50 mL容量瓶中,加流动相溶解并稀释至刻度,摇匀,配成对照品储备液,再精密量取2 mL,置于25 mL容量瓶中,加流动相配制成1 mL含红霉素0.5 mg的对照品溶液。
(3)绘制标准曲线 分别精密量取上述对照品溶液0.5 mL、1.0 mL、2.0 mL、4.0 mL、8.0 mL、12.0 mL、16.0 mL至25 mL容量瓶中,加流动相至刻度。分别进样20 μL,记录色谱图。以峰面积对进样量绘制标准曲线,求出回归方程。
(4)测定 精密称取样品5 g,置于分液漏斗中,加石油醚80 mL,缓慢振摇,使基质溶解,用磷酸盐缓冲液(pH6.0)提取4次,每次约25 mL,合并提取液,置于100 mL容量瓶中,用磷酸盐缓冲液(pH7.0)稀释至刻度,摇匀,配制成1 mL含红霉素0.5 mg的供试品溶液。与对照品同法测定,利用标准曲线计算样品浓度。
有关生物制药工艺(第2版)的文章

灭菌乳达到商业无菌,无须冷藏,可以在常温下保存。牛乳经预热及均质后,进入板式或管式热交换器的加热段,被加压热水系统加热至 137°C。离开保温管后,灭菌乳进入无菌冷却段,被水冷却。灭菌乳在无菌条件下被连续地从管道内送往包装机。......
2023-06-15

熔剂生产是有毒有害作业 熔剂成分中多为各种氯化物、氟化物、氧化物。熔剂生产是噪声环境下的作业 配制熔剂的各种原材料要经过破碎、磨细、筛分等工序,各种破碎机、磨粉机、筛分机及抽排风机、集尘设备开动时,在生产现场发出高分贝的不同频度的噪声。在有毒有害作业现场 氯气、六氯乙烷等氯化物及氟化物的气体;铍的氧化物以及粉尘对操作者的呼吸道都有不同程度的危害,可能诱发呼吸系统慢性疾病。......
2023-06-26

2)为减少销售和生产成本,集中优势力量开发产品,提高竞争力,近年来,企业改组、并购活动十分活跃。3)产品由单件销售向成套供应发展,螺纹插装阀供应商有望向兼产叠加阀、管式阀等方向发展。2)生产的平衡阀的质量与可靠性在市场上口碑居首。4)螺纹插装阀插孔标准独特,自成派系,经过市场考验反而被其他生产商接受或部分接受。......
2023-06-22

图8-2 电线电缆包覆挤出成型生产线1—芯线 2—芯线预热处理 3—抽真空管 4—单螺杆挤出机 5—机头 6—冷却水槽 7—测试仪 8—绞盘 9—卷绕电线电缆包覆挤出成型工艺流程:放线装置→芯线调直装置→芯线预热筒→抽真空接管→包覆机头→单螺杆挤出机→冷却水槽→电火花测试仪与外径测试→长度计量→自动排线→绞盘。图8-3 电线、电缆包覆挤出成型生产设备1)放线装置。一般选用直角机头,便于芯线通过。用于检测包覆质量。......
2023-06-15

图7-43 圆网生产工艺流程及设备平网机头设计 平网成型机头中的上、下模板内是衣架式熔料流道,上、下口模由偏心轴带动,能在齿条上左右移动,完成成型和平网丝的粘接成型工作。成型机头由机头体3、梳板4、导板1、偏心轴2等组成。......
2023-06-15

子任务二麦芽的制取把大麦制成麦芽,称为麦芽制取。图2.3麦芽制取工艺流程一、大麦的预处理(一)大麦的后熟与储藏新收获的大麦有休眠期,发芽率较低,只有经过一段时间的后熟期才能达到应有的发芽力,一般后熟期需要6~8周。为减少呼吸消耗,大麦水分应控制在12.5%以下,温度在15℃以下。......
2023-12-07

确定链霉素生产工艺流程,如图1-2-10所示。链霉素是一种高极性并有很强亲水性的有机碱,整个分子成为一个三价盐基强碱。链霉素易溶于水,难溶于有机溶剂。适合于菌丝生长的pH为6.5~7.0,适合于链霉素合成的pH为6.8~7.3,pH低于6.0或高于7.5,都对链霉素的生物合成不利。......
2023-06-24

药芯焊丝CO2焊是一种气渣联合保护的弧焊方法,如图1-5-49所示。图1-5-49 药芯焊丝CO2焊示意图1—导电嘴 2—药芯焊丝 3—喷嘴 4—保护气体 5—电弧 6—熔池 7—熔渣 8—焊缝金属1.焊接工艺性能好与实心焊丝CO2焊相比,药芯能改变熔滴过渡形态,细化熔滴,药芯焊丝CO2焊时电弧稳定、飞溅很小且焊缝成形美观,可全位置焊,而且气渣联合保护提高了抗气孔的能力。......
2023-06-26
相关推荐