能劳动的人们无力购买机器原料等;能购买机器原料与开设工厂的人们,又不得不雇佣别人来从事生产。因此,劳动与生产,表现出相对的分离。但是,仅有劳动或者仅有机器原料等,生产终是不能成立。一旦销路停滞,生产过剩则群趋于停工关厂,或者缩小范围。......
2023-08-17
一、生产前准备
(一)查找资料,了解青霉素生产基本知识
青霉素(benzylpenicillin,penicillin)又称盘尼西林、配尼西林,包括常称的青霉素G、青霉素钠、苄青霉素钠、青霉素钾、苄青霉素钾。青霉素是抗生素的一种,是指从青霉菌培养液中提取的分子中含有青霉烷、能破坏细菌的细胞壁并在细菌细胞的繁殖期起杀菌作用的一类抗生素。青霉素类抗生素是β-内酰胺类中一大类抗生素的总称。
最初的青霉素生产菌是野生型青霉菌,生产能力只有几十个单位,不能满足工业需要。随后找到了适合于深层培养的橄榄形青霉菌,即产黄青霉(Penicillium.chrysogenum),生产能力为100 U/mL。经过X射线、紫外线诱变,生产能力达到1000~1500 U/mL。随后经过诱变,得到不产生色素的变种,目前生产能力可达66000~70000 U/mL。青霉素是抗生素工业的首要产品。中国为青霉素生产大国,国内生产的青霉素已占世界产量的近70%,国内较大规模的生产企业有华北制药、哈医药、石药、鲁抗医药,单个发酵罐规模均在100 m3以上,发酵单位在70000 U/mL左右,而青霉素工业发酵世界先进水平达100000 U/mL以上。
1.青霉素的作用机理
作用于细胞壁合成中的肽多糖合成的第三阶段,线形肽多糖在转肽酶的催化下进行交联,肽多糖链之间每两条肽链结合时均释放出一个D-丙氨酸,青霉素中与肽多糖的D-丙氨酰-D-丙氨酸二肽相似,竞争性地与转肽酶结合,使转肽酶不能催化多肽链之间的交联。
2.青霉素的分子结构及其衍生物
青霉素的基本母核为β-内酰胺环和噻唑烷环并联组成的N-酰基-6-氨基青霉烷酸,侧链上的R基可为不同的取代基,如图1-2-1所示。侧链基团不同,形成不同的青霉素,主要是青霉素G(见图1-2-2)。工业上应用的有青霉素钠、青霉素钾、普鲁卡因、二苄基乙二胺盐。
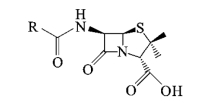
图1-2-1 青霉素母核

图1-2-2 青霉素G
3.青霉素的理化性质
青霉素是一种游离弱酸,能与碱金属或碱土金属及有机胺类结合成盐类。青霉素游离酸易溶于醇类、酮类、酯类和醚类,但在水中溶解度很小,青霉素钾、钠盐易溶于水和甲醇,而不溶于丙醇、丙酮、氯仿等。工业上通过将青霉素G游离酸与乙酸钾反应生成钾盐,使之从乙酸丁酯相中结晶析出,可得到高纯度的青霉素G钾盐。
青霉素具有一定的吸湿性,吸湿性的大小与内在质量有关,纯度越高,吸湿性越小,也越易于存放。通常情况下,固体青霉素盐的稳定性与其含水量和纯度有很大关系,干燥、纯净的青霉素很稳定,青霉素的水溶液则很不稳定,而且受pH和温度的影响很大,温度升高或在酸性、碱性条件下分解更快,见表1-2-2。
表1-2-2 pH和温度对青霉素G钠盐结晶水溶液半衰期的影响

4.青霉素的应用
青霉素问世以来,临床上主要用于控制敏感金黄色葡萄球菌、链球菌、肺炎双球菌、淋球菌、脑膜炎双球菌、螺旋体等引起的感染,对大多数革兰氏阳性菌(如金黄色葡萄球菌)和某些革兰氏阴性菌及螺旋体有抗菌作用。青霉素的优点是毒性小,但由于难以分离除去青霉噻唑酸蛋白(微量可能引起过敏反应),因此需要皮试。青霉素的缺点是对酸不稳定,不能口服,排泄快,对大多数阴性菌效果较差。而半合成青霉素——氨苄青霉素则耐酸广谱,对抗绿脓杆菌的磺苄青霉素耐酸、耐酶;由6-氨基青霉素烷酸化学半合成的可口服又可注射的乙氧萘青霉素对酸和青霉素酶稳定。
5.青霉素生产菌的生物学特性
(1)生物学特性 现国内青霉素生产厂大都采用绿色丝状菌,形成绿色孢子和黄色孢子的两种产黄青霉菌株;深层培养中菌丝形态为球状和丝状两种,我国生产上采用的是丝状。菌落平坦或皱褶,圆形,边沿整齐或锯齿或扇形。气生菌丝形成大小梗,上生分生孢子,排列呈链状,似毛笔,称为青霉穗。孢子黄绿色至棕灰色,圆形或圆柱形。
(2)发酵条件下的生长过程 产黄青霉菌的生长分为三个代谢阶段。
第一阶段:菌丝生长繁殖期,这个时期培养基中糖及含氮物质被迅速吸收,丝状菌孢子发芽长出菌丝,菌丝浓度增加很快,此时青霉素分泌量很少。
第1期:分生孢子萌发,形成芽管,原生质未分化,具有小泡,分支旺盛。第2期:菌丝繁殖,原生质体具有嗜碱性,类脂肪小颗粒。第3期:形成脂肪包含体,积累储藏物,没有空泡,嗜碱性很强。
第二阶段:青霉素分泌期,这个时期菌丝生长趋势减弱,间隙添加葡萄糖作碳源和花生饼粉、尿素作氮源,并加入前体,此期间丝状菌pH要求6.2~6.4,青霉素分泌旺盛。
第4期:脂肪包含体形成小滴并减少,形成中小空泡,原生质体嗜碱性减弱,开始产生抗生素。第5期:形成大空泡,有中性染色大颗粒,菌丝呈桶状,脂肪包含体消失,青霉素产量最高。
第三阶段:菌丝自溶期,此时丝状菌的大型空泡增加并逐渐扩大自溶。
第6期:出现个别自溶细胞,细胞内无颗粒,仍然呈桶状。释放游离氨,pH上升。第7期:菌丝完全自溶,仅有空细胞壁。
按显微镜检查菌丝形态变化或根据发酵过程中生化曲线测定进行补糖,这样既可以调节pH,又可以提高和延长青霉素发酵单位。除补糖外,氮源的补加也可以提高发酵单位,控制发酵。1~3期为菌丝生长期,3期的菌体适宜为种子。4~5期为生产期,生产能力最强,通过工程措施延长此期,以获得高产。在第6期到来之前结束发酵。
(二)确定生产技术、生产菌种和工艺路线
(1)确定生产技术:微生物发酵技术。
(2)确定生产菌种:产黄青霉(P.chrysogenum)。
(3)确定青霉素的发酵工艺流程,如图1-2-3所示。
二、菌种培养
(一)生产孢子的制备
将砂土保藏的孢子用甘油、葡萄糖、蛋白胨组成的培养基进行斜面培养,经传代活化。最适生长温度在25~26℃,培养6~8 d,得单菌落,再转斜面,培养7~9d,得斜面孢子。移植到优质小米(或大米)固体培养基上,25℃生长6~7 d,制得小米孢子。
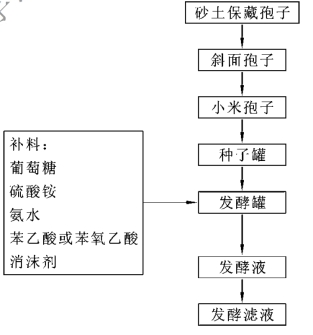
图1-2-3 青霉素发酵生产工艺流程图
(二)种子罐和发酵罐培养工艺
青霉素大规模生产时采用三级发酵。一级发酵通常在小罐中进行,将生产孢子按一定接种量移入种子罐内,25℃培养40~45 h,菌丝浓度达40%(体积分数)以上,菌丝形态正常,即移入繁殖罐内,此阶段主要是让孢子萌芽形成菌丝,制备大量种子供发酵用。二级发酵主要是在一级发酵的基础上使青霉菌菌丝体继续大量繁殖,通常在25℃培养13~15 h,菌丝浓度达40%以上,残糖在1.0%左右,无菌检查合格便可作为种子,按30%接种量移入发酵罐,此时的发酵为三级发酵,除了继续大量繁殖菌丝外主要是生产青霉素。产黄青霉菌发酵条件列于表1-2-3中。
表1-2-3 产黄青霉菌发酵条件

三、青霉素的发酵过程控制
在青霉素的生产中,让培养基中的主要营养物只够维持青霉菌在前40 h生长,而在40 h后,靠低速连续补加葡萄糖和氮源等,使菌处于半饥饿状态,延长青霉素的合成期,可大大提高产量。所需营养物限量的补加常用来控制营养缺陷型突变菌种,使代谢产物积累到最大量。
(一)培养基
青霉素发酵中采用补料分批操作法,对葡萄糖、铵盐、苯乙酸进行缓慢流加,维持一定的最适浓度。葡萄糖流加时波动范围较窄,浓度过低使抗生素合成速度减小或停止,过高则导致呼吸活性下降,甚至引起自溶,葡萄糖浓度是根据pH、溶氧或CO2释放率予以调节。
(1)碳源的选择 生产菌能利用多种碳源,如乳糖、蔗糖、葡萄糖、阿拉伯糖、甘露糖、淀粉和天然油脂。葡萄糖、乳糖结合能力强,而且随时间延长而增加,所以通常采用葡萄糖和乳糖。可根据形态变化滴加葡萄糖。
(2)氮源 玉米浆是最好的氮源,含有多种氨基酸及其前体苯乙酸和衍生物。玉米浆质量不稳定,可用花生饼粉或棉籽饼粉取代。可补加无机氮源。
(3)无机盐 需要硫、磷、镁、钾等。铁有毒,控制浓度在30 μg/mL以下。
(4)流加控制 补糖:根据残糖、pH、尾气中CO2和O2含量控制。残糖在0.6%左右,pH开始升高时加糖。补氮:流加硫酸铵、氨水、尿素,控制氨基氮浓度在0.05%。添加前体:在合成阶段,苯乙酸及其衍生物,苯乙酰胺、苯乙胺、苯乙酰甘氨酸等均可为青霉素侧链的前体,直接掺入青霉素分子中,也具有刺激青霉素合成作用,但浓度大于0.19%时对细胞和合成有毒性,还能被细胞氧化。策略是流加低浓度前体,一次加入量低于0.1%,保持供应速率略大于生物合成的需要。
(二)温度
生长适宜温度为30℃,分泌青霉素温度为20℃。20℃下青霉素破坏少,周期很长。生产中采用变温控制,不同阶段采用不同温度。前期控制在25~26℃,后期降温到23℃。过高则会降低发酵产率,增加葡萄糖的维持消耗量,降低葡萄糖至青霉素的转化得率。有的发酵过程在菌丝生长阶段采用较高的温度,以缩短生长时间,生产阶段适当降低温度,以利于青霉素合成。
(三)pH
青霉素合成的适宜pH为6.4~6.6,避免超过7.0,青霉素在碱性条件下不稳定,易水解。缓冲能力弱的培养基中,pH降低,则意味着加糖率过高而造成酸性中间产物积累;pH上升,说明加糖率过低,不足以中和蛋白质产生的氨或其他生理碱性物质。前期pH控制在5.7~6.3,中后期pH控制在6.3~6.6,通过补加氨水进行调节。pH较低时,加入CaCO3、通氨调节或提高通气量。pH上升时,加糖或天然油脂。一般直接加酸或碱自动控制,流加葡萄糖控制。
(四)溶氧
溶氧低于30%饱和度时,产率急剧下降,低于10%饱和度时,则造成不可逆的损害。所以溶氧浓度不能低于30%饱和度。通气量(指每分钟通气体积与料液体积的比值)一般为1.25 L/(L·min)。溶氧过高,菌丝生长不良或加糖率过低,呼吸强度下降,影响生产能力的发挥。维持适宜的搅拌速度,保证气液混合,提高溶氧,根据各阶段的生长和耗氧量不同,调整搅拌转速。
(五)菌丝生长速度与形态、浓度
对于每个有固定通气和搅拌条件的发酵罐内进行的特定好氧过程,都有一个使氧传递速率(OTR)和氧消耗速率(OUR)在某一溶氧水平上达到平衡的临界菌丝浓度,超过此浓度,OUR>OTR,溶氧水平下降,发酵产率下降。在发酵稳定期,湿菌可达15%~20%,丝状菌干重约为3%,球状菌干重在5%左右。
(六)消泡
发酵过程泡沫较多,需补入消泡剂,包括天然油脂(如玉米油)、化学消泡剂。少量多次。前期不宜多加入,以免影响呼吸代谢。
四、青霉素的提取工艺过程
青霉素不稳定,发酵液预处理、提取和精制过程要条件温和、快速,防止降解,提取工艺流程如图1-2-4所示。从发酵液中提取青霉素,早期曾使用过活性炭吸附法,目前多采用溶剂萃取法。由于青霉素性质不稳定,整个提取过程应在低温下、快速、严格控制pH下进行,注意对设备清洗消毒时减少污染,尽量避免或减少青霉素效价的破坏损失。
(一)预处理
发酵液在萃取之前需预处理。发酵液加少量絮凝剂沉淀蛋白质,然后经真空转鼓过滤或板框过滤,除掉菌丝体及部分蛋白质。青霉素易降解,发酵液及滤液应冷至10℃以下,过滤收率一般在90%左右。
(二)过滤
菌丝体粗长10μm,采用鼓式真空过滤机过滤,滤渣形成紧密饼状,容易从滤布上刮下。滤液pH为6.2~7.2,蛋白质含量为0.05%~0.2%。需要进一步除去蛋白质。
(三)萃取
(1)一次BA(乙酸丁酯)萃取 用1.5%硫酸调节pH至2.0~2.2,按1∶(3.5~4.0)(体积比)加入BA及适量破乳剂,在5℃左右进行逆流萃取。

图1-2-4 青霉素提取工艺流程图
(2)一次水提取 按1∶(4~5)(体积比)加入1.5%NaHCO3缓冲液(pH6.8~7.2),5℃左右进行逆流萃取。
(3)二次BA萃取 用1.5%硫酸调节pH至2.0~2.2,按1∶(3.5~4.0)(体积比)加入BA及适量破乳剂,在5℃左右进行逆流萃取。
(四)脱色
每升萃取液中加入150~250g活性炭,搅拌15~20 min,过滤。
(五)结晶
加25%乙酸钾丁醇溶液,真空度大于0.095 MPa、温度为45~48℃共沸蒸馏结晶,得到青霉素钾盐,水和丁醇形成共沸物而蒸出,盐结晶析出。晶体经过洗涤、干燥后,得到青霉素产品。
五、青霉素钠的含量测定方法
(1)碘量法测定 精密称定样品5 g,溶解后置于100 mL容量瓶中,稀释至刻度,即为供试液,精密量取5 mL,置于碘瓶中,加1 mol/L的氢氧化钠溶液放置20 min,再加1 mL 1 mol/L盐酸和5 mL pH 4.5的乙酸钠缓冲液,精密加入0.01 mol/L碘滴定液15 mL,密塞,摇匀,在20~25℃暗处放置20 min,用0.01 mol/L硫代硫酸钠滴定液滴定,至近终点时加淀粉指示剂,继续滴定至蓝色消失。
另精密量取供试液5 mL,置于碘瓶中,加缓冲液5 mL,精密加入碘滴定液15 mL,同法操作,作为空白。
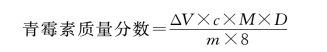
式中,ΔV为硫代硫酸钠溶液减少的体积;c为硫代硫酸钠溶液的浓度;M为青霉素的摩尔质量;D为稀释倍数;m为样品质量。
(2)高效液相色谱法 色谱条件与系统适用性试验:用十八烷基硅烷键合硅胶为填充剂,以0.1 mol/L磷酸二氢钾溶液(用磷酸调节pH至2.5)-乙腈(70∶30)为流动相,检测波长为225 nm,流速为1.0 mL/min。取青霉素对照品和2-苯乙酰胺各适量,加水制成1 mL中含各约0.2 mg的混合溶液,取20μL注入高效液相色谱仪,记录色谱图,色谱峰流出顺序为2-苯乙酰胺、青霉素。两峰之间的分离度应不小于2.0,理论板数按青霉素峰计算不低于1600。
有关生物制药工艺(第2版)的文章

能劳动的人们无力购买机器原料等;能购买机器原料与开设工厂的人们,又不得不雇佣别人来从事生产。因此,劳动与生产,表现出相对的分离。但是,仅有劳动或者仅有机器原料等,生产终是不能成立。一旦销路停滞,生产过剩则群趋于停工关厂,或者缩小范围。......
2023-08-17

超临界流体具有与液体相近的密度,黏度较低,扩散性好,这使得其与高分子熔体在工业生产条件下的混合成为可能。2)将超临界流体作为发泡剂给工业化生产增加了很大的难度。如CO2的临界温度为31.3℃,临界压力为7.37MPa,尽管这是可以实现的,但所需设备将变得复杂,在将超临界流体加入到塑料熔体起到发生发泡为止这一段时间、区间内,流体必须始终处于其温度和压力的临界点之上,这使得加工工艺十分复杂、更难控制。......
2023-07-02

1.防潮湿设计采用喷涂、浸渍、灌封、憎水等工艺对重要器件进行防水处理。2.防霉设计控制环境条件来抑制霉菌生长,如采用防潮、通风、降温等措施。3.防盐雾设计采用密封结构。④ 关键的金属结构件,全部采用热镀锌板或不锈钢板,增强防盐雾腐蚀能力,提高机械使用寿命。......
2023-10-23

与常规的多效蒸发相比,MVR工艺技术应用于NMMO回收有三个突出的优点:回收产品的质量好、设备运行能耗低和投资成本少。MVR技术可以较大幅度地降低设备投资成本,Lyocell纤维溶剂回收中大都采用并流式多效蒸发工艺,这一工艺的特点是物料借助各效间的压力差流动。MVR系统不存在传热效率降低的问题,因此,不仅减少热交换器的面积,进而节约了近50%的建筑面积,使MVR整体的投资成本比多效蒸发下降了近17%。......
2023-06-25

焊接工艺是与制造焊件有关的加工方法和实施要求,包括焊接准备、材料选用、焊接方法选定、焊接参数、操作要求等。焊条电弧焊工艺具有灵活与严格两重性。通常都要经过焊接工艺评定合格后确定焊接参数,并不得随意更改。焊接工艺制定前要对设计图样的焊接工艺性进行审查,识别新材料、新工艺、新设备和特殊要求,提出试验项目、焊接工艺评定项目及焊工培训项目。焊接完成后的工艺控制 包括焊后热处理、无损检测、焊缝表面处理等。......
2023-06-25

UASB反应器中废水为上向流,最大特点是在反应器上部设置了一个特殊的气、液、固三相分离系统,三相分离器的下部是反应区。气、液、固的混合液上升至三相分离器内,气体可被收集,污泥和水则进入上部相对静止的沉淀区,在重力作用下,水与污泥分离,上清液从沉淀区上部排出,污泥被截留在三相分离器下部并通过斜壁返回到反应区内。图9-8UASB反应器中沿高度的污泥浓度分布示意图较低水力负荷;较高水力负荷......
2023-06-19

熔焊过程中,如何降低大量的有害气体、有害烟尘、噪声等对周围环境和人员的伤害,各个国家都在研究、生产低烟尘、低毒性的焊接材料。随着焊接工业化水平的不断提高,熔化极气体保护焊在制造业中应用日益广泛。然而,熔化极气体保护焊因飞溅大、成形差等原因,严重影响其焊接质量及推广。目前,纳米活性剂的使用,可以有效地改善焊接熔滴过渡方式,稳定电弧、改善焊缝成形和降低焊接飞溅等。......
2023-06-15
相关推荐